小体鲟卵透明带家族ZP3亚型和ZPAX基因cDNAs克隆及其组织表达分析
2018-08-01东天朱华王巍董颖田照辉胡红霞
东天,朱华,王巍,董颖,田照辉,胡红霞
(北京市水产科学研究所 渔业生物技术北京市重点实验室,北京 100068)
脊椎动物卵细胞被细胞膜外糖蛋白基质包裹,在哺乳动物中,称为透明带(zona pellucid, ZP),在鸟类中称其为卵周膜(perivitelline membrane),在两栖类中俗称卵黄膜(vitelline envelope),在鱼类中则称之为浆膜(chorion)[1]。1992年,Bork等[2]首次发现了ZP蛋白家族高度保守的ZP结构域特征,随后,研究者证实,ZP蛋白由N端信号肽序列、ZP结构域、furin蛋白酶切割位点、跨膜功能域(TMD)和C端疏水基团等构成[3-5]。哺乳动物ZP蛋白的功能主要是介导精卵识别,诱发顶体反应,促使质膜融合以防止多精受精,保护早期未着床胚胎正常发育等[6]。与哺乳动物不同,硬骨鱼类ZP蛋白在受精过程中主要从结构上对卵细胞提供了机械性的保护:受精时,ZP蛋白可指引单个精子穿过位于动物极的卵孔(micropyle)直接进入卵膜,同时形成受精锥(fertilization cone)堵塞在卵孔处以防止多精受精[7-9]。脊椎动物ZP蛋白由多个ZP基因编码,由于ZP基因的命名相对混乱,研究人员根据命名系统及氨基酸序列同源性将其划分为6个基因亚家族:ZPA/ZP2、ZPB/ZP4、ZPC/ZP3、ZP1、ZPAX和ZPD亚家族[10]。研究发现,哺乳动物基因组中一般包含3~4个ZP基因,两栖类及鸟类包含5~6个ZP基因,鱼类至少存在7个编码ZP蛋白的基因[5,8,10-11]。
ZP3隶属卵透明带家族(zona pellucida superfamily)中的一员,是哺乳动物卵母细胞透明带的主要蛋白成分之一,已被证实具有结合精子并引发顶体反应的功能[12-13]。Kanamori[14]对发育早期的青鳉Oryziaslatipes胚胎cDNA片段进行Southern杂交时,首次发现了一个在C端与ZPA结构域高度同源但其余氨基酸序列同源性较低的基因;随后,Lindsay等[15]在发育早期的非洲爪蟾Xenopuslaevis胚胎中也检测到了具有类似特征的基因,命名为ZPAX基因,该基因与ZPA高度同源,推测其可能
为ZPA和ZPB基因的祖先。目前,研究者已克隆获得青鳉、鲤Cyprinuscarpio、斑马鱼Daniorerio、银鲫Cauratusgibelio、齐口裂腹鱼Schizothoraxprenanti等动物的ZP3 cDNA序列,并证明ZP3是构成鱼类卵壳的主要蛋白之一[16-20]。目前,已获得ZPAXcDNA序列的物种包括热带爪蟾Xenopustropicalis、罗非鱼Oreochromismossambicus、中华鲟Acipensersinensis、原鸡Gallusgallus等动物[9,21]。有研究表明,不同物种ZP蛋白的表达组织不同,哺乳动物ZP蛋白主要在卵巢中表达[5,22];鱼类ZP蛋白表达的部位略有不同,青鳉、虹鳟Oncorhynchusmykiss、美洲拟鲽Pseudopleuronectesamericanus等鱼类ZP蛋白合成发生在肝脏中[23-25];而鲤科鱼类,如斑马鱼和鲤鱼ZP蛋白在卵巢中合成[18,26]。
小体鲟Acipenserruthenus隶属于硬骨鱼纲Osteicthyes、辐鳍亚纲Actinopterygii、鲟形目Acipenseriformes,是目前世界上最古老的鱼类之一,具有极高的养殖经济价值[27]。小体鲟个体较小、生长速度快、繁殖周期相对较短,是研究鲟科鱼类生长和繁殖等经济性状调控机制的主要模式物种。目前,ZP基因家族在鲟上的研究尚处于起步阶段,其在鲟鱼性腺发育、卵子发生及精卵结合等过程中所发挥的作用尚不明确,仅有文献报道成功克隆出中华鲟AsZP3 3种亚型(AsZP3.1、AsZP3.2、AsZP3.3)、AsZPB和AsZPAX基因cDNA全长序列,并发现AsZP3 3种亚型、AsZPB和AsZPAX基因在4龄雌鱼卵巢中高表达,AsZP3 3种亚型在3龄雄鱼精巢中高表达,且AsZP3基因不同亚型之间表达水平呈现时空差异[9,11]。本研究课题组前期在小体鲟性腺转录组测序结果中筛选到ArZP3及ArZPAX基因具有雌、雄特异表达特点。基于上述研究结果,本研究中首次克隆得到小体鲟ArZP3 3种亚型及ArZPAX基因部分cDNA序列,并对其在各组织中的分布进行分析,旨在为研究ZP3及ZPAX基因在小体鲟性腺发育、卵子发生等过程中的作用和机制奠定理论基础。
1 材料与方法
1.1 材料
试验用小体鲟取自北京市水产科学研究所国家级鲟良种场。选择2尾5龄小体鲟(雌、雄各1尾,性腺发育阶段均为Ⅳ期),取雌鱼的卵巢、肝、脑、肠、肾、脾、心、肌肉、皮和鳃,以及雄鱼的精巢样品作为试验材料。其中,卵巢样品用于基因克隆试验;卵巢、精巢、肝、脑、肠、肾、脾、心、肌肉、皮和鳃等共11种样品用于组织表达特异性分析试验,所有样品均于超低温冰箱(-80 ℃)中储藏备用。
RNeasy mini kit RNA提取试剂盒购自Qiagen公司;Trizol Reagent、DNaseI、RT-PCR 反转录试剂盒购自Invitrogen公司;pGM-19T Vector 载体连接试剂盒、E.coliDH5α感受态细胞、MiniBEST胶回收试剂盒购自TaKaRa公司;PCR引物由北京擎科新业生物技术有限公司合成;其他常规试剂由北京市水产科学研究所提供。
1.2 方法
1.2.1 引物合成及测序 借助Primer 3.0、DNAMAN和Oligo 6.0软件设计的试验用引物如表1所示。表1中不同基因中间片段引物ArZP3-1-F/R、ArZP3-4-F/R、ArZP3-5-F/R和ArZPAX-F/R,是根据GenBank上登录的中华鲟AsZP3 3种亚型(AC054852、AC054853、HM067972)cDNA序列、中华鲟AsZPAX(JF751060)cDNA序列,以及课题组前期性腺转录组测序结果比对出的小体鲟ArZP3 3种亚型、ArZPAX基因保守片段进行设计;ArZP3-1-qF/R、ArZP3-4-qF/R和ArZPAX-qF/R为组织表达特异性分析半定量PCR目的基因引物;18S-qF/qR为组织表达特异性分析半定量PCR内参基因引物。所有引物合成及序列测定均由北京擎科新业生物技术工程有限公司完成。将引物用无菌水溶解至10 pmol/μL浓度,于4 ℃下过夜保存后使用。
1.2.2 小体鲟ArZP3 3种亚型及ArZPAXcDNA保守片段的克隆
(1)总RNA提取及反转录。使用Qiagen公司RNeasy mini kit试剂盒提取小体鲟11种组织(卵巢、精巢、肝、脑、肠、肾、脾、心、肌肉、皮、鳃)总RNA,用匀浆仪对组织充分研磨匀浆,在RNase-Free DNase set柱上处理基因组,用紫外分光光度计测定OD值,保证总RNA样本的OD260 nm/OD280 nm值为1.8~2.2,用琼脂糖凝胶电泳检验RNA 的完整性。以提取的总RNA为模板,按照SuperScript Ⅲ First-Strand Synthesis System for RT-PCR(Invitrogen)试剂盒说明书的步骤,以Oligo (dT) 20为引物进行反转录,合成cDNA第一链。反转录产物可直接用于PCR 扩增或于-20 ℃下保存备用。
(2)cDNA保守片段克隆。以雌性小体鲟卵巢总RNA反转录得到的cDNA第一链为模板,使用引物ArZP3-1-F/R、ArZP3-4-F/R、ArZP3-5-F/R和ArZPAX-F/R扩增目的基因的保守片段。PCR反应体系包括:10×Ex Taq buffer 4 μL,25 mmol/L MgCl23.2 μL,2.5 mmol/L dNTPs 2.4 μL,10 pmol/μL上、下游引物各1.2 μL,5 U/μL Ex Taq 0.4 μL,cDNA模板2.0 μL,用ddH2O补足至40 μL。反应程序为:95 ℃下预变性5 min;95 ℃下变性30 s, 退火30 s,72 ℃下延伸2 min,共进行35个循环;最后在72 ℃下再延伸10 min。PCR产物经15 g/L琼脂糖凝胶电泳,用TaKaRa胶回收试剂盒对目的片段进行纯化,纯化产物与pMD-19T载体连接后,转化至大肠杆菌DH5α感受态细胞中,经过蓝白斑菌筛选,最后挑取单个白色菌落过夜培养,通过对菌液鉴定挑选阳性菌液进行测序。

表1 试验所用引物序列及相应退火温度
(3) 序列分析、同源性比对和系统发育树的构建。对测序正、反向片段进行拼接,将拼接结果在GenBank上进行Blast序列比对,通过DNAMAN软件预测其氨基酸序列,使用MegAlign软件进行物种间氨基酸序列比对和同源性分析,采用MEGA 5.2软件构建系统发育树(邻接法,NJ法)[28]。用于同源性比对及系统发育树构建的其他物种氨基酸序列包括:人(Homosapiens,HsZP1, NP_997224;HsZP2.1,NP_003451;HsZP2.2,NP_001277033;HsZP3,AAA61336;HsZP4, NP_067009)、小鼠(Musmusculus,MmZP3, NP_035906)、大鼠(Rattusnorvegicus,RnZP1, NP_445961;RnZP2, NP_112412;RnZP3, NP_446214;RnZP4, NP_758833)、鸭嘴兽(Ornithorhynchusanatinus,OaZPAX, XP_001514402)、原鸡(Gallusgallus,GgZP1, NP_990014;GgZP2, NP_001034187;GgZP3, NP_989720;GgZPB, BAA76739;GgZPD, BAD13713;GgZPAX, NP_001039302)、非洲爪蟾(Xenopuslaevis,XlZP3, NP_001081657)、热带爪蟾(Xenopustropicalis,XtZP2, NP_988855;XtZP3, NP_001107471;XtZPB, AAL86571;XtZPD, AAL86573;XtZPAX, AAL86574)、斑马鱼(Daniorerio,DrZP2, AAD49112;DrZP3, NP_571406;DrZP3a.1, AAI16532;DrZP3a.2, NP_001025291;DrZP3b, AAH67692;DrZP3c1, CAX14369;DrZP3c2,CAP09495;DrZPAX, AAI24758)、罗非鱼(Oreochromisniloticus,OnZPAX, XP_003446420)、鲤(Cyprinuscarpio,CcZP2.1, CAA96572;CcZP2.2, CAA96573;CcZP3, CAA88836)、鲫(Carassiusauratus,CaZP2, CAA96576;CaZP3, CAA88838)、青鳉(Oryziaslatipes,OlZPB, AAD38905;OlZPC1, NP_001098218;OlZPC2,AAN31189;OlZPC3, NP_001098219;OlZPC4, NP_001098220;OlZPC5, AAD38910;OlZPAX, AAN31186)、虹鳟(Oncorhynchusmykiss,OmZP2.3, NP_001118072)、黑头软口鲦(Pimephalespromelas,PpZP3, AAG28398)、半滑舌鳎(Cynoglossussemilaevis,CsZP3a, ABY81290;CsZP3b, ABY81291)、中华鲟(Acipensersinensis,AsZP3.1, ACO54852;AsZP3.2, ACO54853;AsZP3.3,HM067972;AsZP3.4,AEM- 43808;AsZPB, JF751061;AsZPAX, AEQ59107)。
1.2.3ArZP3-1、ArZP3-4和ArZPAX组织表达特异性分析 以小体鲟卵巢、精巢、肝、脑、肠、肾、脾、心、肌肉、皮和鳃等11种组织总RNA(各1 μg)反转录得到的cDNA 为模板,使用目的基因引物ArZP3-1-qF/qR、ArZP3-4-qF/qR、ArZPAX-qF/qR和持家基因引物18S-F/R进行半定量PCR。反应条件如下: 95 ℃下预变性5 min;95 ℃下变性30 s,退火30 s,在72 ℃下延伸30 s,共进行35个循环;最后在72 ℃下再延伸10 min。利用持家基因18S在各组织器官中的表达量基本相同这一特性,将其作为各组织半定量PCR产物量的参照,并利用Gel-Pro analyzer 4软件定量分析ArZP3-1、ArZP3-4和ArZPAX基因在不同组织中的表达差异。
2 结果与分析
2.1 ArZP3 3种亚型及ArZPAX cDNA保守片段克隆及序列分析
使用DNAstar软件中的SeqMan II对正、反向测序结果进行拼接后得到ArZP3 3种亚型和ArZPAX基因cDNA保守片段。其中,ArZP3-1部分cDNA序列长度为1029 bp,对应编码342个氨基酸(图1);ArZP3-4部分cDNA序列长度为1191 bp,对应编码397个氨基酸(图2);ArZP3-5部分cDNA序列长度为717 bp,对应编码238个氨基酸(图3);ArZPAX部分cDNA序列长度为733 bp,对应编码243个氨基酸(图4)。使用ExPASy分子生物学服务器上的Signal Pand Prosite软件 (http://prosite. expasy.org/)对氨基酸序列结构进行预测,发现ArZP3-1、ArZP3-4、ArZP3-5和ArZPAX氨基酸序列均存在一个保守的ZP结构域(图1~图4虚线部分)。

注:虚线部分表示小体鲟ArZP3-1氨基酸序列上的保守ZP结构域Note:The dotted line represents the conserved ZP domain on the amino acid sequence of ArZP3-1 in sterlet图1 小体鲟ArZP3-1基因部分cDNA序列及预测的氨基酸序列(GenBank登录号MF785109)Fig.1 ArZP3-1 partial length cDNA sequence and deduced amino acid sequence(GenBank accession No.MF785109) of sterlet Acipenser ruthenus

注:虚线部分表示小体鲟ArZP3-4氨基酸序列上的保守ZP结构域Note:The dotted line represents the conserved ZP domain on the amino acid sequence of ArZP3-4 in sterlet图2 小体鲟ArZP3-4基因部分cDNA序列及预测的氨基酸序列(GenBank登录号MF785110)Fig.2 ArZP3-4 partial length cDNA sequence and deduced amino acid sequence (GenBank accession No. MF785110) of sterlet Acipenser ruthenus
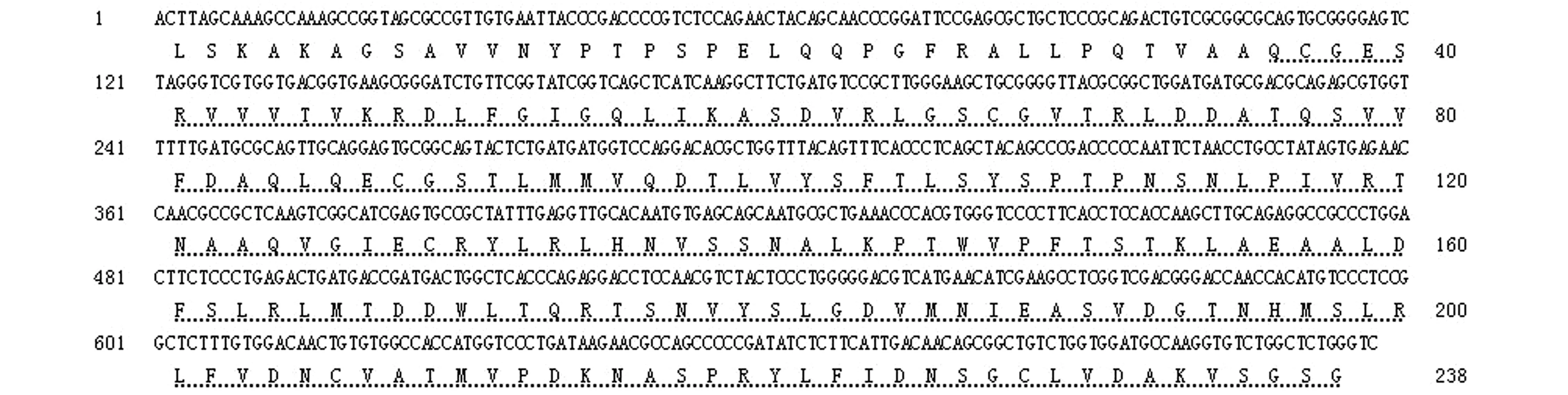
注:虚线部分表示小体鲟ArZP3-5氨基酸序列上的保守ZP结构域Note:The dotted line represents the conserved ZP domain on the amino acid sequence of ArZP3-5 in sterlet图3 小体鲟ArZP3-5基因部分cDNA序列及预测的氨基酸序列(GenBank登录号MF785111)Fig.3 ArZP3-5 partial length cDNA sequence and deduced amino acid sequence (GenBank accession No. MF785111)of sterlet Acipenser ruthenus

注:虚线部分表示小体鲟ArZPAX氨基酸序列上的保守ZP结构域Note:The dotted line represents the conserved ZP domain on the amino acid sequence of ArZPAX in sterlet图4 小体鲟ArZPAX基因部分cDNA序列及预测的氨基酸序列(GenBank登录号KX928953)Fig.4 ArZPAX partial length cDNA sequence and deduced amino acid sequence (GenBank accession No. KX928953)of sterlet Acipenser ruthenus
2.2 同源性比对及系统发育树构建
使用DNAMAN和MegAlign软件,对小体鲟ArZP3不同亚型物种间氨基酸序列进行比对及同源性分析(图5)发现,ArZP3 3种亚型间对应保守区段氨基酸序列一致性为71.37%,且在5′端保守性较低,3′端保守性较高;与中华鲟AsZP3 3种亚型对应保守性区段氨基酸序列相比,ArZP3 3种亚型与AsZP3.1一致性较高,为80%~95%,与AsZP3.2及AsZP3.3一致性较低,为20%~30%;与其他物种对应氨基酸区段的同源性比对发现,ArZP3 3种亚型与哺乳类动物、鸟类、两栖类及其他鱼类ZP3氨基酸序列一致性为40%~50%。对小体鲟ArZPAX物种间氨基酸序列进行比对及同源性分析(图6)发现,ArZPAX与中华鲟AsZPAX对应保守区段的氨基酸序列一致性最高,达到65.54%;与斑马鱼、罗非鱼和青鳉等鱼类ZPAX对应保守氨基酸区段一致性较高,达到50%;与哺乳类、鸟类和两栖类动物ZPAX一致性较差,仅为30%~35%。
使用MEGA 6.0软件进行ZP家族物种间氨基酸序列比对和同源性分析,用 Bootstrap验证重复1000次。从图7可见,哺乳类、鸟类、两栖类和鱼类的ZP蛋白清晰地聚为6大支,分别为ZP2、ZP1、ZPB/ZP4、ZPAX、ZPD 和 ZPC/ZP3。其中,小体鲟ArZPAX先与中华鲟AsZPAX聚为一支,然后再与高等鱼类、哺乳类、两栖类和鸟类的ZPAX聚为一支。小体鲟ArZP3-1与ArZP3-4、小体鲟ArZP3-5与中华鲟AsZP3.1先分别聚为一支,然后再与鲤科鱼类、哺乳类、鸟类、两栖类聚为一大支。
2.3 ArZP3-1、ArZP3-4和ArZPAX半定量PCR组织表达特异性分析
对ArZP3 3种亚型中的ArZP3-1、ArZP-4和ArZPAX基因进行11种组织(卵巢、精巢、肝、脑、肠、肾、脾、心、肌肉、皮和鳃)半定量PCR,组织表达特异性分析,电泳结果如图8所示

图5 小体鲟ArZP3 3种亚型与其他物种氨基酸序列的比对结果Fig.5 Alignment results of amino acid sequences in three subtypes of ArZP3 between sterlet Acipenser ruthenus and other species
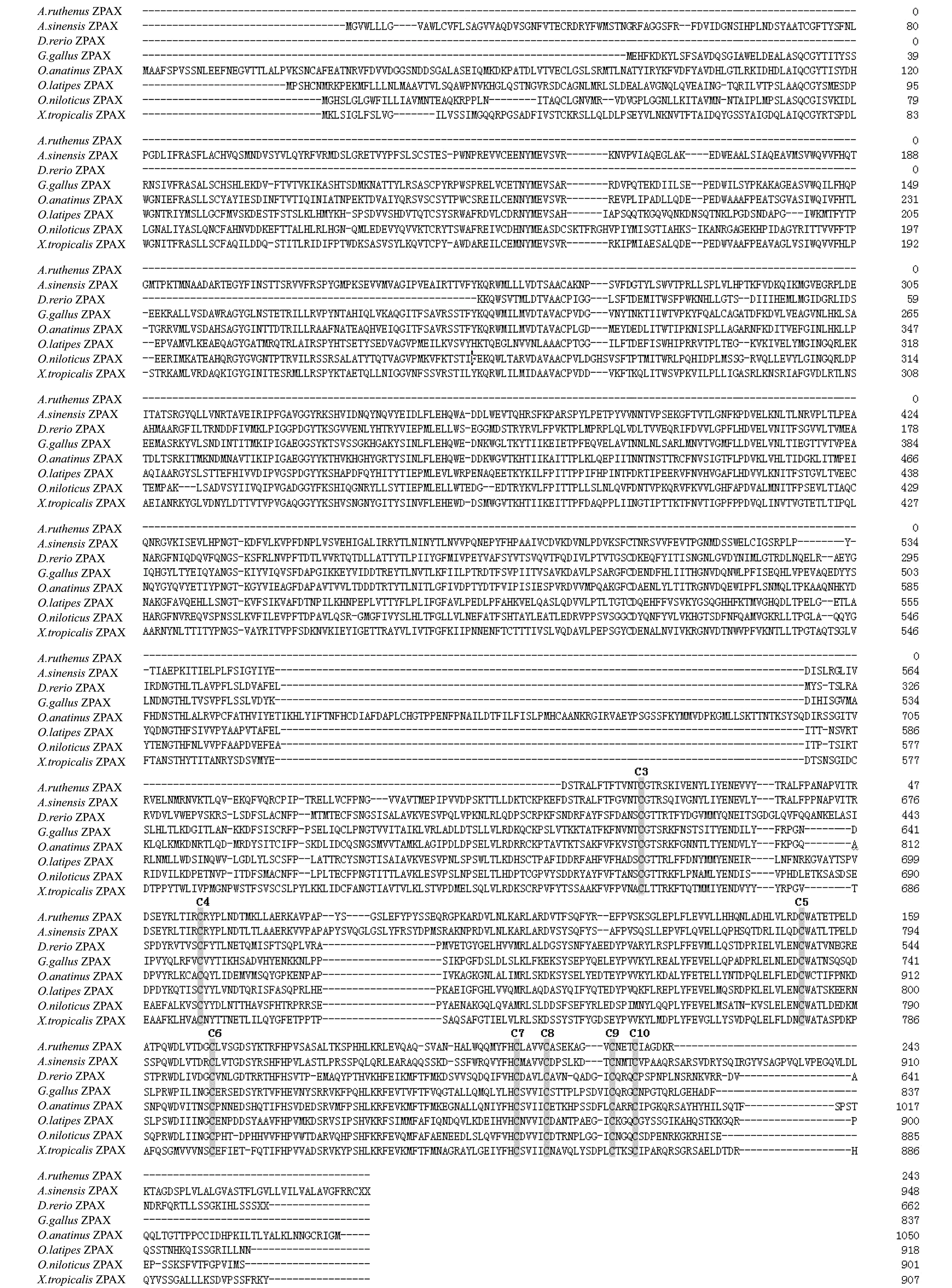
图6 小体鲟ArZPAX与其他物种氨基酸序列的比对结果Fig.6 Alignment results of amino acid sequences in ArZPAX between sterlet Acipenser ruthenus and other species

图7 小体鲟与其他物种ZP家族氨基酸序列系统发育树聚类分析Fig.7 Cluster analysis of phylogenetic tree of ZP family amino acid sequence between sterlet Acipenser ruthenus and other species
(以Ar18S为空白对照)。其中,持家基因Ar18S扩增片段长度在200 bp左右,在11种组织中均有表达,且条带亮度基本一致,可作为持家基因使用;目的基因ArZP3-1、ArZP3-4和ArZPAX扩增片段
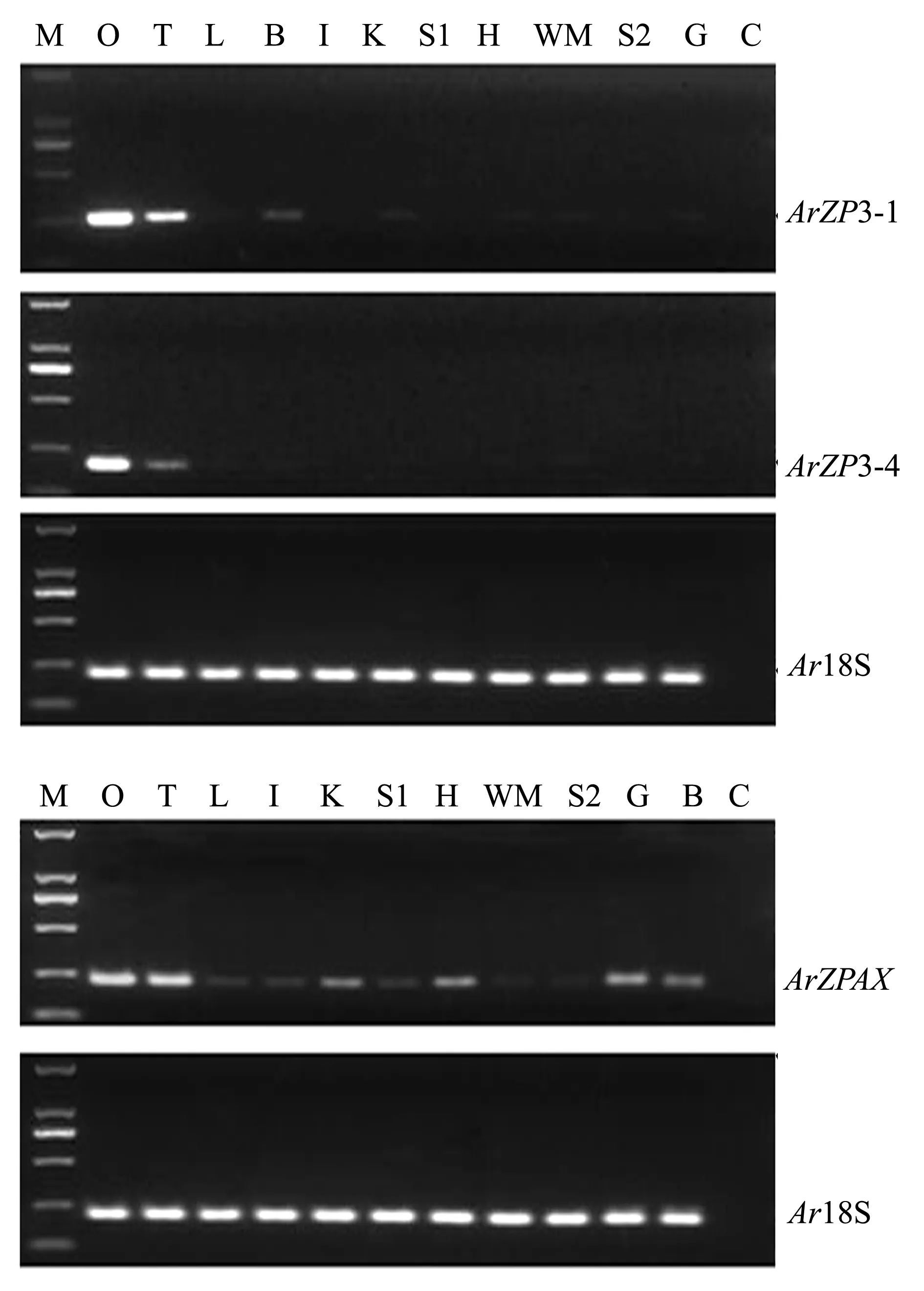
注:M为DL2000 DNA Marker;O为卵巢;T为精巢;L为肝脏;I为肠;K为肾脏;S1为脾脏;H为心脏;WM为肌肉;S2为皮;G为鳃;B为脑;C为空白对照Note: M,DL2000 DNA Marker; O,ovary; T,testis; L,liver; I,intestine; K,kidney; S1,spleen; H,heart; WM,white muscle; S2,skin; G,gill; B,brain; C,blank control图8 小体鲟ArZP3-1、ArZP3-4、ArZPAX组织表达特异性分析结果(Ar18S为空白对照)Fig.8 Tissue expression distribution of ArZP3-1, ArZP3-4 and ArZPAX(Ar18S as RT-PCR control)
长度与预期长度相同,不同目的基因在11种组织中的表达情况不同。使用Gel-Pro analyzer 4软件对电泳条带亮度进行分析处理,将所得目的基因与内参基因的亮度比值作为目的基因不同组织间相对表达量数据进行直观分析。从图9可见:ArZP3-1在性腺中的表达量较高,且在卵巢中的表达量远高于精巢,在雌鱼肝、脑、肾、心、肌肉、鳃中也有不同程度的表达,在肠、脾和皮中几乎不表达;ArZP3-4仅在卵巢和精巢中表达,且在卵巢中的表达量远高于精巢,在其他组织中几乎不表达;ArZPAX在性腺中表达量最高,且在卵巢中的表达量略高于精巢,在雌鱼肝、脑、肠、肾、脾、心和鳃中也存在一定量的表达,在肌肉和皮中几乎不表达。从目的基因间的表达情况来看,ArZPAX更具有表达的广泛性,ArZP3-1在性腺上的表达量最高。
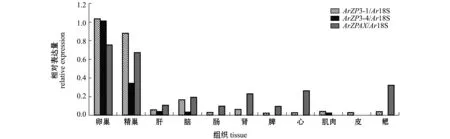
图9 小体鲟ArZP3-1、ArZP3-4及ArZPAX基因的组织相对表达量Fig.9 Relative expression levels of ArZP3-1, ArZP3-4 and ArZPAX in tissues detected by RT-PCR
3 讨论
3.1 序列分析及基因进化
本研究中成功克隆获得小体鲟卵透明带家族ArZP3基因3种亚型(ArZP3-1、ArZP3-4、ArZP3-5)的cDNA部分序列。通过物种间氨基酸序列比对发现,ArZP3 3种亚型中ArZP3-1和ArZP3-4间的同源性较高,ArZP3-5与其他亚型同源性相对较低。Li 等[11]在对中华鲟ZP3的研究中也发现其存在3个亚型,并命名为AsZP3.1、AsZP3.2、AsZP3.3,其中,AsZP3.2和AsZP3.3的同源性较高,其序列一致性为82%,而AsZP3.3与其他两个亚型的同源性仅在20%左右。本研究中,小体鲟ArZP3 3种亚型与中华鲟AsZP3.1同源性最高,为80%~95%,与AsZP3.2及AsZP3.3的一致性较低,为20%~25%,由此推测小体鲟ArZP3基因可能存在更多的亚型,且功能不尽相同。目前,研究人员发现,在斑马鱼、半滑舌鳎、青鳉等高等鱼类中ZP3/ZPC基因也存在多个亚型,而在鸟类、哺乳类动物中ZP3/ZPC基因的多个亚型现象还未见报道[25,29-30]。
本研究中成功克隆获得小体鲟卵透明带家族ArZPAX基因的cDNA部分序列。通过物种间氨基酸序列比对发现,ZPAX氨基酸序列在物种间的一致性较低,其中,小体鲟ArZPAX与中华鲟AsZPAX氨基酸序列保守性较高,约52%,与两栖类、禽类及高等鱼类ZPAX氨基酸序列保守性为20%~30%。Yue等[9]成功克隆获得中华鲟AsZPAX的完整cDNA序列,发现物种间ZPAX氨基酸序列的ZP结构域上存在10个高度保守的半胱氨酸残基(Cys residues),其中,本研究中克隆得到的小体鲟ArZPAX基因编码的部分氨基酸序列中找到相对应的8个(图6)。哺乳动物ZP蛋白C末端存在一个富含疏水氨基酸的跨膜功能域(TMD),它可以将ZP蛋白锚定到卵膜表面[31]。与哺乳动物相比,硬骨鱼类ZP蛋白在C端缺少跨膜功能域(TMD)结构,ZP蛋白前体可以在没有TMD结构的情况下进入卵壳,推测在大多数硬骨鱼类卵母细胞发育过程中,TMD并非为必要的结构[32-33]。本研究中,ArZPAX氨基酸序列C端同样缺少TMD结构,这与已报道的中华鲟AsZPAX蛋白结构具有相同特点[9]。
目前,有研究人员提出,ZP家族可能是由一个共同的ZP3/ZPC祖先基因衍变而来,ZP3/ZPC祖先基因序列的一次加倍产生了ZP3/ZPC基因,随后又复制过多次并逐渐进化成为其他ZP基因的前体,包括ZPA/ZP2、ZPB/ZP4、ZPD、ZP1和ZPAX基因[34-35],本研究中构建的物种间ZP家族氨基酸序列系统发育树,基本符合了上述假设(图7)。ZP3在许多物种上都有多种亚型,从本研究中构建的系统发育树的结果上看,同一物种ZP3的不同亚型亲缘关系不同。其中,小体鲟ArZP3 3种亚型均与中华鲟AsZP3.1聚为一支,亲缘关系最近,而与中华鲟另外两种亚型(AsZP3.2、AsZP3.3)未直接聚在一起,亲缘关系较远,斑马鱼DrZP3的3种亚型也存在此现象(图7),推测ZP3不同亚型间可能具有功能差异。另外,小体鲟ArZPAX首先与中华鲟AsZPAX聚为一支,随后再与高等鱼类、哺乳类、两栖类和鸟类的ZPAX一起聚为ZPAX亚家族,最终与ZP2亚家族、ZPB/ZP4亚家族、ZP1亚家族和ZPD亚家族聚为一大亚支(图7),推测这些亚家族亲缘关系较近,可能拥有相同的祖先。
3.2 组织分布及表达分析
近些年,有研究人员发现,半滑舌鳎CsZP3两种亚型在许多组织中广泛分布,其中,CsZP3a基因mRNA在雌鱼卵巢及肾脏中高表达,在肌肉和脾脏中低表达;CsZP3b基因mRNA在雌鱼卵巢、肾、心、脑、肌肉、脾、鳃和肠等8种组织及雄鱼精巢和肾脏中表达[30]。中华鲟AsZP3基因3种亚型也有类似的现象,其中AsZP3.1基因mRNA在卵巢、肝脏、肾、脾、心等5种组织中广泛表达,而AsZP3.2及AsZP3.3基因mRNA仅在卵巢中高表达[11]。本研究中,小体鲟ArZP3-1基因mRNA在卵巢、精巢、肝、脑、肾、心、肌肉、皮、鳃等组织中广泛表达,而ArZP3-4基因mRNA仅在卵巢和精巢组织中表达,与中华鲟AsZP3基因不同亚型的表达谱结果相似,而ArZP3两个亚型mRNA在卵巢中的表达量均远高于精巢的结果,推测ArZP3基因可能在雌鱼性腺发育及卵子成熟过程中发挥一定的功能,但仍需进一步研究。Yue等[9]通过荧光定量PCR技术检测了中华鲟AsZPAXmRNA在不同组织中的表达情况,发现AsZPAX仅在雌性卵巢及肝脏中表达,且在卵巢中的表达量远高于肝脏。与中华鲟不同的是,本研究中检测到小体鲟ArZPAXmRNA具有在多组织中广泛表达的特点(图8、图9),在卵巢和精巢中表达量最高,在肝、肠、肾、脾、心、鳃和脑中也存在一定量的表达,推测小体鲟的ZPAX基因可能具有更多方面的作用,仍需进一步地深入研究。
