茶叶提取物体外抗氧化活性与其功能性成分含量的相关性研究
2018-08-01丹曹永王华冯云子伍锦鸣赵谋明
李 丹曹 永王 华冯云子伍锦鸣赵谋明
(1. 广东中烟工业有限责任公司技术中心,广东 广州 510385;2. 华南理工大学食品科学与工程学院,广东 广州 510640)
饮茶及茶文化在中国已有数千年的历史。中国茶叶品种齐全,资源丰富,是世界上主要的茶叶生产、出口国。根据发酵的情况,茶叶可分为不发酵茶(绿茶、白茶)、半发酵茶(乌龙茶)、全发酵茶(红茶)及后发酵茶(黑茶)等[1]。茶作为世界三大饮品之一,不仅口感佳、热量低,且具有诸多保健功能,如抗氧化[2-3]、抗动脉硬化[4-5]、抗菌抗病毒[2]、护肝明目[3]和保护神经[6]等。将茶叶经过一定工艺制得提取物能强化其保健功效,通过提取工艺充分利用低质的茶末、茶碎等茶原料,可以增加产业附加值。
机体内自由基的大量存在是引发心血管疾病、机体老化及癌症等疾病的重要原因,而随着人们健康绿色环保意识的增强,食源性天然抗氧化剂的研究与开发具有重要意义,应用前景广阔。研究表明茶叶及其提取物具有良好的抗氧化能力[7],但研究多集中在水溶性组分[8],对其醇提物涉及较少。而且在茶叶活性物质的研究工作中[6-7],多集中在多酚的定量,然而其抗氧化活性物质在真实体系中的贡献大小仍不清楚。重组模型验证的思路来源于近年来兴起的分子感官组学研究系统[9],常用于香气活性物质的研究,通过重组构建体系判断香气活性物质鉴定的全面性和活性贡献特点非常实用[10],然而采用重组模型验证茶叶功能活性贡献大小的研究未见报道。
本研究对比分析不同发酵类型的茶叶醇提物及水提物的功能性成分差异,以氧自由基的吸收能力(ORAC)和DPPH自由基的清除能力为指标,比较各样品体外抗氧化活性,并建立活性指标与功能性组分含量的相关性,通过重组模型确定其中关键活性成分对总抗氧化活性的贡献能力,旨在为新型天然抗氧化剂的开发及茶叶综合利用价值的提高提供理论指导。
1 材料与方法
1.1 原料
3种茶样:分别自其产区购买,详见表1。

表1 茶叶样品信息
1.2 仪器
旋转蒸发器:RE-52A型,上海亚荣生化仪器厂;
电子天平:EL 204/EL3002型,上海梅特勒-托利多仪器有限公司;
数控超声波清洗器:KQ-800KDE型,江苏省昆山市超声仪器有限公司;
调温电热器:Q/320683AAFA02-2005型,5 000 mL,上海苏进仪器设备厂;
摇摆式中药粉碎机:DFY-500型,温岭市林大机械有限公司;
循环水式真空泵:SHZ-D(Ⅲ)型,巩义市予华仪器有限责任公司;
色谱柱:XBridge C18(5 μm,150 mm×4.6 mm)型,美国Waters公司;
高效液相色谱仪:Waters-600型,美国Waters公司;
多功能酶标仪:Varioskan Flash型,美国Thermo Fisher Scientific公司;
紫外可见分光光度计:UV-2100型,上海尤尼柯UNIC科学仪器有限公司。
1.3 试剂
浓硫酸、没食子酸、抗坏血酸、盐酸、乙醇、冰乙酸、苯酚、福林酚试剂、无水碳酸钠、乙二胺四乙酸二钠(EDTA·2Na)、十二水合磷酸氢二钠(Na2HPO4·12H2O)、二水合磷酸二氢钠(NaH2PO4·2H2O)、葡萄糖:分析纯,国药集团化学试剂有限公司;
咖啡碱标准品:纯度>98%,广州鼎国生物技术有限公司;
荧光素钠:纯度>99%,上海源叶生物科技有限公司;
甲醇、乙腈:色谱级,德国Merck公司;
1,1-二苯基-三硝基苯肼(DPPH)、水溶性维生素E(Trolox)、谷氨酸、2,2’-偶氮二(2-甲基丙基咪)二盐酸盐(AAPH)、表没食子儿茶素没食子酸酯(EGCG)、儿茶素(C)、表没食子儿茶素(EGC)、表儿茶素没食子酸酯(ECG)、没食子儿茶素(GC)、没食子酸(GA)标准品:纯度>98%,美国Sigma公司。
1.4 试验方法
1.4.1 样品制备 将茶样粉碎过40目筛,称取50 g茶粉,加入80%乙醇或蒸馏水[料液比为1∶12 (g/g)],加热回流提取2 h。冷却后过滤,滤液采用旋转蒸发仪浓缩至100 mL左右,制得茶醇提物及水提物于4 ℃贮藏备用。
1.4.2 茶提物浸提得率测定 参照GB 50093—2010中恒重法,按式(1)计算得率。
(1)
式中:
c——茶叶提取物浸提得率,%;
m1——浓缩液干物质总重量,即浓缩液质量×干物质含量,g;
m2——茶叶干重,g。
1.4.3 茶提物主要功能性成分含量测定
(1) 茶多酚含量测定:采用福林酚比色法,按GB/T 8313—2008执行。
(2) 茶多糖含量测定:采用苯酚-硫酸法[11]。
(3) 游离氨基酸含量测定:采用水合茚三酮比色法,按GB/T 8314—2013执行。
(4) 儿茶素、咖啡碱、没食子酸(GA)含量测定:采用高效液相法,按GB/T 31740.2—2015执行。
1.4.4 DPPH 自由基清除能力测定 根据Zheng等[12]的方法,修改如下:取2 mL茶提物或标准品混合物稀释液与2 mL DPPH乙醇溶液(0.2 mmol/L)涡旋混匀,静置常温避光反应30 min后,于波长517 nm处测定吸光度(Asample)。取2 mL无水乙醇与2 mL样液混合测得吸光值为Ablank,以等量无水乙醇代替茶样测得吸光值标记为Acontrol,该研究以Trolox作为阳性对照。DPPH自由基清除率按式(2)计算:
(2)
式中:
C——DPPH清除率,%;
Asample——样品(样品与DPPH乙醇溶液)的吸光值;
Ablank——空白样品(乙醇与茶提物样液)的吸光值;
Acontrol——对照组(乙醇与DPPH乙醇溶液)的吸光值。
将样品浓度与其对应的自由基清除率进行拟合,建立线性回归方程。清除率为50%对应的样品或阳性对照的浓度即为IC50值。
1.4.5 氧自由基清除能力(ORAC值)测定 根据Lin等[11]的方法,修改如下:用pH 7.40磷酸盐缓冲液(75 mmol/L)溶解和稀释AAPH、荧光素钠盐、Trolox及待测样品至相应浓度。在96孔板的微孔中依次加入25 μL茶提取物稀释液/标准品混合物、pH 7.40的磷酸盐缓冲液或Trolox标准液,7 nmol/L 的荧光素溶液75 μL。将96孔板在37 ℃下进行10 min 孵育后,加入AAPH溶液(12.8 mmol/L)100 μL,采用酶标仪开始计时反应并读数(激发波长485 nm、发射波长538 nm),反应时间120 min,每1 min 读1次,共读数121次。曲线下方的面积按式(3)计算:
AUC=0.5×(f0+f121)+(f1+f2+……+f120),
(3)
式中:
AUC——曲线下方的面积;
f0——初始荧光强度,a.u.;
fi——第imin时的荧光强度,a.u.。
NetAUC=AUCsample-AUCblank,其中Trolox浓度与相应的Net AUC呈正比可建立方程,将样品Net AUC代入方程,即得ORAC值。茶提物的ORAC值单位设为每克干物质相当于Trolox的量(μmol TE/g·DW)。
1.5 数据分析
试验结果以“均值±标准偏差”表示(n≥3)。采用Microsoft Excel 2013作图,SPSS 20.0软件进行相关性分析和单因素方差分析(P<0.05)。
2 结果与讨论
2.1 不同茶类提取物浸提得率及功能性成分分析
不同茶类醇提物及水提物浸提得率及主要功能性成分含量见表2。不同茶类提取物(tea extracts, TE)浸提得率具有显著差异(P<0.05)。红碎茶和普洱熟茶水提物的得率高于醇提物的,而信阳毛尖则是醇提物较高,可能是信阳毛尖为绿茶,其中茶多酚含量高,同时茶多酚在80%乙醇中比纯水中的溶解度大,提高了其醇提物的提取得率。醇提物及水提物中得率高低顺序都为:信阳毛尖>普洱熟茶>红碎茶,其中最高的为信阳毛尖醇提物(36.89%)。各主要功能性组分中茶多酚含量最高,茶多糖及咖啡碱次之,没食子酸、蛋白质和氨基酸含量较少。
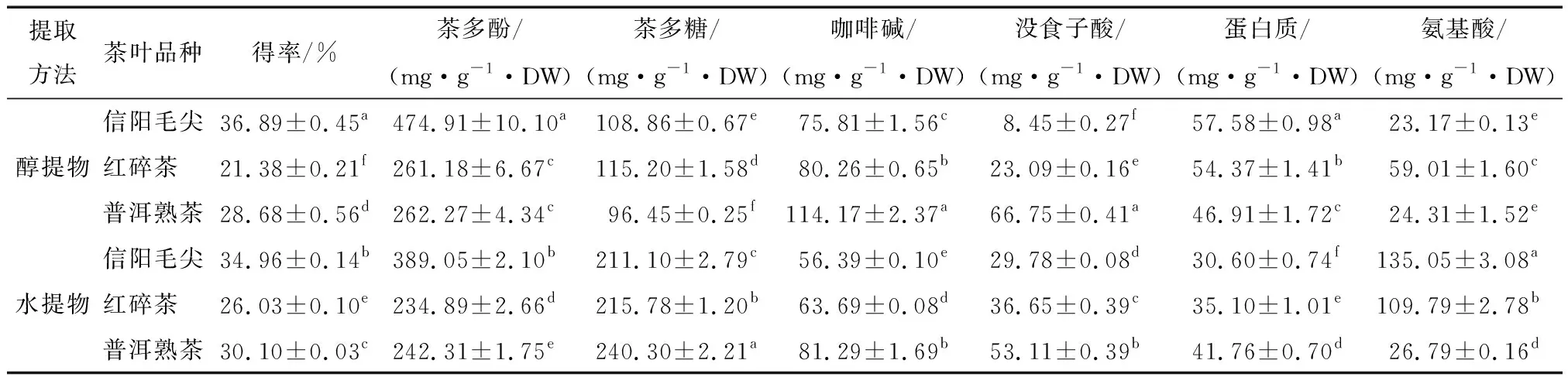
表2 不同茶提取物得率及其功能成分含量†
† 同列肩标字母不同表示数据间存在显著性差异(P<0.05)。
3种茶的醇提物茶多酚含量都显著高于其水提物,表明茶多酚在80%的乙醇溶液中溶解度更高。信阳毛尖2种提取物中的茶多酚含量都显著高于普洱熟茶及红碎茶,其中最高的为信阳毛尖醇提物(474.91 mg/g·DW),这与各类茶的加工工艺有关。绿茶加工过程中经过杀青,使过氧化酶和多酚氧化酶等酶系失活,茶多酚不被氧化而损失。李大祥等[13]研究表明采用相同原料制得绿茶和红茶,绿茶的茶多酚含量基本不变而红茶则显著下降。而普洱熟茶渥堆工艺中湿热的环境和微生物作用也会导致酚类物质含量减少[14]。
信阳毛尖、红碎茶及普洱熟茶水提物中茶多糖含量显著高于醇提物,分别是醇提物中的1.94,1.87,3.05倍,表明水提法能将茶多糖更充分地提取出来。水提物中茶多糖含量从高到低排序为:普洱熟茶>红碎茶>信阳毛尖,且普洱茶水提物中的茶多糖含量(240.3 mg/g·DW)显著高出红碎茶和信阳毛尖(P<0.05),这与黑茶后发酵过程中大量微生物作用促进茶叶中多糖分解为可溶性糖有关[15]。
提取物中咖啡碱含量在2种提取工艺中的高低顺序一致,均为:普洱熟茶>红碎茶>信阳毛尖,咖啡碱为嘌呤碱杂环结构,较为稳定,随发酵的进行降低并不显著,因此咖啡碱主要取决于原料中的含量[16]。没食子酸是茶多酚的结构组成单元,也是具有生理活性的简单酚类化合物[17],2种提取物中普洱茶的没食子酸含量皆最高。茶叶醇提物中蛋白质含量比水提取中高,但总体含量较低,是由于茶叶80%的蛋白质主要为难以溶解的谷蛋白,而可溶性的主要为醇溶谷蛋白[18]。氨基酸在水提物中含量显著高于醇提物,且水提物中信阳毛尖、红碎茶的茶氨酸含量分别为普洱茶的5.18,4.03倍,这主要是黑茶工艺中的“渥堆作用”导致大量茶氨酸被破坏,含量急剧降低[19]。
不同茶提取物中5种儿茶素的定量结果见表3。儿茶素是茶叶多酚类物质的主体成分,约占茶多酚总量的70%~80%[17],由表3可知,茶多酚含量与儿茶素总量存在极显著相关性(P<0.01),相关系数为0.928,说明儿茶素总量在各茶类中的变化趋势与茶多酚一致。醇提物中儿茶素总量显著高于水提物(P<0.05),其中信阳毛尖醇提物儿茶素总量最高(451.88 mg/g·DW)。红碎茶与普洱熟茶的醇提物及水提物的儿茶素总量都无显著差异,仅为信阳毛尖2种提取物总量的1/7及1/3。不同茶类加工工艺不同是造成儿茶素含量差异显著的主要原因。关于红茶工艺的研究[20]结果表明,揉切和发酵过程会使儿茶素含量减少近75%。茶叶的酯/简比值(酯型儿茶素:简单儿茶素)越高其相应的功能活性越强,信阳毛尖的醇提物和水提物及红碎茶醇提物酯/简比值都高于1,分别为3.88,1.43,1.14,表明可能具有较强的活性,酯型儿茶素的保健功能较强,具有抗氧化、抗肿瘤、保护神经心脑血管、代谢酶干预、免疫内分泌等作用[21],其中又以EGCG和EGC的活性较高[22]。
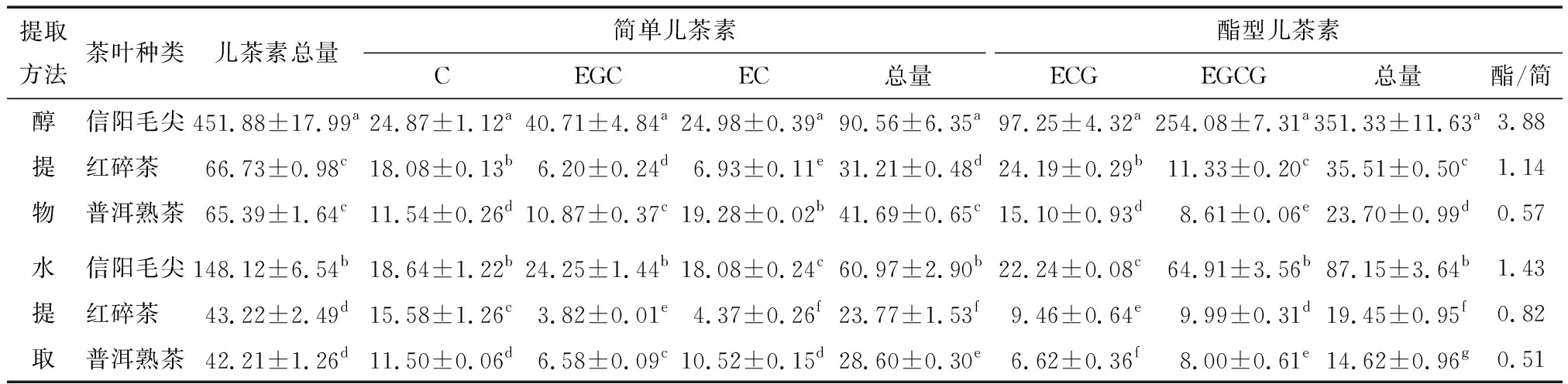
表3 不同茶提取液中儿茶素组分及含量†
† “酯/简”表示酯型儿茶素含量与简单儿茶素含量的比值;同列上标字母不同表示数据存在显著性差异(P<0.05)。
2.2 不同茶类提取物的抗氧化活性分析
2.2.1 氧自由基吸收能力 氧自由基吸收能力法是Cao等[23]在Glazar[24]的研究基础上建立起来的一种评价样品总抗氧化活性的化学方法,具有灵敏高,适用性广泛等特点。ORAC法根据自由基破坏荧光探针导致荧光强度变化的原理,以Trolox为定量标准、荧光素钠为荧光物质、AAPH为过氧自由基来源。当抗氧化剂对ROO自由基作用时会引发荧光强度变化,采用荧光酶标仪测定抑制作用变化过程。如表4所示,不同茶类醇提物的ORAC值都显著高于其相应水提物的,说明醇提物的氧自由基吸收能力更强。醇提物中3种茶类的ORAC值具有显著差异,其大小顺序为:信阳毛尖>普洱熟茶>红碎茶。徐维盛等[25]采用ORAC法比较16种茶叶的抗氧化能力发现绿茶>黑茶>红茶,与本研究结果一致。而3种茶类的水提物都有一定氧自由基吸收能力但无显著差异(P>0.05)。
2.2.2 对DPPH自由基的清除能力 20世纪50年代末由Marden Blois[26]提出的DPPH自由基清除能力法,目前已发展成为评价和筛选化合物及天然提取物体外抗氧化能力的常用方法。不同茶类提取物的DPPH自由基的的半数清除率(IC50)见表5。提取物浓度与其对应的DPPH自由基清除作用存在良好的线性关系(相关系数为0.993~0.997)。
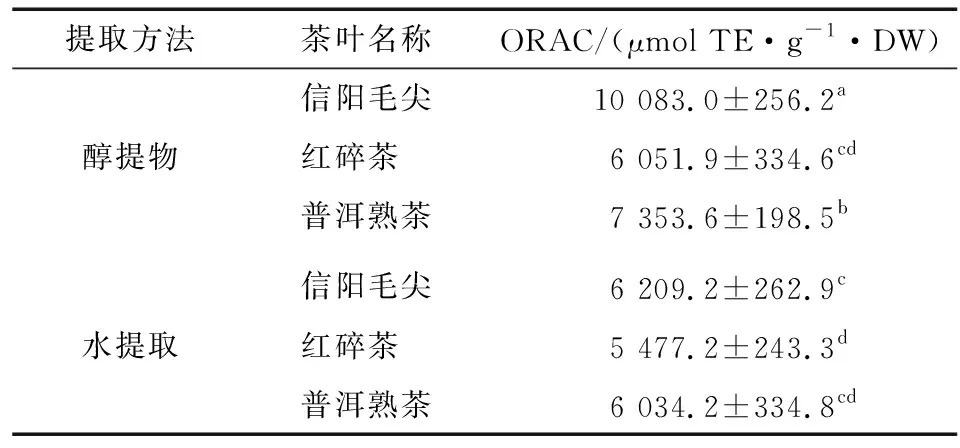
表4 不同品种茶叶提取液ORAC值†
† 同列肩标字母不同表示数据存在显著性差异(P<0.05)。
不同茶类的醇提物IC50值显著低于其对应的水提物,说明醇提物具有更强的DPPH自由基清除能力。与对照组相比,仅有信阳毛尖醇提物的DPPH自由基清除能力显著高于Trolox。2种提取物中各类茶的IC50值具有显著差异(P<0.05),且大小顺序一致:信阳毛尖>普洱熟茶>红碎茶。周金伟等[27]测定各类茶的DPPH自由基的清除能力发现不发酵茶抗氧化能力明显强于发酵茶,与本研究结果一致,这表明抗氧化能力受加工工艺的影响。
2.2.3 体外抗氧化活性与其功能性成分含量的相关性分析
不同茶提物中主要功能性成分含量与体外抗氧化能力(ORAC及1/IC50值)的相关性见表5。茶多酚含量与茶提物的ORAC及DPPH值呈显著正相关(P<0.05),相关系数分别是0.897及0.914,表明茶多酚含量越高,茶提物对氧自由基与DPPH自由基的清除能力越强,此结果与陈雪[28]的研究相符。儿茶素为茶多酚中的主体成分,5种主要儿茶素总量与ORAC值及1/IC50值呈极显著正相关(P<0.01),其中ECG含量与ORAC及1/IC50都呈极显著相关性(P<0.01),EGC、EC与ORAC值呈极显著相关性(P<0.01),而与1/IC50呈显著相关(P<0.05)。EGCG则与2个抗氧指标都有显著相关性(P<0.05)。值得注意的是,儿茶素的酯/简与ORAC和1/IC50呈显著相关性(P<0.05),说明酯/简比值越高其相关的抗氧化能力越强,而酯型儿茶素(特别是ECG)的含量是影响茶提物中氧自由基及DPPH自由基清除能力的重要因素。
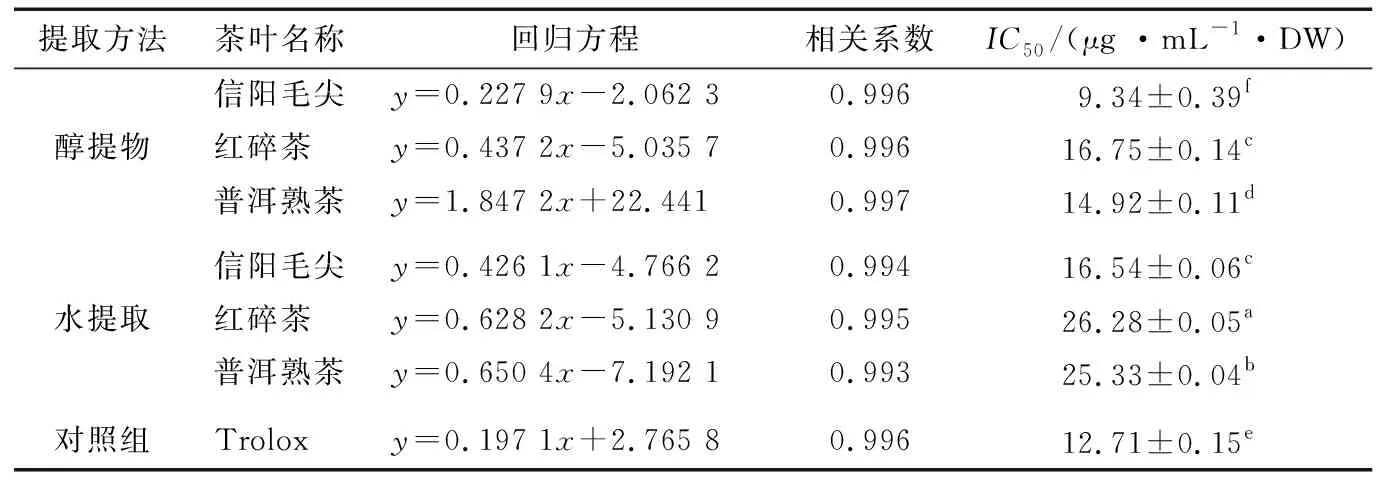
表5 茶叶提取液DPPH自由基清除活力†
† 同列肩标字母不同表示数据间存在显著性差异(P<0.05)。
表6 茶提取物中功能成分含量与体外抗氧化能力的相关系数†
Table 6 Relationship between the functional components contents and the anti-oxidant activities
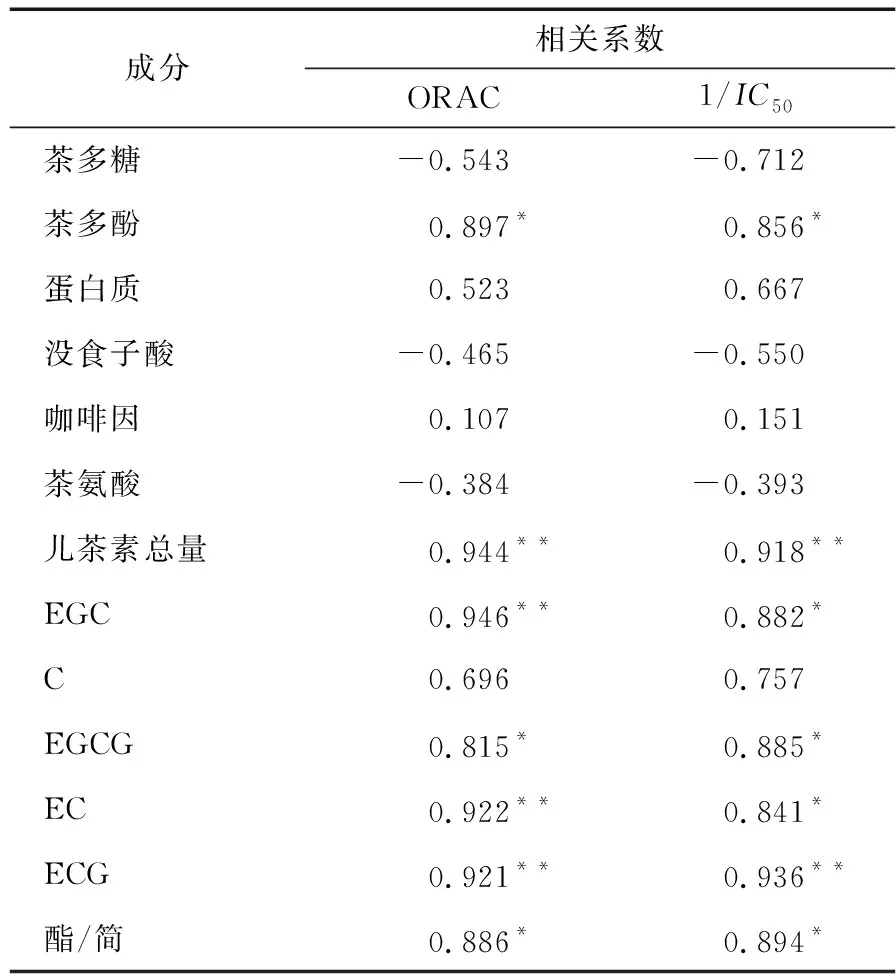
成分相关系数ORAC1/IC50茶多糖-0.543-0.712茶多酚0.897*0.856*蛋白质0.5230.667没食子酸-0.465-0.550咖啡因0.1070.151茶氨酸-0.384-0.393儿茶素总量0.944**0.918**EGC0.946**0.882*C0.6960.757EGCG0.815*0.885*EC0.922**0.841*ECG0.921**0.936**酯/简0.886*0.894*
† *表示在P<0.05水平上差异显著,**表示在P<0.01水平上差异显著。
2.2.4 体外抗氧化活性与儿茶素、没食子酸含量的关系 根据以上分析结果,试验独立选取相关性较高的5种儿茶素和没食子酸标品,并根据其在各茶提物中的含量(表2、3)进行复配,得到标品混合物STE。通过测定并比较TE及STE的ORAC、DPPH值,进一步探究5种儿茶素和没食子酸对样品抗氧化能力的贡献作用,ORAC和DPPH的贡献率分别按式(4)、(5)计算:
(4)
(5)
式中:
R1——ORAC的贡献率,%;
R2——DPPH的贡献率,%;
ORACSTE——标品混合物的ORAC值;
ORACTE——茶叶提取物的ORAC值;
DPPHSTE——标品混合物的DPPH值;
DPPHTE——茶叶提取物的DPPH值。
由图1可知,3种茶的STE-E及STE-W的ORAC值较其相应的茶提物差异显著。信阳毛尖STE-E的ORAC值贡献率最高,达90.08%,说明信阳毛尖醇提物中的5种儿茶素及没食子酸为其氧自由基清除能力的主要贡献体。而作为发酵茶的红碎茶和普洱熟茶的STE-E贡献率分别仅为45.94% 及45.13%,不超过50%。说明通过发酵或后发酵工艺后,一方面儿茶素的含量会随着发酵的进行而减少,所以茶提物中儿茶素及没食子酸的抗氧化贡献明显减少,另一方面,通过发酵和后发酵过程会生成其他具有抗氧化活性的物质。屠幼英等[29]发现,红茶中多酚氧化产物茶黄素具有较好的抗氧化活性。
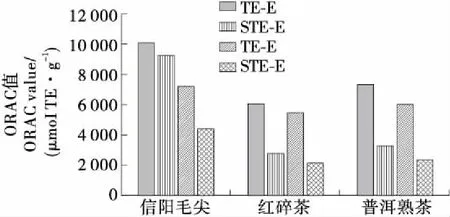
TE-E、TE-W分别指茶叶醇提物及水提物;STE-E、STE-W分别指根据茶醇提物及水提物中的成分含量配制成的标准品混合物(含C、EC、ECG、EGC、EGCG及没食子酸)
图1 不同品种茶叶提取液及相应标品混合物的ORAC值
Figure 1 The ORAC value of different tea extracts and the corresponding standard mix
由图2可知,3种茶的STE-E及STE-W的DPPH值较其相应的茶提物差异显著,其中信阳毛尖STE-E对茶提物的抗氧化性贡献率最高,达61.31%,而红碎茶STE-E最低,仅为23.30%。而水提物中3种茶的STE-W的DPPH值贡献率差异不大(34.57%~43.44%)。6种STE中仅有信阳毛尖STE-E贡献率超过50%,说明茶提物中除5种儿茶素及没食子酸外,其他功能性物质对DPPH的清除也起了重要作用。同时茶叶工艺的不同也影响茶类STE-E的贡献率,不发酵茶中儿茶素及没食子酸的贡献率明显大于发酵茶提物。
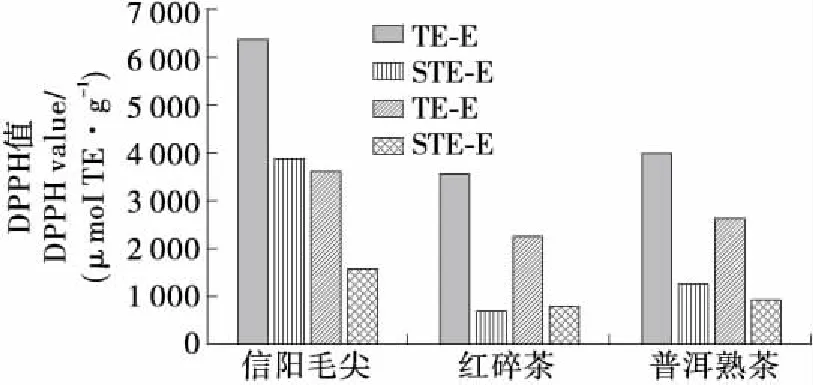
TE-E、TE-W分别指茶叶醇提物及水提物;STE-E、STE-W分别指根据茶醇提物及水提物中的成分含量配制成的标准品混合物(含C、EC、ECG、EGC、EGCG及没食子酸)
图2 不同品种茶叶提取液及相应标品混合物的DPPH自由基清除能力
Figure 2 The values of different tea extracts and the corresponding standard mix for scavenging DPPH free radicals
3 结论
试验结果表明,3种茶类醇提物及水提物的组分含量和抗氧化活性差异显著。醇提物中茶多酚(信阳毛尖>普洱熟茶>红碎茶)、咖啡因及蛋白质的含量较高,而水提物中以茶多酚、茶多糖(普洱熟茶>红碎茶>信阳毛尖)及茶氨酸为主,这些差异与原料来源及茶叶加工工艺有关。儿茶素总量与茶多酚含量呈极显著相关(P<0.01),信阳毛尖的2种提取物与红碎茶醇提物的儿茶素酯/简值>1。3种茶类的醇提物对氧自由基吸收及DPPH自由基清除能力都比其水提物强,且3种茶类醇提物的ORAC值与IC50值的大小趋势一致为:信阳毛尖>普洱熟茶>红碎茶。DPPH和ORAC结果与提取物中茶多酚含量、儿茶素单体(ECG、EC、EGC、ECGC)、儿茶素总量和酯/简值都呈显著相关性,酯型儿茶素(ECG和EGCG)的含量对DPPH自由基清除能力及ORAC活性具有较大贡献。儿茶素与没食子酸标品复配试验表明,5种儿茶素(ECG、EC、C、EGC、ECGC)和没食子酸是信阳毛尖茶提物中主要抗氧化组分;而红碎茶、普洱熟茶因经发酵处理生成其他抗氧化活性组分,亟待进一步研究。
