新疆部分地区牛轮状病毒VP6基因的原核表达与免疫反应性分析
2018-08-01陆亚冬刘贤侠陈创夫
陆亚冬, 刘贤侠, 陈创夫
(石河子大学动物科技学院, 新疆 石河子 832003)
轮状病毒(Rotavirus,RV)是引起婴幼儿和多种幼龄动物腹泻的主要病原之一。给人类的健康和畜牧业的发展带来极大的损失,依据轮状病毒自身的特有的抗原性和PAGE胶上轮状病毒RNA片段电泳的迁移率,其血清型分为A、B、C、D、E和F共 6个组,A组在人类和动物病毒株中甚是普遍[1]。
RV为无囊膜球形病毒,A群RV为有11个基因片段的双股RNA病毒,基因组编码6个结构蛋白和5个非结构蛋白[2]。其中内衣壳蛋白VP6由第6节段基因编码,由397个氨基酸组成,大小为45 kD,该蛋白是基因组的核心蛋白,约占病毒蛋白量的51%。轮状病毒粒子为3层衣壳结构,外层衣壳由VP7和VP4蛋白构成病毒衣壳中间层由VP6组成,最内层由VP2、VP3和VP1组成,VP6蛋白不但在病毒的复制和装配中发挥重要的作用[3-9],也是A群RV的群特异性抗原。VP6具有较高的免疫反应性和抗原性,是介导其特异性免疫反应黏膜免疫的特异性抗原[10~14]。而牛轮状病毒是轮状病毒属的一种,牛轮状病毒是引起新生犊牛腹泻的主要病原之一,该病在生产实践中极为普遍,常和其他病原混合感染,本研究基于新疆地区规模化牛场的现状,为解决规模化牛场中致犊牛腹泻病原的快速诊断问题,为后续的间接ELISA试验、免疫胶体金试纸条制备试验奠定了基础。
1 材料与方法
1.1 菌株、载体E.coliDH 5α 菌株、BL21(DE3)菌株和原核表达载体pET-32a菌株均由石河子大学动物疾病防控重点实验室保存;pMD19-T载体,购自宝生物工程(大连)有限公司。
1.2 主要试剂和仪器 酶标仪、牛轮状病毒抗原检测试剂盒,购自上海润裕公司; IPTG购自Merk公司;限制性内切酶(EcoRI/HindIII)、T4连接酶、蛋白酶抑制剂、DNA Marker,购自宝生物工程(大连)有限公司;质粒小提取试剂盒、琼脂糖凝胶回收试剂盒、His标签蛋白纯化试剂盒(可溶性蛋白)、Protease Inhibitor Cocktail、Ni-Agarose Resin,均购自北京康为世纪生物科技有限公司;HRP标记的山羊抗牛IgG、广谱彩虹预染Marker,购自天根生化科技(北京)有限公司。
1.3 样本的采集 从新疆北疆地区的142团、143团、148团、塔城地区163团、克拉玛依市、奎屯、沙湾、石河子、呼图壁、吉木萨尔县、新疆奇台县等地区规模化奶牛场和部分肉牛场采集腹泻犊牛粪便样品共172余份,保存-80 ℃冰箱待检。
1.4 方法
1.4.1 腹泻犊牛粪便的处理 用液氮在研钵中研磨粪便,将粪便与对应体积的PBS于冰上充分研磨,进行超声破碎,进行反复冻融,最后匀浆液于12 000 r/min离心30 min,取上清用牛轮状病毒抗原用ELISA试剂盒进行检测。
1.4.2 牛轮状病毒抗原检测ELISA试剂盒 试剂盒原理是双抗体夹心法,将处理好的样品上清液吸取200 μL加入已经预先包被牛轮状病毒捕获抗体的微孔中,同时设置阴阳性对照孔和空白孔,除空白孔外,样品孔中加入辣根过氧化物酶(HRP)标记的检测抗体100 μL,微量震荡仪器上进行震荡混匀,用封板膜封好后置于37 ℃恒温培养箱中作用1 h,取出弃掉微孔中的液体,每孔用洗涤液洗板5次,每次2 min,加入底物后避光孵育15 min,用终止液进行终止,在450 nm的酶标仪上进行读数,初步鉴定并收集阳性病料。
1.4.3 目的基因扩增与测序 根据GenBank中牛轮状病毒VP6基因序列(登录号:AF317127),运用Primer5.0软件对基因进行引物设计。该基因序列由上海生物工程技术服务有限公司合成,见表1。
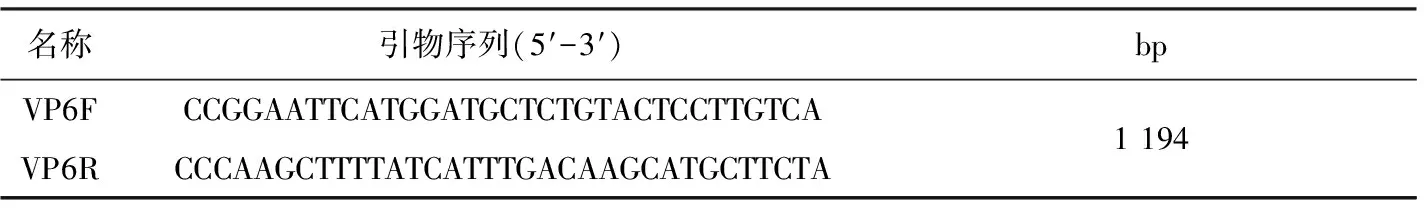
表1 牛轮状病毒VP6引物
以牛轮状病毒阳性病料提取总RNA,反转录为cDNA,以cDNA为模板,进行PCR扩增,PCR反应体系20 μL;2XEsTaqMaster mix 10.0 μL,上、下游引物各0.4 μL,模板2.0 μL,ddH2O 7.2 μL。 PCR反应条件:95 ℃预变性5 min,94 ℃变性30 s,65 ℃退火30 s,72 ℃延伸30 s,72 ℃后延伸10 min,共进行35个循环,反应结束后PCR产物进行2%的琼脂糖凝胶电泳进行检测,同时琼脂糖凝胶试剂盒回收目的片段。
将回收的目的片段与pMD19-T载体在16 ℃水浴锅中过夜连接,构建重组质粒pMD19-T-VP6。连接体系20 μL:目的基因片段12 μL,pMD19-T载体3 μL,T4DNA Ligase Buffer 3 μL,T4DNA ligase 2.0 μL。将重组质粒转入E.coliDH5α感受态细胞,在有抗性的LB固体培养基上进行筛选阳性克隆,经菌液PCR和双酶切鉴定阳性克隆,并将提取的质粒送上海生工生物工程技术服务有限公司测序。
1.4.4 原核表达载体的构建 用EcoRI和HindIII对测序正确的菌株的质粒以及pET-32a载体进行双酶切,经琼脂糖凝胶回收试剂盒回收目的片段以及酶切后的线性pET-32a载体,并将目的片段分别和线性pET-32a在连接酶的作用下16 ℃水浴过夜,将连接产物转化E.coliDH5α,经抗性的LB固体培养基筛选阳性克隆,进行菌液PCR和双酶切鉴定。将构建好的质粒转化至BL21中。
1.4.5 重组蛋白表达及表达条件优化 将筛选出的阳性克隆菌再转入LB液体培养基中,37 ℃,220 r/min 培养2 h,使得其OD值0.4~0.6。通过调整诱导剂的浓度,在不同的诱导时间进行诱导并收集菌体。取1 mL菌液离心弃上清,加入20 μL的5×SDS蛋白上样液和80 μL的灭菌水进行混合,震荡混匀后沸水煮5 min,取15 μL样品进行SDS-PAGE进行蛋白电泳,用考马斯亮蓝染色和冰乙酸进行脱色,观察。
1.4.6 重组蛋白表达形式的鉴定 对重组蛋白进行大量表达,超声30 min,12 000 r/min离心分离上清和沉淀,运用SDS-PAGE电泳检查进行分析重组表达蛋白在上清和包涵体的鉴定。
1.4.7 重组蛋白的纯化 可溶性蛋白纯化缓冲液配方。
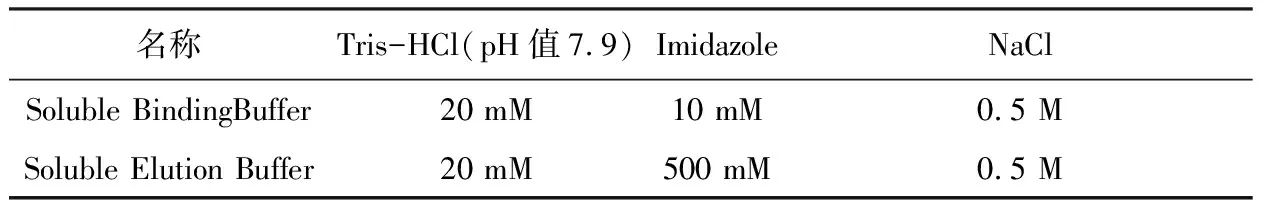
表2 可溶性蛋白纯化缓冲液配方
将Ni-Agarose Resin填料混匀后加入层析柱,室温静置10 min,待凝胶与溶液分层后, 把底部的出液口打开,让乙醇通过重力作用缓慢流出。向装填好的柱中加入5倍柱体积的去离子水将乙醇冲洗干净后,再用10倍柱体积的 Binding Buffer平衡柱子,平衡结束后即可上样。
7His标签蛋白纯化试剂盒(可溶性蛋白) 进行纯化, 咪唑洗脱后目的蛋白的纯度。收集菌体后,每100 mg菌体(湿重)加入1 mL细菌裂解液(每1 mL细菌抽提试剂 中已加入10 μL蛋白酶抑制剂混合物),超声裂解菌体。超声过程中保持菌液处于冰浴中,应避免连续超声导致的大量产热,短时间,多次超声,通过一定的间隔时间避免溶液过热,最终菌液变清即可。10 000 r/min(4 ℃)离心3 min,收集上清中的可溶性蛋白。用Binding Buffer将菌体裂解液等倍稀释后负载上柱,流速为10倍柱体积/小时,收集流穿液,使用15倍柱体积的Soluble Binding Buffer冲洗柱子,洗去杂蛋白。使用适量Soluble Elution Buffer洗脱,收集洗脱峰。洗脱峰可以分管收集,每1 mL收集1管,收集洗脱峰。表达产物经散装Ni2+柱进行亲和层析分离纯化,在500 mmol/L咪唑洗脱液中收集得到的目的蛋白。洗脱后,依次使用10倍柱体积的去离子水洗涤柱子,再用3倍柱体积的20%乙醇平衡 (乙醇要将填料浸没),封柱后2 ℃~8 ℃保存。
1.4.8 Western Blotting 检测重组蛋白VP6 对重组蛋白进行SDS-PAGE后转移至NC膜上,用190 mA的电流转膜50 min,将膜放入预先用TBST洗涤后的杂交瓶中,37 ℃封闭2 h,用TBST洗涤2次,每次5 min。加入1∶4 000的稀释的牛轮状病毒阳性血清,37 ℃孵育2 h后用TBST洗涤2次,每次5 min,加入1∶5 000稀释的辣根过氧化物酶标记的山羊抗牛IgG,37 ℃孵育2 h,TBST洗涤3次,每次5 min。进行显色,进行拍照处理。
2 结果与分析
2.1 目的基因的扩增和序列测定 PCR扩增BRV VP6片段大小为1194 bp,经2%琼脂糖凝胶电泳分析,与预期的大小一致,如图1。测序结果与标准序列比对后同源性100%。
2.2 VP6基因的表达载体的构建及其酶切鉴定结果 用EcoRI和HindIII限制性内切酶进行双酶切,表明目的基因BRV VP6基因已经成功插入到表达载体中,如图2。
2.3 重组蛋白VP6-32a-DE3的诱导表达图 诱导表达的重组蛋白表达结果与预期理论值60 kDa大小相符,如中插彩版图3。
2.4 重组蛋白VP6-32a-DE3上清/包涵体鉴定 SDS-PAGE电泳检测分析表明,重组表达蛋白质在上清和包涵体都有表达,如中插彩版图4。
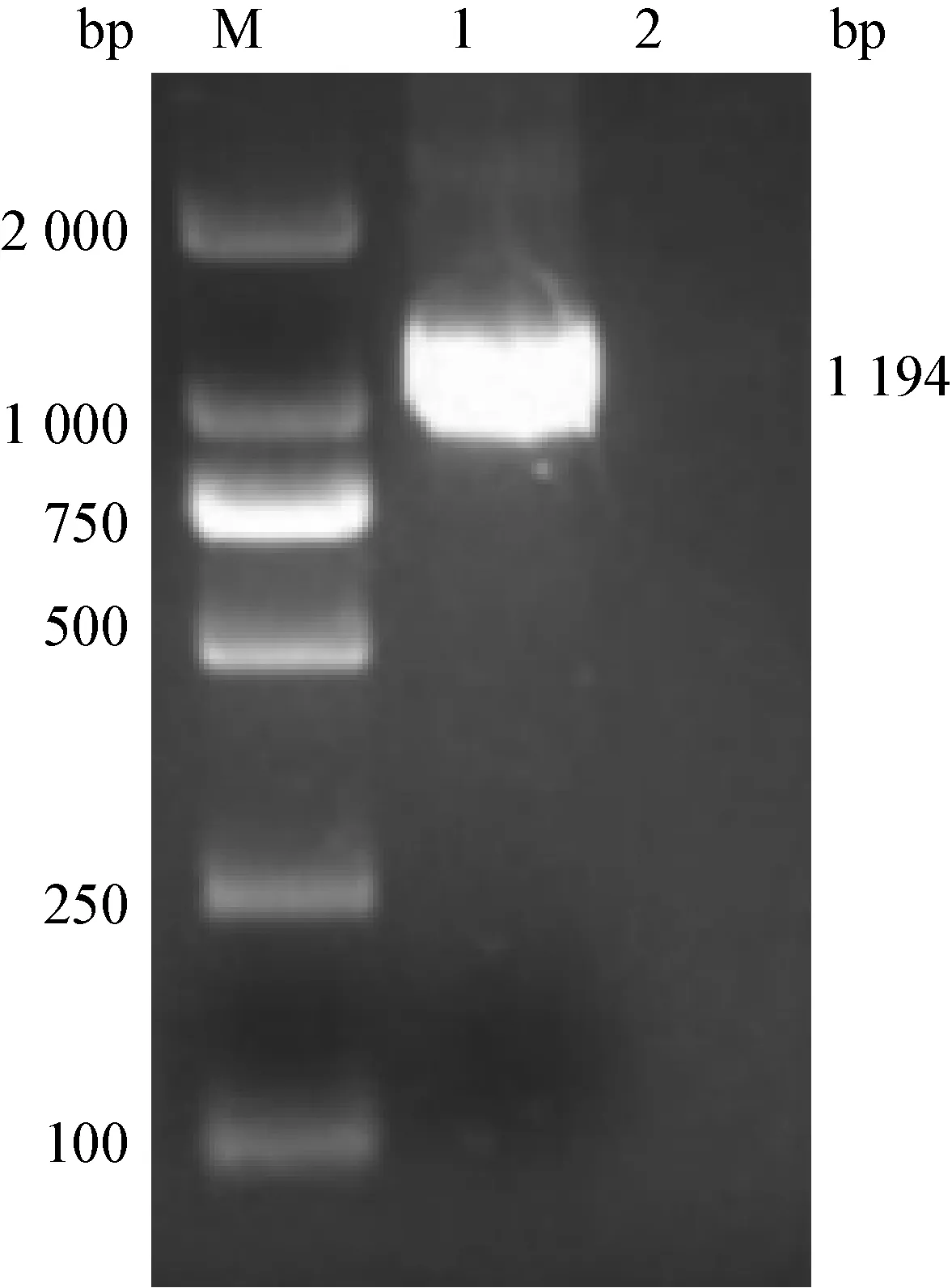
图1 VP6基因的扩增结果

图2 pET32a-VP6质粒双酶切鉴定
2.5 重组蛋白VP6-32a-DE3的纯化 10His标签蛋白纯化试剂盒(可溶性蛋白) 纯化结果,如中插彩版图5。
2.6 重组蛋白VP6-32a-DE3 Western Blot鉴定 纯化的重组蛋白VP6-32a-DE3 Western Blot鉴定,如中插彩版图6。
3 讨论
本研究表达的牛轮状病毒重组蛋白BRV-VP6-32a-DE3蛋白经15%SDS-PAGE分析,重组蛋白以包涵体和上清形式均有存在。经诱导后重组菌裂解其上清和沉淀以及重组蛋白经亲和层析后,Western Blot分析显示出单一的目的条带,约60 kDa。
RV是无囊膜的双链RNA病毒,20面体结构,属于呼肠孤病毒科成员,外部衣壳、内部衣壳和核心衣壳3层组成,结构蛋白VP6位于衣壳结构的中间层,在病毒粒子的形成中起着重要的作用[15],双股RNA作为病毒体的核心,由11个不连续的片段组成,编码VP1、VP2、VP3、VP4、VP6、VP7 6个结构蛋白和NSP1、NSP2、NSP3、NSP4、NSP5/NSP6 六个非结构蛋白。VP6蛋白的多肽折叠成2个不同的结构域,结构蛋白VP6位于分子的基部,并维持病毒的结构。从疏水性蛋白方面、病毒分组的特异性抗原方面和病毒株的分离鉴定上,VP6具有很强的抗原性和免疫原性,是诊断性试验中检测到的主要抗原,是介导RV特异性免疫反应的-黏膜免疫的主要抗原[16]。 Kohli E等[14]研究得到高效价的抗体,表明单克隆抗体与VP6蛋白的反应性以及用肽扫描连续7个肽,确定A群VP6蛋白含有群特异抗原表位。第6基因编码的内衣壳蛋白,VP6含有基因组的蛋白核心,占病毒蛋白量的51%,因其基因序列在各毒株间比较保守,它在病毒的复制装配中起着重要的作用。周芳等研究表明,在牦牛轮状病毒VP6基因序列分析及RT-PCR中所建立的检测方法具有良好的特异性和稳定性[17],只扩增出牦牛RV及BRV的特异性片段[18]。
牛腹泻是养牛生产中极为常见的疾病,尤其是初生犊牛腹泻更是极为棘手的问题,不仅造成了生产效率的低下,而且浪费了大量的人力、物力和财力。同时又因不同疾病在临床上导致的犊牛腹泻的症状类似不容易鉴别,为此迫切需要建立一种快速、便捷、易于操作的诊断试剂,本试验通过对内衣壳蛋白VP6基因的克隆、原核表达,为VP6作为诊断抗原开发奠定了一定基础。
