Ghrelin在马鹿器官组织中的表达
2018-08-01张召议王彩云杨银凤
张召议, 王彩云, 杨银凤
(1.内蒙古农业大学兽医学院, 内蒙古 呼和浩特 010018 ; 2.农业部动物临床诊疗技术重点实验室, 内蒙古 呼和浩特 010018)
马鹿属于偶蹄目鹿科的反刍动物。2008年被列入《世界自然保护联盟》濒危物种红色名录—低危(LC),我国Ⅱ级保护动物。马鹿的鹿茸是名贵中药材,鹿角是重要药用原料,鹿胎、鹿鞭、鹿尾和鹿筋也具有很高的经济价值。因此,马鹿是一种珍贵的经济动物。由于生存环境和饲养条件无法满足马鹿特殊要求,很容易产生多种疾病,甚至死亡。Ghrelin 是日本科学家Kojima等在小鼠和人胃内分泌细胞及下丘脑弓状核中发现的一种含有28个氨基酸残基的多肽。它是生长激素释放激素受体(GHS-R)天然的内源性配体,具有促进生长激素(GH)的释放、刺激食欲、调节能量代谢、促进胃蠕动、影响消化器官的发育和成熟等生物学效应[1]。Ghrelin分布广泛,在人的消化系统、生殖系统、神经系统和内分泌系统中均有表达[2]。Kaiya等研究发现,其在禽的消化系统、呼吸系统、泌尿系统和心血管系统中也有Ghrelin的表达[3-6]。随着研究的不断深入,Miller等人研究显示在成年绵羊的消化系统、生殖系统和淋巴系统内Ghrelin均有表达[7]。Kazak公绵羊的下丘脑、垂体、心脏、肝脏、瘤胃、网胃、瓣胃、皱胃、十二指肠和背最长肌均发现有Ghrelin mRNA的分布。黄治国等用RT-PCR和Real-time PCR检测雄性哈萨克羊和新疆细毛羊体内Ghrelin的表达及组织分布,发现所检测的各组织中均有Ghrelin表达[8]。有学者通过检测发现Ghrelin和GHS-R1a的mRNA及蛋白在羊卵母细胞中也有表达[9]。Wang等在0~56日龄羔羊胃肠道内均发现有Ghrelin的表达,其中在皱胃内的表达量明显高于瘤胃、网胃、十二指肠、空肠和回肠[10]。
运用RT-PCR技术证实Ghrelin基因在乌珠穆沁羊子宫体、输卵管、子宫颈和阴道组织内均有表达。在蒙古绵羊卵泡中检测到了Ghrelin mRNA及其多肽的存在[11]。目前有关Ghrelin在反刍动物体内的研究报道较少,且未见Ghrelin在马鹿各器官内的表达情况的报道。本试验以马鹿为实验动物,通过RT-PCR和Real-time PCR方法检测Ghrelin在其体内各组织器官中的表达情况,以阐述Ghrelin在马鹿体内的分布范围,了解分泌Ghrelin的主要器官,旨在为进一步探讨Ghrelin在马鹿体内各器官的作用提供理论依据。
1 材料与方法
1.1 试验动物 成年马鹿(雌性)1头。
1.2 主要试剂 RNAiso Plus(Total RNA 提取试剂盒, TaKaRa公司);反转录试剂盒PrimerScriptTMRT Reagent Kit with gDNA Eraser(TaKaRa公司);Premix TagTM(TaKaRa公司);SYBR Premix EX TagTMⅡ (Tli RNase Plus,TaKaRa公司);核酸染料、TAE、氯仿、异丙醇、琼脂糖、DL-2 000 Marker、75%乙醇。
1.3 试验方法
1.3.1 材料 马鹿屠宰后立即刮取舌、气管、食管、瘤胃、网胃、瓣胃、皱胃、十二指肠、空肠、回肠、盲肠、结肠、直肠和膀胱等器官的黏膜,并切取适量的大脑、下丘脑、肺、心肌、心内膜、肝、胰、脾、肾、输尿管、输卵管、子宫、阴道、垂体、松果体、颌下腺、腮腺、甲状腺、淋巴结、肾上腺、卵巢和骨骼肌等组织块,立即置于液氮中冷冻备用。
1.3.2 PCR引物的设计及合成 依据马鹿Ghrelin mRNA序列和引物设计原则设计1对特异性PCR引物1(P1、P2)。另外根据GenBank中马鹿β-actin序列设计了另一对PCR引物2(P3、P4)。引物序列见表1,以上序列均递送至上海生工生物工程技术服务有限公司进行合成。
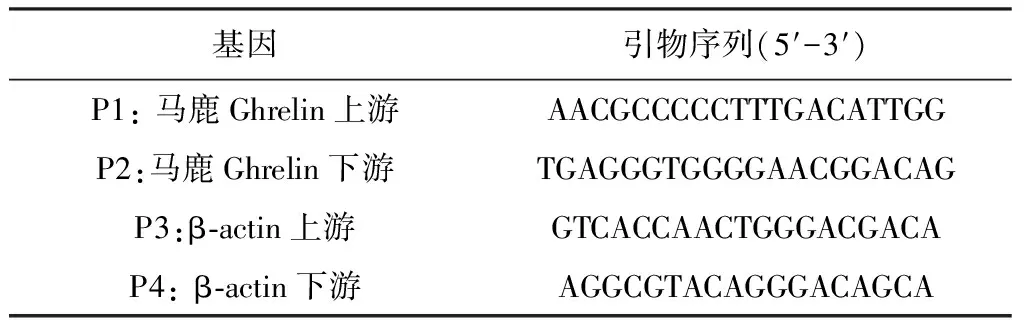
表1 β-actin、马鹿Ghrelin的引物序列
1.3.3 总RNA的提取 采用TaKaRa公司(日本)的RNAiso Plus Total RNA提取试剂盒,按其说明书进行,最后用ddH2O溶解RNA沉淀,于-80 ℃保存备用。
1.3.4 反转录反应 使用TaKaRa公司的反转录试剂盒,反应液配置在冰上进行。将6.5 μL的RNA加入到1.5 mL离心管中进行去除基因组DNA反应,反应体系为10 μL,其中RNase Free dH2O 0.5 μL、gDNA Eraser 1.0 μL、5×gDNA Eraser Buffer 2.0 μL,42 ℃水浴2 min。将此反应液加入到反转录体系中合成cDNA,反应体系为20 μL,其中RNase Free dH2O 4.0 μL、5×Prime Script Buffer 2(for Real Time) 4.0 μL、RT Primer Mix 1.0 μL、Prime Script RT Enzyme Mix I 1.0 μL。置于PCR仪进行反转录,反应条件为:37 ℃ 15 min,85 ℃ 5 s,存于-20 ℃备用。
1.3.5 定性表达检测 将反转录得到的cDNA进行PCR反应,反应体系为:PremixTaq(TaKaRaTaqTMVersion 2.0 plus dye) 12.5 μL、cDNA 0.5 μL、P1或P3 (20 μmol/L) 0.5 μL、P2或P4(20 μmol/L)0.5 μL、灭菌蒸馏水11 μL。PCR反应程序:94 ℃预变性5 min,94 ℃变性30 s,66.5 ℃退火30 s,72 ℃延伸30 s,35个循环72℃延伸7 min。PCR产物用1%琼脂凝胶电泳分离,然后用凝胶成像系统照相。
1.3.6 定量表达检测 以cDNA为模板,进行Real-time PCR反应。反应体系为20 μL:SYBR PreminExTaq(2×) 10 μL,P1或P3 (10 μmol/L) 0.8 μL,P2或P4 (10 μmol/L) 0.8 μL,10倍稀释的cDNA模板2 μL,dH2O 6.4 μL。反应程序为:扩增程序:95 ℃预变性30 s;95℃变性5 s,63 ℃退火34 s,45个循环;熔解程序:95 ℃ 5 s;60 ℃ 30 s;95 ℃ 15 s。每个样品的β-actin基因和Ghrelin基因分别做3个重复。Ghrelin的相对表达量采用2-△CT进行计算△CT= CTGhrelin—CTβ-actin。
1.3.7 统计分析 采用Spass 20.0 软件进行单因素方差分析,共分为36组,每组做3个重复。
2 试验结果
2.1 定性表达检测结果 为检测Ghrelin在马鹿体内可能表达的器官,根据本课题组呈送到GenBank中马鹿Ghrelin部分mRNA序列和引物设计原则设计1对预计扩增产物为166 bp的特异性PCR引物,同时为检测所提取的马鹿各器官RNA的完整性,根据马鹿β-actin序列设计1对预计产物为208 bp的引物,选用36鹿器官总RNA为模板进行RT-PCR反应后,经1%琼脂凝胶电泳进行检测,在马鹿的舌、食管、瘤胃、网胃、瓣胃、皱胃、十二指肠、空肠、回肠、盲肠、结肠、直肠、肝、胰、颌下腺、腮腺、气管、肺、肾、输尿管、膀胱、卵巢、输卵管、子宫、阴道、大脑、下丘脑、垂体、松果体、甲状腺、肾上腺、心肌、心内膜、脾、淋巴结和骨骼肌内均有约166 bp和208 bp 的扩增带(见图1)。

图1 马鹿组织Ghrelin RT-PCR的表达检测结果
1:心肌; 2:甲状腺; 3:松果体; 4:卵巢; 5:结肠; 6:瘤胃; 7:肾; 8:膀胱; 9:肺; 10:十二指肠; 11:回肠; 12:食管; 13:盲肠; 14:瓣胃; 15:心内膜; 16:脾; 17:子宫; 18:舌头; 19.皱胃; 20:肾上腺; 21:垂体; 22:网胃; 23:下丘脑; 24:空肠; 25:胰; 26:淋巴结; 27:输尿管; 28:肝; 29:颌下腺; 30:阴道; 31:结肠; 32:直肠; 33:大脑; 34:气管黏膜; 35:骨骼肌; 36:输卵管; M:DL-2000 DNA Marker
2.2 定量表达检测结果 马鹿Ghrelin Real-time PCR数据经SPSS 20.0软件分析,在以上检测的36种器官内均有Ghrelin表达且相对表达量差异显著,如图2所示Ghrelin在皱胃内的表达量显著高于其他器官(P<0.05),其次是胰、子宫、卵巢、十二指肠和食管,且与舌、瘤胃、网胃、瓣胃、空肠、回肠、盲肠、结肠、直肠、大脑、下丘脑、气管黏膜、肺、心肌、心内膜、肝、脾、肾、输尿管、膀胱、输卵管、阴道、垂体、松果体、颌下腺、腮腺、甲状腺、淋巴结、肾上腺和骨骼肌等器官内的表达量相比差异显著(P<0.05)。
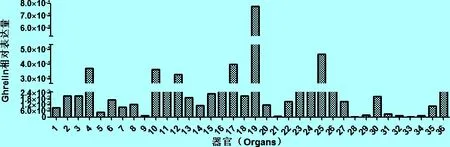
图2 Ghrelin相对表达量(P<0.05)
3 讨论
3.1 定性表达 Ghrelin是一种主要在胃部产生,然后作用于中枢神经系统的脑肠肽[12]。它在小肠、大肠、胰腺、胎盘中有表达,在下丘脑弓状核也检测出有其mRNA表达[13]。许多研究者采用多种生物学手段研究Ghrelin在不同动物组织器官内的表达情况。它也广泛分布在反刍动物各器官中。本试验通过RT-PCR方法检测此马鹿体内可能表达Ghrelin的器官,结果发现,在所检测的器官内均有表达。由此推测,Ghrelin可能在马鹿群体各器官组织中广泛表达。王家乡等采用RT-PCR方法研究Ghrelin在非洲雏鸵鸟胃肠道内的分布变化,结果表明,Ghrelin除在空肠、结肠不表达外,在消化道的其他部位均有表达[5]。而本试验显示Ghrelin在空肠、结肠同样表达,这些结果的不同可能是由于种属差异性,但也可能与样本数量过少有关,这一问题还有待于进一步研究。
3.2 定量表达 黄治国等用RT-PCR和Real-time PCR检测雄性哈萨克羊和新疆细毛羊体内Ghrelin的表达及组织分布,发现所检测的各组织中均有Ghrelin表达,并且在皱胃内的表达量远高于其他器官[8]。本试验以马鹿为研究对象,采用Real-time PCR方法检测Ghrelin在不同器官内的表达量,结果显示,Ghrelin在所检测的36种器官内的表达量之间存在显著差异,且在皱胃内的表达量最高。同时张曼、刘骄等用RT-PCR和qPCR方法分别检测驯鹿和梅花鹿体内Ghrelin的表达,结果显示,在皱胃内的表达量高于其他被检测的器官[14-15]。因此,笔者推测Ghrelin可能在马鹿群体的皱胃内表达量最高。由于马鹿是我国Ⅱ级保护动物,在开展试验的过程中只能选取被淘汰的马鹿作为研究对象,因此本试验存在样本过少等问题,后续试验在条件允许时将进一步扩大样本数量进行研究。此试验为今后进一步研究Ghrelin在马鹿群体各组织器官中的表达情况奠定了实验基础,进而为后续研究Ghrelin在反刍动物各组织中的共性表达提供理论依据。
4 结论
本试验结果表明,Ghrelin在被测马鹿中的36个器官内均有表达,且在皱胃内的表达量最高,其次是胰、子宫、卵巢、十二指肠和食管,其他器官的表达量相对较低。
