小型猪腹腔镜肝缺血再灌注合并肝部分切除对肝细胞凋亡及相关基因影响的研究
2018-08-01张千振葛延松焦智慧张建涛王洪斌
张千振, 葛延松, 焦智慧, 李 辉, 白 鸽, 张建涛, 王洪斌
(东北农业大学动物医学学院, 黑龙江 哈尔滨 150030)
缺血再灌注损伤(IRI)是一种多因素参与的病理生理过程。肝脏是血供丰富和存在大量内皮细胞的器官,因此肝脏对缺血再灌注损伤非常敏感。肝脏缺血再灌注损伤(HIRI)是肝脏术后肝功能衰竭的重要因素之一,它多见于肝脏外科手术过程中,如肝部分切除术及肝移植术等[1]。研究表明,肝脏缺血再灌注损伤导致的细胞死亡,包括细胞坏死和细胞凋亡[2]。细胞凋亡是由特定的凋亡基因调控的程序性死亡,在维持机体内环境稳态和机体发育中至关重要[3]。腹腔镜技术具有切口小、损伤轻、恢复快的特点,并且成功应用于肝脏外科手术中。目前腹腔镜肝切除手术过程中缺血再灌注损伤对细胞凋亡的影响迄今未见报道,本研究应用腹腔镜技术建立小型猪肝脏缺血再灌注合并肝部分切除损伤模型,并检测凋亡相关基因Bax、Bcl-2 mRNA的表达及Caspase-3、Caspase-9酶活性,分析小型猪腹腔镜肝损伤与细胞凋亡的关系,为探讨缺血再灌注损伤的发病机制和保护性研究提供理论依据。
1 材料与方法
1.1 实验动物 广西巴马小型猪12头,4~6月龄,体重25~35 kg,经实验室和临床检查健康,整个试验过程中饲养管理环境一致。
1.2 主要设备与试剂 腹腔镜手术基本设备,Olympus 公司生产;左弯分离钳、直角分离铅、无损伤肠钳、弯头剪刀、单极电凝球、单极电凝钩、冲洗/吸引管,杭州光典公司生产;IntelliiVue MP30型重症监护仪,德国Philips公司生产;小型猪复合麻醉剂(XFM),东北农业大学兽医外科教研室配制;丙泊酚注射液,西安力邦制药有限公司,批号1404271;硫酸阿托品注射液,新乡市常乐制药有限责任公司,批号1605047 2;酚磺乙胺注射液,新乡市常乐制药有限责任公司,批号1605297 3;TRIZol试剂购自美国Invitrogen公司;反转录试剂盒,购自东洋纺;引物购自上海生工生物工程技术服务有限公司;Caspase-3和Caspase-9活性检测试剂盒,均为碧云天生物技术研究所生产;TUNEL凋亡检测试剂盒,购自美国罗氏公司。
1.3 手术方法 将12头巴马小型猪随机分为假手术组(Sham组)和模型组(IRI组)。假手术组仅建立气腹60 min,模型组进行腹腔镜右半肝缺血60 min+左半肝切除。术前禁食24 h,禁水12 h。麻醉前肌肉注射硫酸阿托品注射液(0.04 mg/kg·bw),15 min后耳缘静脉注射小型猪复合麻醉剂(0.02 mL/kg·bw)、丙泊酚注射液(0.5 mL/kg·bw)进行诱导麻醉。完成气管插管后,连接呼吸麻醉机,呼吸频率为15~20次/min,吸呼比为1∶2,潮气量为10~15 mL/kg·bw,异氟烷维持麻醉,浓度维持在2.5%~4%。小型猪仰卧保定,术部剃毛、消毒、铺盖创巾。
腹腔镜右半肝缺血60 min+左半肝切除组(I/R组):采用四套管法建立气腹和手术通路,通入CO2维持气腹压在10 mmHg。在腹腔镜视野下切断肝圆韧带、镰状韧带、左右三角韧带及冠状韧带,充分游离肝叶。首先助手用肠钳将右肝内叶提起,术者利用左弯分离钳和直分离钳将胆囊管和胆囊动脉与肝实质充分分离,同时将自制止血带从胆囊管和胆囊动脉底部穿过,穿过右内叶基部;另一根止血带同样穿过右外叶基部,同时收紧两条止血带,持续阻断右半肝入肝血流60 min。缺血结束后,松开卡扣,撤出两条止血带,恢复右半肝血供,同时进行左半肝切除。在左内叶与右内叶分界线(肝中裂)用带线双针三排贯穿结扎肝实质,每排3~4针。用电凝球在结扎线左侧1~2 cm处做一预切线,并用电凝钩在预切线处离断肝实质,将左内叶和左外叶全部切除。检查断面有无出血点,利用电凝球和纱布止血,用冲洗器冲洗腹腔。将自封袋送入腹腔,切除的肝组织及止血带和卡扣装入袋内,扩大套管腹壁切口至4 cm左右,将自封袋从腹腔取出,关闭气腹。在腹底部套管放置1根引流管,并在体外固定,按常规手术操作闭合腹腔,切口周围涂碘酊消毒。
1.4 样本采集及指标检测
1.4.1 样本采集及处理 各组分别于术前、术后即刻、术后1、3、7 d采集肝组织样本,将肝组织分成2份:一份肝组织分装置于冻存管并放入液氮中保存;另1份肝组织置于多聚甲醛固定液中固定,然后行常规脱水、浸蜡、包埋等处理。
1.4.2 酶活性检测 根据Caspase-3、9活性检测试剂盒说明书,应用酶标仪检测各组织样本的OD值(405nm),根据标准曲线计算各样本Caspase-3、Caspase-9酶活性。
1.4.3 qRT-PCR检测Bax、Bcl-2 mRNA的表达 TRIZol法提取肝组织总RNA,实时荧光定量PCR试剂盒进行反转录和PCR反应。Bax、Bcl-2及β-actin 引物根据GenBank中相应基因序列设计,Bax引物序列:上游引物:5′-TTCAGGGTTTCATCCAGGATCG-3′,下游引物:5′-ATCCTCTGCAGCTCCATGTTAC-3′;Bcl-2引物序列:上游引物:5′-GAGGATTGTGGCCTTCTTTG-3′,下游引物:5′-GCCGGTTCAGGTACTCAGTC-3′;β-actin引物序列:上游引物:5′-TCTGGCAACCACACCTTCT-3′,下游引物:5′-TGATCTGGGTCATCTTCTCAC-3′。反应体系为10 μL,反应条件为95 ℃预变性15 s;扩增95 ℃ 15 s,60 ℃ 60 s,60 ℃ 30 s共40个循环,采用2-ΔΔCt法计算相对表达量。
1.4.4 肝细胞凋亡的检测 各时间点采集肝组织并置于10%多聚甲醛固定液中,24 h后石蜡包埋并切片,按标准操作脱蜡和再水化组织。采用微波照射进行抗原修复,PBS冲洗2次后,将TUNEL反应混合液滴加在样品上,置于湿盒中避光孵育60 min(37 ℃)。PBS冲洗3次,滴加辣根过氧化物酶标记的POD,湿盒中避光孵育30 min(37 ℃)。PBS冲洗3次,加入DAB显色,苏木素复染后封片。光学显微镜观察(400倍)显示细胞核为棕黄色为阳性细胞。每张切片选择5个视野观察凋亡情况,并计算出肝细胞凋亡指数(AI)。肝细胞凋亡指数计算公式:AI=凋亡细胞数/肝细胞总数×100%。
2 结果
2.1 TUNEL染色结果 组间比较,两组AI在术后即刻差异显著(P<0.01或P<0.05),术后1 d、3 d差异极显著(P<0.01)。两组术后AI均呈现先升高后降低的趋势。假手术组在术后即刻与术前相比差异显著(P<0.01或P<0.05),术后1 d与术前相比差异极显著(P<0.01)。模型组在术后即刻、术后1 d、3 d与术前相比差异极显著(P<0.01),在术后1 d达到峰值,见封二彩版图1及表1。
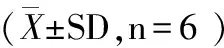
表1 不同时间点两组肝细胞AI的变化
注:与术前相比,*表示差异显著(P<0.01或P<0.05),**表示差异极显著(P<0.01);模型组与假手术组相比,#表示差异显著(P<0.01或P<0.05),##表示差异极显著(P<0.01),下表同
2.2 肝组织Bax、Bcl-2 mRNA表达的变化
2.2.1 Bax mRNA表达水平 组间比较,两组Bax mRNA表达在术后即刻、术后1 d、3 d差异极显著(P<0.01)。两组术后Bax mRNA表达均呈现先升高后降低的趋势。假手术组在术后即刻与术前相比差异极显著(P<0.01),其余时间点差异不显著(P>0.05)。模型组在术后即刻、术后1 d、3 d与术前相比差异极显著(P<0.01),在术后1 d达到峰值,见表2。
2.2.2 Bcl-2mRNA表达水平 组间比较,两组Bcl-2 mRNA表达在术后即刻、术后1 d、3 d差异极显著(P<0.01)。假手术组在术后即刻与术前相比差异极显著(P<0.01),其余时间点差异不显著(P>0.05)。模型组Bcl-2 mRNA 表达呈现先降低后升高的趋势,在术后即刻、术后1 d与术前相比差异极显著(P<0.01),在术后即刻达到最低值,见表2。
2.2.3 Bax/Bcl-2比值 组间比较,两组Bax/Bcl-2比值在术后即刻、术后1 d、3 d差异极显著(P<0.01)。假手术组在术后1 d与术前相比差异极显著(P<0.01),其余时间点差异不显著(P>0.05)。模型组Bax/Bcl-2比值表达水平均呈现先升高后降低的趋势,在术后即刻、术后1 d、3 d与术前相比差异极显著(P<0.01),在术后1 d达到峰值,见表2。

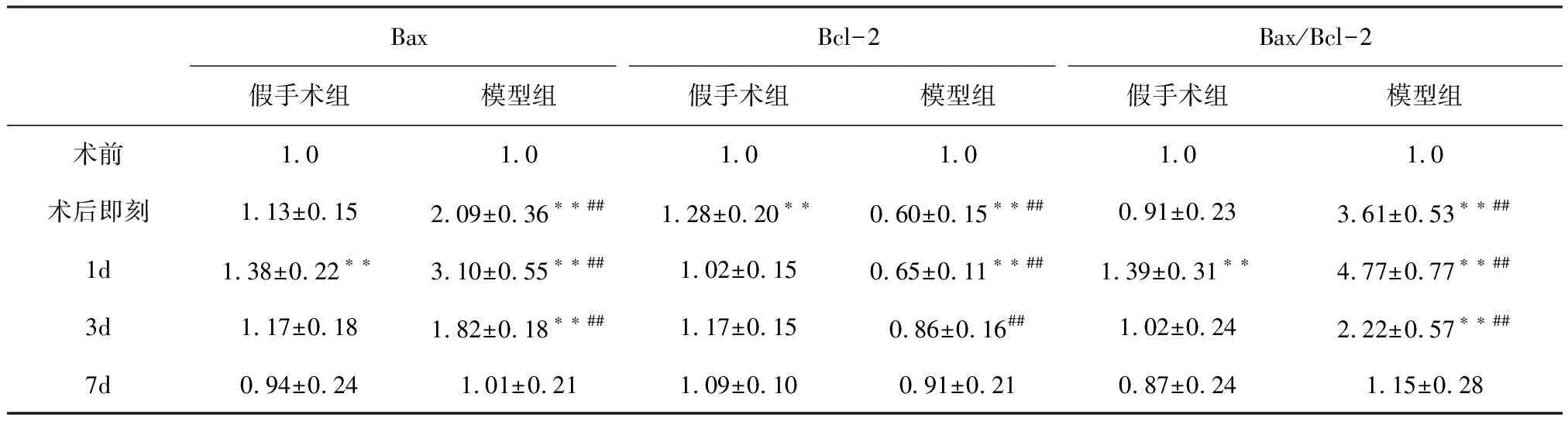
BaxBcl-2Bax/Bcl-2假手术组模型组假手术组模型组假手术组模型组术前1.01.01.01.01.01.0术后即刻1.13±0.152.09±0.36∗∗##1.28±0.20∗∗0.60±0.15∗∗##0.91±0.233.61±0.53∗∗##1d1.38±0.22∗∗3.10±0.55∗∗##1.02±0.150.65±0.11∗∗##1.39±0.31∗∗4.77±0.77∗∗##3d1.17±0.181.82±0.18∗∗##1.17±0.150.86±0.16##1.02±0.242.22±0.57∗∗##7d0.94±0.241.01±0.211.09±0.100.91±0.210.87±0.241.15±0.28
2.3 肝组织Caspase-3、Caspase-9活性变化
2.3.1 Caspase-9活性 组间比较,两组Caspase-9活性在术后即刻、1 d、3 d差异极显著(P<0.01)。两组术后Caspase-9活性均呈现先升高后降低的趋势。假手术组在术后1 d与术前相比差异极显著(P<0.01),其余时间点无显著差异(P>0.05)。模型组在术后即刻、术后1 d与术前相比差异极显著(P<0.01),在术后1 d达到峰值。见表3。
2.3.2 Caspase-3活性 组间比较,两组Caspase-3活性在术后1 d、3 d差异极显著(P<0.01)。两组术后Caspase-3活性均呈现先升高后降低的趋势。假手术组在术后1 d与术前相比差异极显著(P<0.01),其余时间点无显著差异(P>0.05)。模型组在术后即刻与术前相比差异显著(P<0.01或P<0.05),术后1 d、3 d与术前相比差异极显著(P<0.01),在术后1 d达到峰值,见表3。
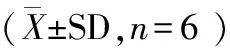
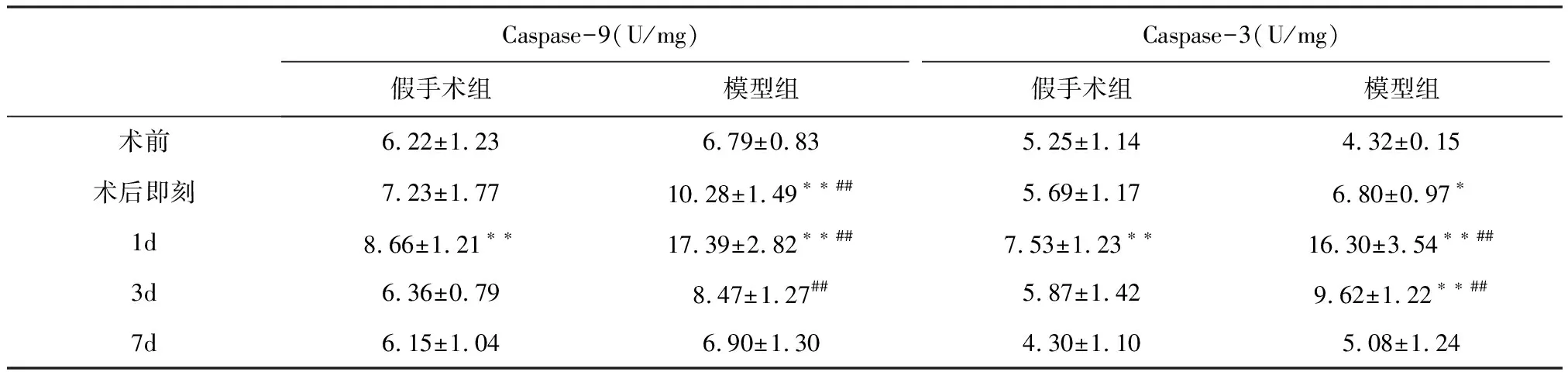
Caspase-9(U/mg)Caspase-3(U/mg)假手术组模型组假手术组模型组术前6.22±1.236.79±0.835.25±1.144.32±0.15术后即刻7.23±1.7710.28±1.49∗∗##5.69±1.176.80±0.97∗1d8.66±1.21∗∗17.39±2.82∗∗##7.53±1.23∗∗16.30±3.54∗∗##3d6.36±0.798.47±1.27##5.87±1.429.62±1.22∗∗##7d6.15±1.046.90±1.304.30±1.105.08±1.24
3 讨论
自1991年Reich等[4]报道了腹腔镜肝良性肿瘤切除以来,腹腔镜技术在肝脏外科领域的应用迅速发展。目前应用腹腔镜技术可完成半肝切除术、扩大半肝切除术、巨大肿瘤切除术及活体肝移植供肝切除术等[5]。肝脏是血供比较丰富的器官,肝脏手术过程中出血的控制非常关键。Pringle法对于入肝血流阻断最为常见,止血效果好、操作简单,但是此法容易导致缺血再灌注损伤[6]。近年来研究表明,组织、器官缺血再灌注损伤可诱导细胞凋亡,认为细胞凋亡是缺血再灌注损伤的机制之一[7-9]。
本研究中通过TUNEL法检测肝细胞凋亡,发现模型组凋亡细胞明显高于假手术组,证实了小型猪腹腔镜肝脏缺血再灌注合并肝部分切除损伤可诱导肝细胞凋亡的发生。研究表明,细胞凋亡主要通过受体途径、内质网途径和线粒体途径发生,后者受线粒体膜通透性的调控[10]。Bcl-2基因家族包括促凋亡因子(Bax,Bak,Bid)和抗凋亡因子(Bcl-2,Bcl-xl,Bcl-w),在线粒体凋亡途径中发挥重要的作用。Bax是Bcl-2家族中重要的促凋亡基因,具有颉颃Bcl-2的作用,Bax与Bcl-2的比值决定细胞受刺激后是否发生凋亡[11]。当Bax相对表达量高于Bcl-2时,Bax可通过改变线粒体膜通透性促进细胞色素c释放到细胞浆中,引发Caspase级联反应并活化Caspase-3,导致细胞凋亡[12]。本研究发现,模型组术后即刻、1 d、3 d Bax mRNA表达水平较术前显著升高,在术后1 d达到峰值,且显著高于假手术组;模型组术后即刻、1 d Bcl-2 mRNA表达水平较术前显著降低,且显著低于假手术组。宋晓静[13]等研究发现,大鼠肝脏缺血60 min,恢复血液供应2 h后Bcl-2 mRNA表达水平较假手术组显著降低,Bax mRNA水平较假手术组显著升高。Jin[14]等将大鼠肝脏血流阻断30 min后,检测再灌注1 h,2 h,6 h,24 h Bax和Bcl-2 mRNA表达水平,发现再灌注后Bcl-2 mRNA表达随着再灌注时间的延长逐渐降低,Bax mRNA表达随着再灌注时间的延长逐渐升高。结合本研究结果,提示Bax和Bcl-2参与小型猪腹腔镜肝损伤中肝细胞凋亡的调控。
Caspase家族通过一系列级联反应参与细胞凋亡的调控,包括凋亡启动子(Caspase-2、8、9)和凋亡执行因子(Caspase-3、6、7)。凋亡启动子处于级联反应的上游,活化后进一步激活下游的凋亡执行因子,通过作用于特异性底物诱导细胞凋亡[15]。Dirk等[16]研究发现,大鼠肝脏缺血60 min再灌注4 h后,Caspase-3活性较假手术组相比明显升高。有文献报道,在大鼠肝脏缺血60 min再灌注8 h后Caspase-9、Caspase-3mRNA和蛋白水平明显升高,提示Caspase-9和Caspase-3在细胞凋亡过程中发挥重要作用[17]。本研究发现,小型猪肝损伤后,肝组织中Caspase-9、Caspase-3活性显著高于假手术组,模型组Caspase-9活性极显著升高的时间点要早于Caspase-3,提示肝损伤后Caspase-9首先被活化,然后激活Caspase-3,进一步引起细胞凋亡。因此,小型猪腹腔镜肝损伤模型可能通过Caspases依赖途经介导了肝细胞凋亡。
4 结论
小型猪腹腔镜肝脏缺血再灌注合并肝部分切除损伤可诱导肝细胞凋亡,其机制可能与Bax转录水平升高,Bcl-2转录水平降低,Caspase-3和Caspase-9活性增强有关。
