氯化钾和氯化铵对葛仙米的生理影响
2018-08-01刘树文杨川黔
刘树文, 杨川黔
(贵州师范学院化学与生命科学学院,贵州贵阳 550018)
葛仙米(NostocsphaeroidesKützing.)生长于水稻田中,别称“天仙米”“天仙菜”“田木耳”,是一种药、食两用固氮蓝藻。《本草纲目》记载,自东晋开始,葛仙米就被作为一种美食和中草药成分,至今已有1 500多年的历史[1]。其蛋白质含量较高,含有丰富的人体必需的各种氨基酸、脂肪酸、维生素以及矿质元素,并且含有具有多种药用价值的各种多糖、色素等,还含有超氧化物歧化酶等生理活性物质[2-3]。据《本草纲目》《全国中草药汇编》以及《本草纲目拾遗》等记载,葛仙米性寒、味淡,具有明目益气、解热清膈、消除疲劳、久食延年,能治疗目赤红肿、夜盲症、脱肛、烫伤,兼具美容护肤之功效,具有很高的药用和保健价值[4]。葛仙米在保健食品、食品添加剂、动物饲料、医药、美容以及精细化加工品等领域也具有广阔的开发应用前景[4-5]。
葛仙米作为我国传统出口的珍贵产品,同时在国内市场也占有举足轻重的地位。葛仙米市场供不应求,价格昂贵,只有少数人能品尝到这种珍稀的食用蓝藻[6]。野生葛仙米在世界范围内分布稀少,主要分布在我国湖北省鹤峰县走马镇周围的水稻田中,非洲有少量分布,也曾在陕西、湖北、广西、广东等省(区)有发现[1]。葛仙米的生长期为每年的11月份到第二年的5月份[1,7]。野生葛仙米产量甚微,大概每年 7.5 kg/hm2左右[7]。湖北省鹤峰县适于葛仙米生长的水稻田有 796 hm2,但最大年产量已由25年前的25 t锐减至0.5 t[1]。为了保护野生葛仙米资源并使其得到合理的开发利用,关于葛仙米的生理生态学以及野生葛仙米的人工培养方面的研究引起了学者的广泛关注[7]。陈珍研究了除草剂、杀虫剂等农药对葛仙米的毒害效应,农药的使用已被认为是葛仙米减产的重要原因之一[7]。
NH4Cl和KCl是水稻田中广泛施用的2种含氯氮肥和钾肥。李云广等研究了高浓度的NaCl对葛仙米生理生化特性的影响[8]。陈珍等研究表明1 mmol/L NH4Cl抑制了葛仙米的光合作用和呼吸作用速率[7,9]。本试验将比较研究 1 mmol/L NH4Cl和1 mmol/L KCl 2种含氯化肥对葛仙米的生理生化特性的影响,为野生葛仙米资源的生态保护提供理论依据,为葛仙米保护区稻田的合理施肥提供指导。
1 材料与方法
1.1 葛仙米的培养
葛仙米采自贵州省岑巩县凯本乡沈家湾村的水稻田中,在实验室内制作得到人工培养的无杂藻和杂菌的葛仙米藻种。配制BG110培养基,121 ℃灭菌30 min。藻种经过匀浆之后,分别接种到9个经高压灭菌的500 mL锥形瓶中,加入 450 mL BG110培养基。分成3组,每组3个重复。1组用BG110培养基、1组用含1 mmol/L KCl的BG110培养基、1组用含1 mmol/L NH4Cl的BG110培养基培养葛仙米。培养温度为25 ℃,用30 W日光灯提供光照,光照度通过照度计测定,培养光照度为1 500 lx。用空气泵通入用0.22 μm滤膜过滤的无菌空气,通气量为300 mL/min,经过8 d光照培养,取藻样测定各项生理指标。
1.2 比生长速率的测定
葛仙米在BG110、含1 mmol/L KCl的BG110以及含 1 mmol/L NH4Cl的BG1103种不同的培养液中培养8 d,分别培养0、2、4、6、8 d后,从9个锥形瓶中各取藻液10 mL,离心30 min,去上清液,加3 mL 95%乙醇,振荡,放入4 ℃冰箱中24 h。4 000 r/min离心30 min后,取上清液,用分光光度计测定D665 nm和D649 nm。
叶绿素a(chlorophyll a,简称Chl a)含量计算公式[10]:
Chla(mg/L)=13.95×D665 nm-6.88×D649 nm。
(1)
比生长速率的计算公式[7]:
μ=(lnX1-lnX2)/(T2-T1)。
(2)
式中:X1、X2分别是T1(0 d)、T2(8 d)的叶绿素a含量。
1.3 各种光合色素含量的测定
葛仙米在BG110、含1 mmol/L KCl的BG110以及含 1 mmol/L NH4Cl的BG1103种不同的培养液中培养6 d,分别从9个培养瓶中各取20 mL藻液,4 000 r/min离心30 min,去上清液,加3 mL 95%乙醇,4 ℃冰箱中放置24 h后 4 000 r/min 离心30 min,取上清液,用分光光度计在波长665、649、470 nm下测定吸光度D[16]。叶绿素b和类胡萝卜素(carotenoid,简称Car)含量依据下列公式计算:
Chlb(mg/L)=24.96×D649 nm-7.32×D665 nm;
(3)
Car(mg/L)=1 000×D470 nm-2.05×Chla-114.8×Chlb。
(4)
葛仙米在BG110、含1 mmol/L KCl的BG110以及含 1 mmol/L NH4Cl的BG1103种不同的培养液中培养6 d,分别从9个培养瓶中各取20 mL藻液,4 000 r/min离心30 min,去上清液,加入4 mL 0.1 mol/L pH值7.0的磷酸缓冲液,冰浴匀浆90次后4 000 r/min离心30 min。取上清液,用分光光度计测定上清液在波长562、615、652 nm下测定吸光度D。再计算出藻蓝蛋白(phycocyanin,简称PC)、别藻蓝蛋白(allophycocyanin,简称APC)、藻红蛋白(phycoerythrin,简称PE)的含量。根据Siegelman & Kycia计算[11]:
PC(mg/mL)=(D615 nm-0.474×D652 nm)/5.34;
(5)
APC(mg/mL)=(D652 nm-0.208×D615 nm)/5.09;
(6)
PE(mg/mL)=(D562 nm-2.41×PC-0.849×APC)/9.62。
(7)
1.4 蛋白质含量的测定(考马斯亮蓝G-250染色法[10])
葛仙米在BG110、含1 mmol/L KCl的BG110以及含 1 mmol/L NH4Cl的BG1103种不同的培养液中培养6 d,从9个培养瓶中各取20 mL藻液,4 000 r/min离心30 min,去上清液,加4 mL 0.1 mol/L pH值7.0的磷酸缓冲液,冰浴匀浆90次,4 000 r/min离心30 min。提取得到的葛仙米蛋白溶液通过考马斯亮蓝G-250法测定。
1.5 可溶性糖含量的测定(蒽酮法[10])
葛仙米在BG110、含1 mmol/L KCl的BG110以及含 1 mmol/L NH4Cl的BG1103种不同的培养液中培养6 d,从9个培养瓶中各取20 mL藻液,4 000 r/min离心30 min,去上清液,加4 mL蒸馏水,冰浴匀浆90次,4 000 r/min离心30 min。提取得到的葛仙米可溶性糖溶液通过蒽酮法测定。
1.6 丙二醛含量的测定(硫代巴比妥酸法)
葛仙米在BG110、含1 mmol/L KCl的BG110以及含 1 mmol/L NH4Cl的BG1103种不同的培养液中培养6 d,从9个培养瓶中各取藻液20 mL,4 000 r/min离心30 min,去上清液,加5% TCA 5 mL,冰浴匀浆90次,4 000 r/min离心30 min后,分别取上清液2 mL放入相应带盖的试管中,再向每支试管中加0.67% TBA 2 mL,混合后沸水浴30 min,冷却后 4 000 r/min 离心30 min后,取上清液,用分光光度计在波长450、532、600 nm下测定吸光度D,按公式C(μmol/L)=6.45(D532 nm-D600 nm)-0.56D450 nm计算出MDA浓度。样品MDA含量(μmol/mg叶绿素)=C(μmol/L)×5/20/叶绿素浓度(mg/L)。
1.7 统计分析
利用软件STATISTICA®7.0(StatSoft Inc,Tulsa,OK,USA)进行统计分析处理。单因素方差分析(ANOVA)和Tukey’s显著性检验(HSD)用来检测不同处理间的显著性水平。正态分布和方差同质性分析分别根据Lilliefors检验和Levene检验。
2 结果与分析
2.1 KCl和NH4Cl对葛仙米生长的影响
BG110培养基、含1 mmol/L KCl的BG110培养基以及含 1 mmol/L NH4Cl的BG110培养基3种培养条件下培养葛仙米的生长曲线见图1。葛仙米分别在BG110培养基、含1 mmol/L KCl的BG110培养基中培养8 d后,以叶绿素含量表示的生物量分别增加到0 d的4.34、3.95倍;而在含1 mmol/L NH4Cl的BG110培养基中培养8 d后葛仙米的生物量降低到0 d的0.31倍。4 d以后1 mmol/L NH4Cl对葛仙米的生长有明显的抑制作用,而1 mmol/L KCl对葛仙米的生长没有明显影响。
葛仙米分别在用BG110培养基、含1 mmol/L KCl的BG110培养基、含1 mmol/L NH4Cl的BG110培养基培养8 d后葛仙米的比生长速率见表1。在1 mmol/L KCl的BG110培养基中培养的葛仙米的比生长速率略低于BG110培养下葛仙米的比生长速率,但两者之间无显著差异(P>0.05)。但1 mmol/L NH4Cl的BG110培养基中生长的葛仙米的比生长速率为负值,与BG110培养基中培养的葛仙米的比生长速率相比降低了168.4%(P<0.05)。
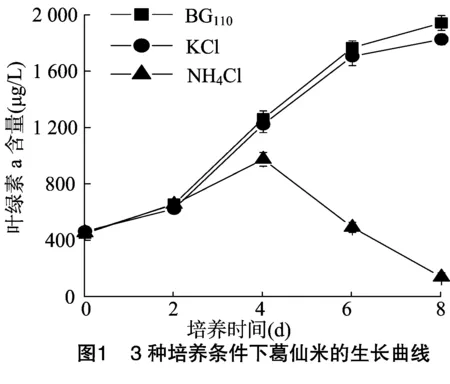

表1 3种培养条件下培养8 d后葛仙米的比生长速率
注:同列数据后不同小写字母表示差异显著(P<0.05),相同字母表示差异不显著。下表同。
2.2 KCl和NH4Cl对葛仙米光合色素含量的影响
葛仙米在BG110、含1 mmol/L KCl的BG110以及含 1 mmol/L NH4Cl的BG1103种不同的培养液中培养6 d后,葛仙米的3种藻胆蛋白(藻蓝蛋白、别藻蓝蛋白、藻红蛋白)含量见表2。与BG110培养基中培养葛仙米相比,1 mmol/L KCl的BG110培养基中培养葛仙米的藻蓝蛋白、别藻蓝蛋白、藻红蛋白3种藻胆蛋白分别降低了23.7%、16.1%和21.5%,但无显著差异(P>0.05);1 mmol/L NH4Cl的BG110培养基中培养葛仙米的藻蓝蛋白、别藻蓝蛋白、藻红蛋白3种藻胆蛋白分别降低了71.6%、74.6%和71.1%,且有显著差异(P<0.05)。
葛仙米在BG110、含1 mmol/L KCl的BG110以及含 1 mmol/L NH4Cl的BG1103种不同的培养液中培养6 d后,葛仙米的叶绿素a、类胡萝卜素2种光合色素含量见表3。与BG110培养基中培养葛仙米相比,1 mmol/L KCl的BG110培养基中培养葛仙米的藻蓝蛋白、别藻蓝蛋白、藻红蛋白3种藻胆蛋白分别降低了3.4%、5.8%,但无显著差异(P>0.05);1 mmol/L NH4Cl的BG110培养基中培养葛仙米的藻蓝蛋白、别藻蓝蛋白、藻红蛋白3种藻胆蛋白分别降低了72.2%、52.8%,且有显著差异(P<0.05)。
2.3 KCl和NH4Cl对葛仙米可溶性蛋白质含量的影响
由图2可见,溶液中可溶性蛋白质含量(y)与考马斯亮蓝染色后的可溶性蛋白质溶液在595 nm波长下的吸光度(x)之间的直线方程为:y=0.002x+0.006(r2=0.997)。葛仙米在BG110、含1 mmol/L KCl的BG110以及含 1 mmol/L NH4Cl的BG1103种不同的培养液中培养6 d后,葛仙米的可溶性蛋白质含量见图3。与BG110培养基中培养葛仙米相比,1 mmol/L KCl的BG110培养基、1 mmol/L NH4Cl的BG110培养基中培养葛仙米的可溶性蛋白质含量分别降低了 5.7%(P>0.05)和53.0%(P<0.05)。

表2 3种培养条件下培养6 d后葛仙米3种藻胆蛋白含量
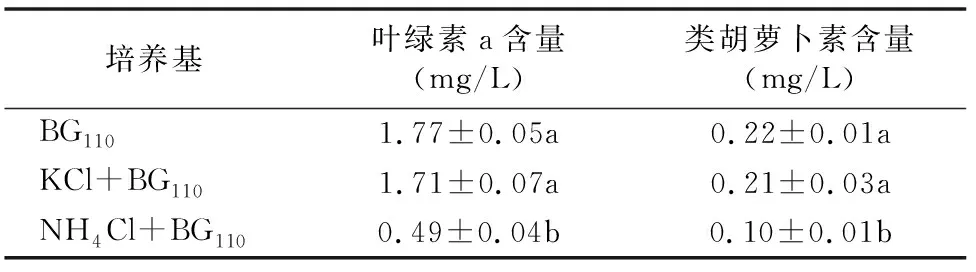
表3 3种培养条件下培养6 d后葛仙米叶绿素a和类胡萝卜素含量


2.4 KCl和NH4Cl对葛仙米可溶性糖含量的影响
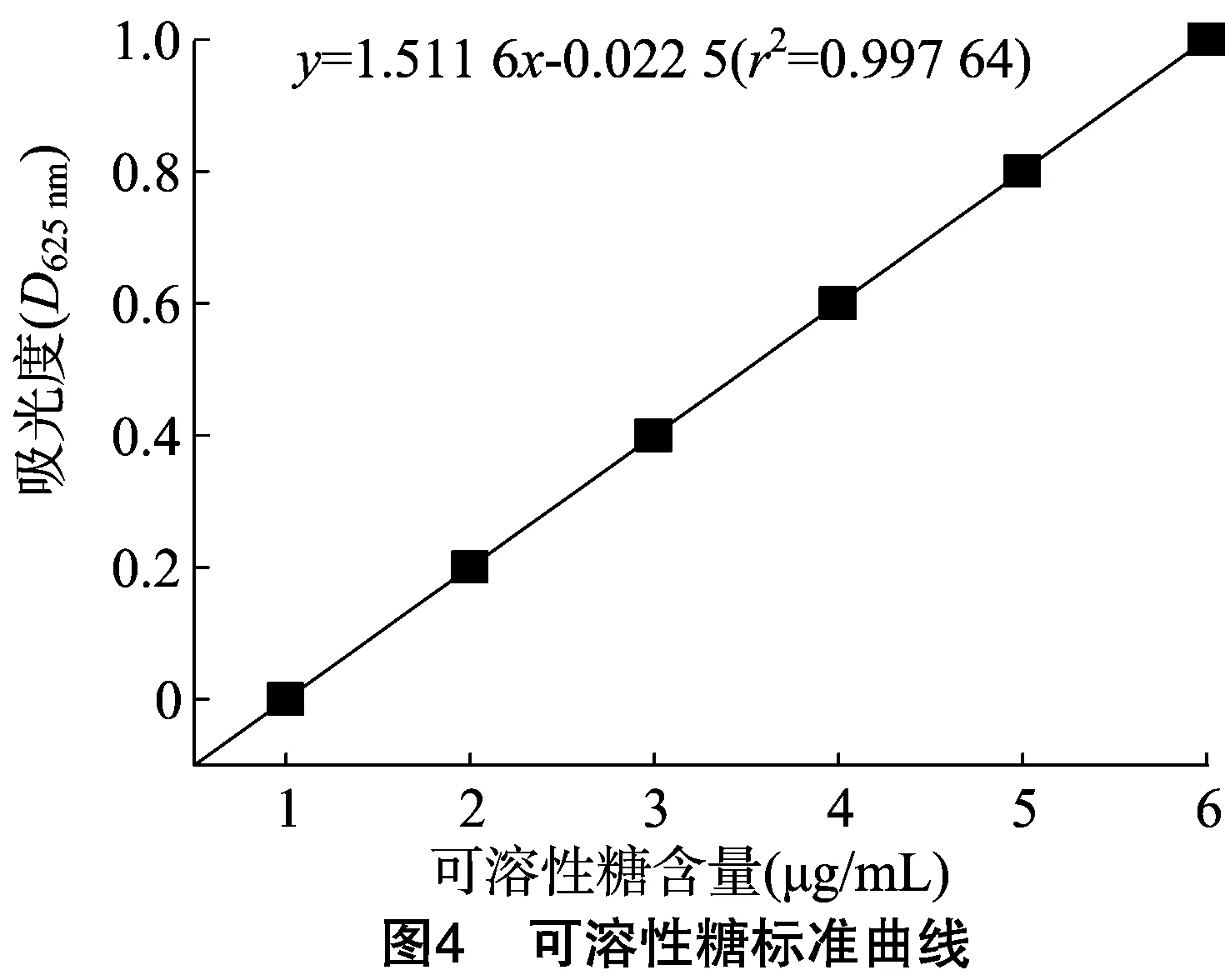
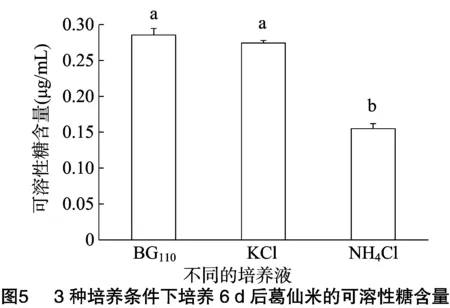
根据图4,溶液中可溶性糖含量(y)与蒽酮试剂染色后的可溶性糖溶液在620 nm波长下的吸光度(x)之间的直线方程为:y=1.511 6x-0.022(r2=0.997)。葛仙米在BG110、含1 mmol/L KCl的BG110以及含 1 mmol/L NH4Cl的BG1103种不同的培养液中培养6 d后,葛仙米的可溶性糖含量见图5。与BG110培养基中培养葛仙米相比, 1 mmol/L KCl的BG110培养基、1 mmol/L NH4Cl的BG110培养基中培养葛仙米的可溶性糖含量分别降低了3.9%(P>0.05)和45.7%(P<0.05)。
2.5 KCl和NH4Cl对葛仙米丙二醛含量的影响
葛仙米在BG110、含1 mmol/L KCl的BG110以及含 1 mmol/L NH4Cl的BG1103种不同的培养液中培养6 d后,葛仙米的丙二醛含量见图6。BG110培养基、含1 mmol/L KCl的BG110培养基中培养葛仙米的丙二醛含量较低,且两者之间无显著差异(P>0.05)。含1 mmol/L NH4Cl的BG110培养基培养下葛仙米的丙二醛含量大幅度升高,分别升高到前两者的21.7、22.0倍(P<0.05)。

3 结论与讨论
本试验比较研究了1 mmol/L KCl和NH4Cl 2种含氯化肥对葛仙米生理生化特性的影响。添加1 mmol/L NH4Cl的BG110培养基中培养的葛仙米,以叶绿素a含量表示的生物量、比生长速率以及各种光合色素、可溶性糖和可溶性蛋白质的含量大幅度下降(P<0.05);添加1 mmol/L KCl的BG110培养基中培养的葛仙米,上述各项生理指标略微降低但无显著差异(P>0.05)。因此,1 mmol/L NH4+对葛仙米生理生化特性的影响较为强烈,而 1 mmol/L K+和Cl-对葛仙米生理生化特性的影响较小。
李运广等的研究结果表明,高于400 mmol/L NaCl对葛仙米产生较强的盐胁迫,葛仙米的可溶性糖含量随NaCl浓度的升高而降低。高浓度的盐主要是通过降低细胞外的离子平衡,从而引起膜结构、细胞器及酶结构的破坏[8]。但本研究中,KCl和NH4Cl的浓度只有1 mmol/L,不足以对葛仙米产生强烈的盐胁迫伤害。因此,1 mmol/L KCl对葛仙米的各项生理指标没有显著影响。但1 mmol/L NH4Cl对葛仙米生理生化特性的影响强烈,因此,NH4+对葛仙米的影响机制不同于盐胁迫。陈珍等研究表明,NH4+破坏了葛仙米光系统Ⅱ的放氧复合体[7-9]。
在本研究中,1 mmol/L NH4Cl引起葛仙米细胞内丙二醛含量显著升高。在逆境胁迫条件下,植物体细胞内活性氧自由基的代谢平衡被破坏,促进植物体内自由基大量产生,导致膜脂过氧化而生成丙二醛,影响细胞膜的正常结构与功能[12]。MDA含量通常被用作膜脂过氧化程度的指标[12]。脂膜过氧化还能影响植物光合作用和呼吸作用电子传递,从而导致活性氧自由基大量产生,进一步引起膜脂过氧化[13]。
因此,为了保护野生葛仙米资源的生态环境,笔者建议在葛仙米生长区水稻田的农业生产中,应该减少含氨氮的化学肥料的施用量。
