雌激素受体α rs3798759位点多态性与壮族男性生育力的相关性分析*
2018-07-31陈文成元辉雄韦玉霞王俊利
李 洁,陈文成,元辉雄,韦玉霞,王俊利
(1.右江民族医学院研究生学院,广西百色 533000;2.右江民族医学院附属医院生殖中心,广西百色 533000)
根据世界卫生组织(WHO)的标准,男性因素在降低人类生育能力中起着至关重要的作用[1]。近年来研究发现,雌激素受体α(ESRα)大量存在于人类生殖组织,其基因多态性与各种疾病,在基因型和人类生殖行为之间表现出复杂的相互作用[2]。造成男性不育的因素包括遗传和环境因素,其中相关基因突变是一个很重要的因素。因此,研究参与男性精子发生基因的多态性成为该领域的研究热点。有文献报道,ESRα 基因上的SNP位点rs3798759与乳腺癌密切相关[3];而与壮族男性生育力的相关性研究报道较少见。为探明该多态性位点对壮族男性生育力的影响,本研究分析ESRα rs3798759位点等位基因和基因型在生育及不育组男性中的分布频率及血清E2和ESRα水平对男性生殖的影响。
1 资料与方法
1.1一般资料 选取 2016年10月至2017年3月于右江民族医学院附属医院生殖医学科就诊患者为研究对象。观察组87例,为排除女方因素,未避孕1年以上未育的壮族男性患者,已知临床因素(如精索静脉曲张、输精管梗阻等)和遗传因素(如染色体异常、Y染色体微缺失等)导致不育的患者除外。对照组73例,为未借助辅助生殖技术的已育壮族男性。
表1 观察组和对照组的各项基本资料
1.2方法
1.2.1精液分析 所有检测对象标本采集时使用手淫取精法,取精前禁欲2~7 d,收集于带刻度的、清洁干燥试管内,所有标本均于右江民族医学院附属医院生殖中心取精室内采取,确保送检时间的可控性和及时性。接收时立即放入37 ℃恒温箱内,并记录标本采集时间。精液常规检测采用西班牙SCA全自动精液分析系统,光学显微镜为OLYMPUS(日本,CX41-32C02),完成常规检测后标本进行Diff-Quik快速染色(参照《WHO人类精液检查与处理实验室手册》第5版诊断标准)[4]。
1.2.2ESRα位点基因型分析 应用DNA 提取试剂盒分离外周血DNA(天根生化科技有限公司),正向引物:5′-TTG AGA AAA AGA TGA GAG GG-3′,反向引物:5′-ACT CCC TGA TGT GTG AAC TG-3′,由宝生物工程(大连)有限公司合成。建立20 μL聚合酶链反应(PCR) 体系,包括1μL模板DNA,10 μL高保真2×Gold Star Taq Master Mix(大连TaKaRa),正、反向引物各1 μL,双蒸水7 μL。反应条件为:95 ℃预变性5 min;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s,共35个循环;72 ℃继续延伸10 min。扩增产物为342 bp,将扩增得到的PCR产物用于酶切(北京NEB)(TrsRⅠ酶37 ℃消化30 min,65 ℃失活5 min),酶切产物用2%琼脂糖凝胶电泳检测。
1.2.3血清激素水平测定 本实验用酶联免疫吸附法(ELISA)测定血清中E2和ESRα的水平,仪器为RT-6000(Rayto),试剂由武汉华美生物工程有限公司提供(批号:C9682310141、101013373);测定步骤严格按照试剂盒说明书进行。
1.3统计学处理 采用SPSS 17.0统计软件进行数据分析,SNP位点在检测人群中的分布比较采用χ2检验,检测基因型在不育组及对照组中的分布频率、关联比值比(OR)及95%置信区间(95%CI),两组血清E2和ESRα水平间的关系比较采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1调查对象基本情况 两组中调查对象的年龄、pH值、禁欲时间及精液体积差异均没有统计学意义(P>0.05),观察组男性的精子水平、前向运动精子百分比及正常精子形态百分比均低于对照组,差异均有统计学意义(P<0.05)。观察组的血清E2、ESRα水平均比对照组高,两者之间差异有统计学意义(P<0.05),见表1。
2.2ESRα基因rs3798759位点基因型分析 对照组只检测出杂合型GT,不育男性组均可检测到 GG、GT、TT 3 种基因型,限制性酶切及DNA测序结果分别见图1、2。
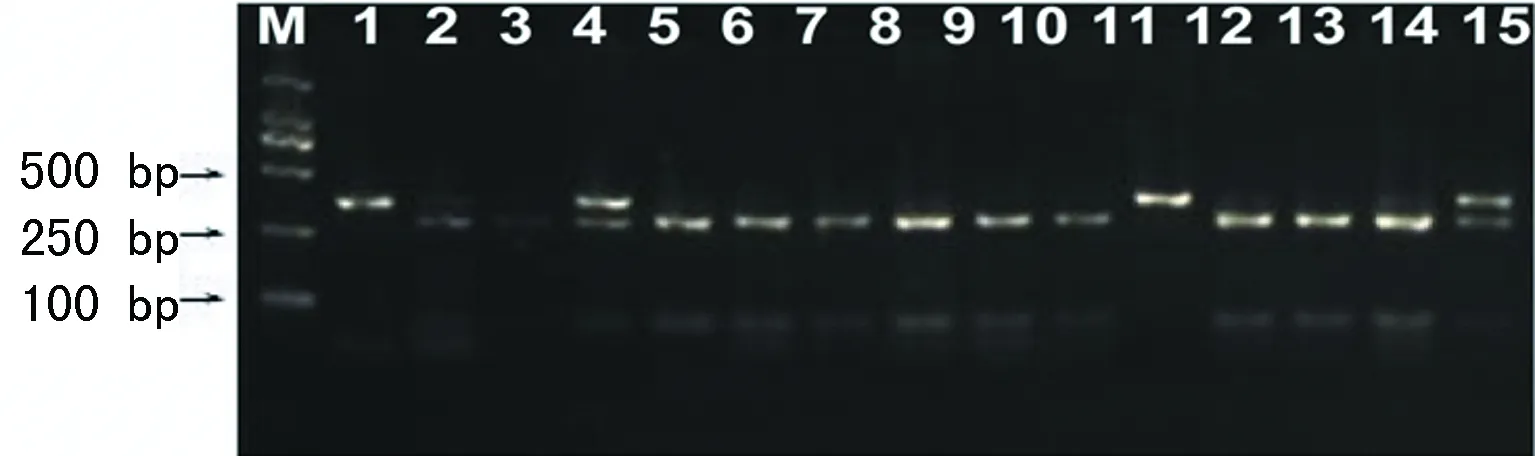
M:相对分子质量;GG纯合型:1、11;TT 野生型:4、15;GT杂合型:2、5、6、7、8、9、10、12、13、14;GG:342 bp;GT:69/273/342 bp;TT:69/273 bp
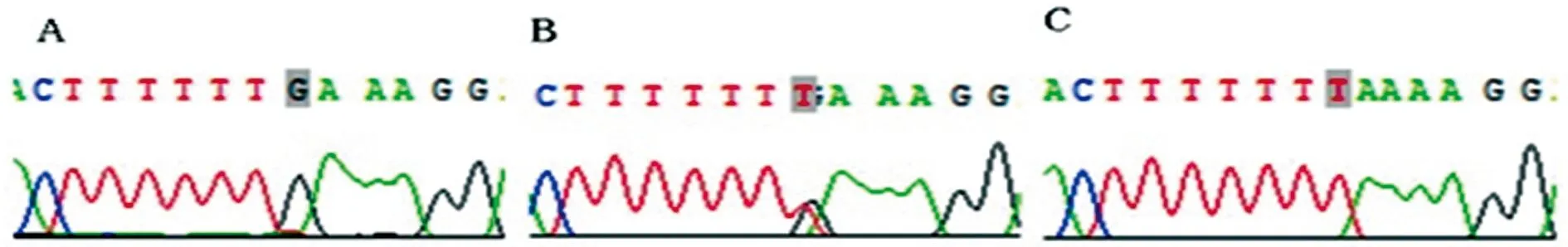
A:GG突变型;B:GT杂合型;C:TT野生型
2.3ESRα基因rs3798759位点多态性与壮族男性生育力的相关性分析 不育组男性等位基因G频率为28.2%,低于生育组(50.0%),差异有统计学意义(χ2=16.05,P<0.01),等位基因G可降低男性不育症的发病风险[OR=0.930,95%CI(0.441~1.963)]。见表2。
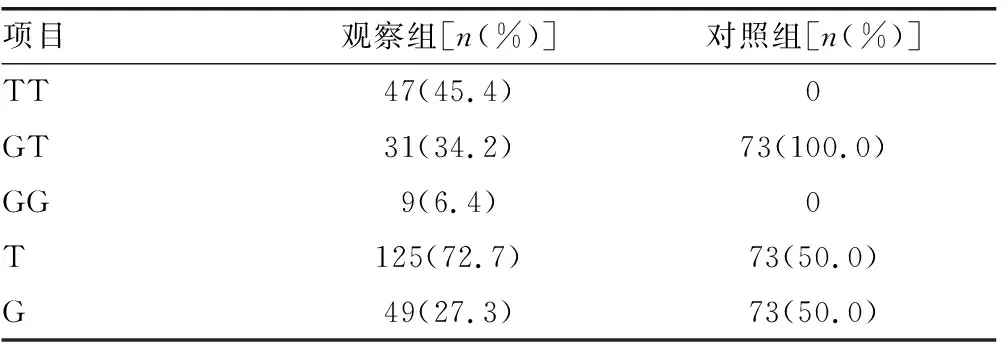
表2 两组ESRα SNP(rs3798759)基因型和等位基因频率
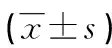
表3 ESRα基因rs3798759多态位点基因型与精液常规参数的关联分析
a:P>0.05,与TT比较
2.4ESRα基因rs3798759 多态与精液质量的关联分析 单因素方差分析(One-way ANOVA)结果显示ESRα基因rs3798759多态性与精子水平、前向运动精子百分比之间不存在显著关联,见表3。
3 讨 论
近年来多项研究探讨雌激素受体基因多态性与男性不育的相关性,结果因研究对象遗传背景差异而不同。随着现在生活成本增高,生活、经济压力增大,不育症发病率增高,壮族男性的生育能力也受到影响。关于壮族男性生育情况的研究涉及的有GSTT1 和GSTM1 基因多态性、雌激素β受体基因RsaⅠ多态性、CYP1A2基因多态性分析等方面的研究[5-7]。本文分析ESRα rs3798759位点与壮族男性生育力的关系。研究对象在年龄、pH值、禁欲时间及精液体积差异均没有统计学意义(P>0.05),观察组男性的精子水平、前向运动精子百分比及正常精子形态百分比均低于对照组,差异均有统计学意义(P<0.05)。本研究发现等位基因G可以降低壮族男性不育的易感性,其不育症的发病风险为等位基因T基因型的0.93倍,但是不同基因型与精液常规参数之间不存在相关性。单一多态性的低显性遗传效应通常取决于与其他多态性位点的相互作用及包括饮食、生活方式等在内的特定环境因素的综合影响,因此遗传变异的影响可能为其他尚未发现的致病因素所掩盖[8]。
遗传因素是男性不育众多病因中不可忽略的一种,全世界约15%的男性不育是由基因突变引起的[9]。雌激素通过ESRα调节转录过程,包括核转录、结合特殊的效应原件和目的基因的表达进行调控,核雌激素受体是调节雌激素复合物功能的转录因子,即使没有直接结合到靶基因的DNA上也可以通过其他类蛋白质相互作用,从而调控基因表达[10]。雌激素对人类生殖系统的分化、成熟和功能发挥着重要的作用,对促性腺激素具有负反馈作用,通过雌激素受体会对生殖参数产生不利的影响[11]。有报道表明ESR基因多态性改变可影响常规精液参数[12]。
雌激素在调节精子的发生中起着直接的作用,影响生殖细胞的增殖、分化和凋亡[13],也是由于在精子发生过程中广泛存在的雌激素受体[14]。研究表明,雌激素可以调节睾丸支持细胞的核转录,维持睾丸的正常发育,影响生殖功能[15-16]。雌激素对生殖细胞的死亡和凋亡的信号机制具有调控作用,诱导精子的激活,通过其受体信号通路调控男性精子生成[17]。E2通过结合经典的细胞内雌激素受体或者膜雌激素受体触发基因组和非基因组信号转导通路,影响和作用于睾丸细胞、生殖细胞及成熟精子[18]。LUCAS等[19]研究发现,E2激活ESRα基因可参与未成熟支持细胞的增殖,这表明雌激素作用可能是调节精子发生和生育的关键步骤。ESRα基因敲除雄鼠出生后睾丸正常,青春期后睾丸开始变性,成年期睾丸萎缩,精子发生障碍和精子密度显著降低,并出现不育[20-21],进一步说明由ESRα介导的雌激素对精子发生具有重要作用。本研究的结果显示观察组血清E2、ESRα水平均明显高于对照组,血清E2、ESRα水平相与男性生殖具有一定的相关性,推测ESRα基因变异对男性不育的影响是通过介导E2和ESRα水平改变实现的。宋明哲等[22]研究中也发现血清E2水平升高提示精子数目减少,可能是因为E2通过多种途径调控或干扰精子的生成所致。虽然上述等位基因频率在观察组与对照组的分布频率之间差异有统计学意义,但要确定血浆E与ESRα水平和各基因型之间关系还需要加大样本量再进行研究。
综上所述,基因ESRαrs3798759位点的变异可能与壮族男性不育存在关联性,但研究结果仍需通过大规模研究进行证实。
