样品不同处理方法提取甜菜基因组DNA的比对研究
2018-07-31邹奕兴旺朱尚明栗媛齐少玮吴则东
邹奕 ,兴旺 ,2,3,朱尚明 ,栗媛 ,齐少玮 ,吴则东 ,2,3*
(1.黑龙江省普通高等学校甜菜遗传育种重点实验室,哈尔滨150080;2.中国农业科学院甜菜研究所/黑龙江大学农作物研究院,哈尔滨150080;3.中国农业科学院北方糖料作物资源与利用重点开放实验室,哈尔滨150080)
甜菜基因组DNA提取的方法很多,如常用的CTAB(十六烷基三甲基溴化铵)法就是利用CTAB将细胞膜溶解,并与核酸形成复合物,此复合物在高盐浓度下溶解于液相中,而在低盐的溶液中则会沉淀,CTAB缓冲液中含有高浓度的NaCl,用于提供高盐浓度,同时含有EDTA,用于抑制DNase活性,使用酚、氯仿和异戊醇对蛋白质进行变性抽提,最后用乙醇或者异丙醇对DNA进行沉淀;其它的提取方法还有SDS(十二烷基磺酸钠)法、蛋白酶K法、使用试剂盒以及碱裂解法等等。如腊萍等[1]分别采用CTAB法和SDS法提取甜菜基因组DNA,结果表明,改进的CTAB法提取的DNA纯度好,产率高;沙红等[2]也对CTAB法和SDS法提取甜菜基因组DNA进行比对,结果也表明CTAB法提取的DNA纯度要好于SDS法;吴则东等[3]利用碱裂解法提取甜菜基因组DNA,该方法提取DNA只需要一种药剂,提取方便且时间短,提取的DNA可以用于SSR引物扩增,但由于没有经过提纯,故杂质较高。在甜菜基因组DNA的提取过程中,取样一般以叶片[4]、花蕾[5]、种子[6]、幼嫩花序及块根[7]为材料进行基因组DNA的提取。
决定DNA的效率以及纯度很重要的一个因素是关于样品的处理,利用鲜样提取DNA,要想保证提取DNA的纯度,就一定要避免样品的降解,以往在处理样品时,大都利用液氮在研钵中进行研磨或者利用研磨杵在离心管中将样品研磨成粉末,研钵研磨样品后在转移到离心管中时容易造成样品损失,而且一般都是鲜样直接处理,而研磨杵在研磨时由于操作的角度较小,容易造成部分样品无法研磨成粉末。本文将探讨如何通过处理样品较快速地提取甜菜基因组DNA,并验证提取的DNA浓度及纯度。
1 实验材料和方法
1.1 实验材料
实验中用到的12个甜菜品系均来自于中国农业科学院甜菜研究所,样品编号分别为1~12。
每份甜菜种子取10粒,用纱布包好后放到蒸馏水中浸泡24h,将蛭石放到搪瓷盘里,用自来水浸泡后,将水空出,然后放到烘箱中进行烘干,180℃,大约4h,待蛭石烘干后,取出,温度降到室温后,将蛭石装入到营养钵中,留3cm左右的高度,营养钵中加蒸馏水至水从营养钵下面刚好流出,每个营养钵播种10粒浸泡好的种子,上面覆盖好消毒的蛭石。待两片子叶展平后,每份种子取5株用于提取基因组DNA。
1.2 方法
1.2.1 甜菜DNA提取方法 处理1:取1~6号编号的样品,每个样品取3株,用锡箔纸包好,然后将包好样品的锡箔纸放入到预先装好液氮的小罐中,等到液氮不再发出吱吱声时,用镊子夹出锡箔纸,然后用研磨棒快速研磨锡箔纸,将样品研磨成粉末,倒入2mL的离心管中,然后向离心管中加入800μL的CTAB缓冲液,65℃干浴1h,期间上下摇动几次,使CTAB充分浸入到样品中去;将样品冷却至室温,加入400μL的24∶1的氯仿/异戊醇,上下混匀;12000 r/min离心10min,取上清液加入到2mL的离心管中,然后加入等体积的异丙醇,上下摇动后放入到冰箱冷冻层10min,之后12000 r/min离心10min,弃掉上清液;利用干浴锅将异丙醇挥发干净,加入100μL的TE溶解DNA。
处理2:取7~12号编号的样品,每个样品取3株放入到预装有800μL CTAB缓冲液的2mL离心管中,每个离心管中放入两粒钢珠,直接利用研磨机进行打磨,反复震荡几次,待样品打碎后,将钢珠倒出,把离心管放入到干浴锅中,之后步骤同处理1。
1.2.2 甜菜基因组DNA的检测 分别利用微量分光光度计和琼脂糖凝胶电泳检测DNA的浓度和纯度。微量分光光度计检测时只需要滴入2μL的DNA原液进行检测,琼脂糖检测时加入5μL的DNA原液和1μL的6×染料,利用凝胶成像系统进行照相记录。1.2.3 SSR检测 将提取的DNA均稀释到10ng/μL,利用SSR引物分别进行扩增,体系和程序见文献[8],PCR产物的检测利用快速银染法[9]。
2 结果与分析

表1 样品不同处理方法提取的DNA浓度
2.1 利用微量分光光度计检测
利用微量分光光度计对提取DNA的浓度和纯度进行检测(表1),两种处理方法提取的DNA浓度相差不大,说明两种处理样品的方法均能够提取出浓度较高的DNA。
2.2 琼脂糖检测提取DNA的纯度
利用1%的琼脂糖凝胶对提取的DNA进行检测,检测结果见图1,编号1~6对应处理1,编号7~12对应处理2,从图1中可以看出,处理1条带清晰完整,没有虚带,说明提取的DNA纯度非常好,而处理2均有部分虚带,可能是由于震荡过程中造成个别DNA条带断裂所致。
2.3 利用PCR对提取的甜菜基因组DNA进行扩增
利用甜菜SSR引物FDSB1023对12个品系进行扩增,扩增后的产物利用8%的非变性聚丙烯酰胺凝胶进行检测,从图2扩增结果可以看出,两种处理样品的方法均能对SSR引物进行扩增。说明两种提取方法均可用于甜菜SSR引物的扩增。
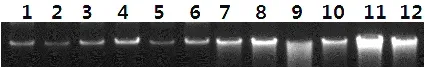
图1 1%琼脂糖凝胶对甜菜品系提取的DNA检测结果1~12甜菜品系编号
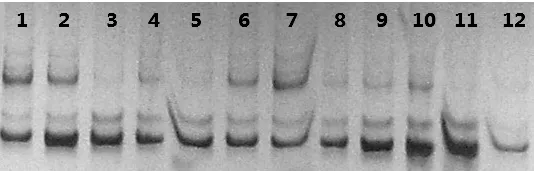
图2 引物FDSB1023对甜菜品系的聚丙烯酰胺检测结果1~12为甜菜品系编号
3 结论
影响基因组DNA提取效率和效果的一个主要因素就是对样品的处理,样品研磨的越精细,提取DNA的效果越好,同时对于冷冻的样品又害怕反复的冻融,这样DNA就很容易降解。本文给出了一个比较好的解决方案,如果实验室有研磨机,就可以将要提取DNA的鲜样直接放到2mL的离心管中,同时在离心管中放入两颗钢珠或者锆珠,如果马上就提取DNA,可以在离心管中直接加入CTAB缓冲液,之后利用研磨机直接将样品打碎,进行提取,如果需要以后再进行提取,就可以将加有钢珠和样品的离心管放到-80℃的冰箱中进行保存,等到需要提取时再加入缓冲液进行打磨提取,这种提取方法一次就可以处理24个样品,处理的速度很快;对于没有研磨机的实验室,可以在取样的时候直接利用锡箔纸将植物鲜样包好,用记号笔记上编号,如果不是近期进行DNA的提取,就把样品放到-80℃的冰箱中进行保存,在需要提取时,取出直接放到装有液氮的保温瓶中冷冻,之后利用研磨棒进行研磨,提取DNA。
