经皮导管介入治疗肺动静脉瘘疗效及安全性评价
2018-07-30宋秋韵伍广伟许能文
宋秋韵, 伍广伟, 许能文, 师 洵
肺动静脉瘘(pulmonary arteriovenous fistula,PAVF)为先天性疾病,发病率约为 0.38‰[1],遗传性出血性毛细血管扩张症(hereditary hemorrhagic telangiectasia,HHT)患者PAVF发病率较高。有证据表明,HHT与ENG、ACVRL1和Smad4基因突变相关[2]。获得性PAVF较先天性少见,通常与肝硬化、血吸虫病、结核病、放线菌病和外伤有关[3]。PAVF患者发生脑卒中、脑脓肿、短暂性脑缺血发作等并发症可能性极高[4-5],如PAVF反常栓塞易造成神经系统并发症。Taylor等[6]1978年首次报道PAVF介入栓塞治疗。随着介入技术及封堵材料不断发展,经皮导管介入治疗减少了传统手术治疗相关风险[2,7],已成为PAVF主流治疗方法。本研究回顾性分析经皮导管封堵/栓塞治疗PAVF患者的效果及安全性。
1 材料与方法
1.1 一般资料
收集2009年5月至2015年5月广西壮族自治区人民医院收治的7例经肺动脉造影和/或64层螺旋 CT肺血管造影(CT pulmonary angiography,CTPA)证实PAVF患者临床资料。其中男4例,女3例,中位年龄32(29~63)岁;美国纽约心脏病协会(NYHA)心功能Ⅲ级3例,Ⅱ级4例;1例室间隔缺损(VSD)患者已接受VSD封堵治疗;1例有鼻出血复发和咯血病史,2例有活动后胸闷、呼吸困难,4例无症状;查体见杵状指2例,手部毛细血管扩张灶1例,心前区可闻及收缩期杂音3例;伴有HHT 3例,血红蛋白升高1例。
1.2 介入治疗方法
所有患者均签署手术知情同意书。局部麻醉下穿刺股静脉并全身肝素化,先行右心导管术与肺动脉造影术(或通过术前CTPA)了解瘘管形态、大小及走行,确定拟封堵肺动脉引入血管并准确测量管径;对引入血管直径>5 mm患者采用封堵器封堵,送入0.035英寸加硬导丝至瘘道远端,沿导丝送入6~12 F输送鞘管,经鞘管送入动脉导管未闭(PDA)封堵器/VSD封堵器(深圳先健科技公司)进行封堵,复查造影显示封堵完全,囊腔完全不显影,封堵器大小、位置适宜,未影响正常肺动脉分支血流;对引入血管直径为3~5 mm(封堵器鞘管难以到达病变部位)患者采用弹簧圈栓塞,Pilot 50指引导丝送至瘘道远端,送入ev3微导管,撤出导丝,植入弹簧圈(美国Micro Therapeutic公司),复查造影显示残余分流明显减少,未影响正常肺动脉分支血流。
1.3 统计学方法
采用SPSS 17.0软件进行统计学分析。连续变量组间差异用配对t检验,非参数变量用Wilcoxon秩和检验。P<0.05为差异有统计学意义。
2 结果
7例经皮导管封堵/栓塞治疗PAVF患者临床特征见表1。
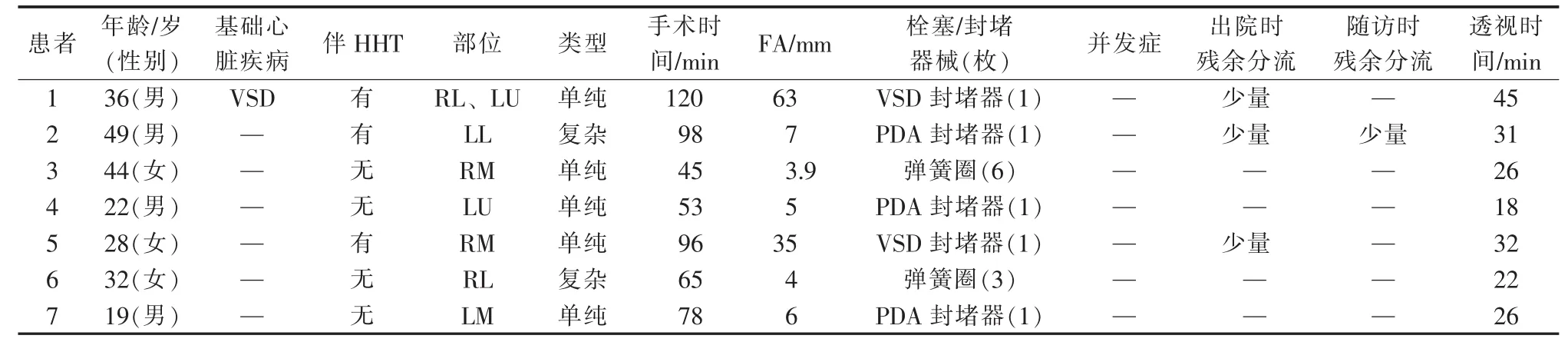
表1 7例PAVF患者特征及经皮导管封堵/栓塞手术时间、透视时间
所有患者PAVF均成功封堵/栓塞(图1),其中1例植入弹簧圈3枚,1例植入6枚;3例各用PDA封堵器1枚,2例分别用VSD封堵器1枚;引入血管中位直径 6 mm(3.9~63 mm);手术时间为45~120 min,平均(79.3±27.0) min;透视时间为 18~45 min,平均(28.6±8.8) min,见表 1。 术后 48 h 动脉血氧分压(PaO2)、动脉血氧饱和度(SaO2)均显著高于术前(P<0.05),动脉血二氧化碳分压(PaCO2)虽较术前升高,但差异无统计学意义(P>0.05),见表2。术后3例肺动脉造影显示少量残留分流。术后所有患者紫绀和肺血管杂音均消失,无器械、手术相关并发症发生(表1)。
所有患者随访24~48个月。6例紫绀、咯血、鼻出血症状缓解,不吸氧状态下SaO2>90%,1例仍有紫绀和胸痛。近期随访中经胸超声心动图显示1例(患者2)有少量残余分流;所有患者NYHA分级较术前减轻,未发生器械相关性栓塞、感染性心内膜炎等;复查CTPA未发现复发或再通;原有心脏杂音患者杂音消失,SaO2维持在正常水平或接近正常水平。

图1 患者1 PAVF治疗前后影像
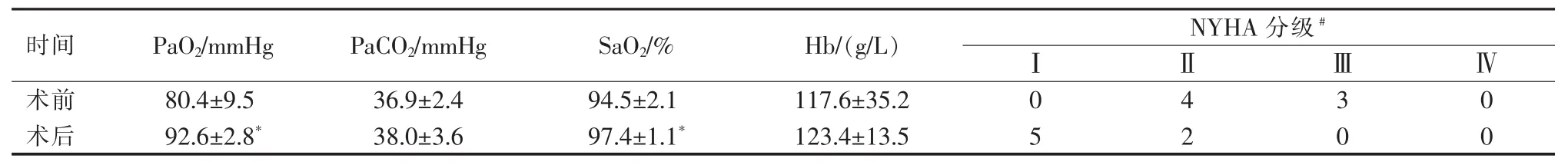
表2 7例PAVF患者封堵/栓塞手术前后动脉血气分析及NYHA分级比较
3 讨论
肺毛细血管襻末梢缺陷使血管扩张成血管囊,肺动静脉之间直接形成交通,导致PAVF。PAVF可能破裂并导致危及生命的咯血或血胸,或其引起的右向左分流可能导致反常栓塞[8]。临床症状轻重取决于其病理变化及右向左分流量,15%~50%患者缺乏明显临床表现。右向左分流量大于体循环总量20%以上时,患者可出现紫绀、杵状指、呼吸困难及反常栓塞等临床表现,最显著表现为无症状低氧血症[9]。本组3例患者有相关临床表现(鼻出血、咯血、胸痛和呼吸困难),其余患者无明显症状;1例复杂PAVF患者有严重低氧血症;仅引入血管直径≥3 mm患者栓塞术后症状与氧合不足有较大改善。既往文献报道欧美国家70%~95%PAVF与HHT有关[2],白种人群HHT伴发PAVF概率远高于亚洲人群,本组 3 例患者(3/7)临床诊断为 HHT[3]。 本研究发现术后患者NYHA分级减轻,可能与术后右向左分流明显减少,氧合不足改善有关。
根据不同临床特征,PAVF诊断基于右向左分流与影像学表现。超声心动图(右心声学造影)结合CTPA 是检测 PAVF 敏感方法[2,4,10-11]。 肺动脉造影为PAVF诊断“金标准”,根据形态特征分为:①单纯型——病灶为单发或多发血管瘤样扩张,分别有1条供血动脉和引流静脉;②复杂型——病灶为多发血管瘤样扩张,有多条供血动脉和引流静脉;③弥散型——病灶呈弥漫多发,相应区域无毛细血管实质充盈期或病变部位肺静脉提前显影[12]。介入治疗前诊断性肺动脉造影有助于明确瘘管形态、大小及走行,确定拟栓塞/封堵肺动脉引入血管,并准确测量管径,制定治疗方案,评估方案收益及风险[3]。
目前经皮导管介入栓塞/封堵术已逐渐取代外科手术,成为PAVF一线治疗方案。既往传统栓塞材料主要为可解脱球囊及弹簧圈,但可能引起球囊萎陷导致瘘管再通、弹簧圈移位脱落引起异位栓塞等并发症[13];Amplatzer封堵器因单个可封堵引入血管直径较大PAVF、易于瘘管颈部封堵及可闭塞较短血管之优势逐渐广泛应用[14]。经皮导管介入栓塞/封堵术成功率高,相关研究显示成功率>90%。
经皮导管介入治疗通常推荐用于引入血管直径≥3 mm PAVF患者[15]。 2009年HHT诊治指南认为,经皮导管介入治疗亦可用于引入血管直径<2 mm PAVF[2]。 本组患者引入血管直径为 3.9~6.3 mm,符合经皮导管介入治疗适应证。栓塞材料选择目前尚无定论。文献报道对引入血管直径<7 mm患者,可采用弹簧圈栓塞;对引入血管直径粗大(>7 mm)患者,由于弹簧圈枚数增多致使脱落、移位等并发症风险增加,可采用 Amplatzer封堵器[13,16-17]。 Amplatzer封堵器型号齐全,适用于不同引入直径PAVF。本研究为避免弹簧圈脱落、移位风险,尽量尝试应用封堵器(3例选择PDA封堵器,2例选择VSD封堵器),均得到满意临床效果,安全可行。
PAVF经皮导管介入治疗常见并发症包括复发/再通、栓塞/封堵装置脱落、脑卒中、一过性胸膜反应及咯血等[18]。本组患者未发生手术相关并发症。虽然大多数PAVF治疗获得成功,但远期随访中仍有一些患者首次栓塞/封堵后发生再通[19]。弹簧圈栓塞后PAVF再通较为多见,再通率为8%~49%[7],再次栓塞治疗后再通率明显降低[20]。有研究显示,Amplatzer封堵器结合弹簧圈栓塞可有效防止再通[21]。再通危险因素包括应用单弹簧圈应用、引入血管内径过大、弹簧圈过大及植入弹簧圈过于靠近引入血管(<1 cm)[22]。本组除患者2随访时仍有少量残余分流外,其余患者无残余分流,亦未发生再通。
总之,经皮导管介入治疗PAVF安全有效。根据不同PAVF类型选择合适栓塞/封堵材料是取得较好疗效的关键。