海岛棉GbPR10基因的克隆及其抗枯萎病表达分析
2018-07-30艾海提艾合买提姚正培曲延英
艾海提·艾合买提,姚正培,曲延英
(新疆农业大学农学院/农业生物重点实验室,乌鲁木齐 830052)
0 引 言
【研究意义】目前广泛种植的栽培棉中,海岛棉(Gossypiumbarbadense)有着纤维长度、比强度、细度等方面优异于其它棉类[1]。棉花病害,尤其是枯萎病的蔓延严重地影响了海岛棉产量和品质[2]。枯萎病病原菌试图进入棉花植株时,棉花不仅以自身特异的组织结构抵抗侵染,而且通过侵染诱导刺激诱导的基因调控来缓慢病害。PR10蛋白是一种具有抗蛋白酶特性的病程相关蛋白(Pathogenesis-related proteins,PRs)[3]。PR10与其它PRs一样由病原有关环境下诱导而调节植物正常生长发育。【前人研究进展】1970年Van Loon[4,5]等在感染烟草花叶病毒(TMV)的烟草中发现PRs蛋白后,17类PRs蛋白质[4]被发现了。在不同物种诱导表达和功能具有很大的差别[6]。研究报道,PR-1是提高病原菌诱导获得性抗性标志蛋白[7];PR-2是以葡聚糖为底物,编码β-1、3-葡聚糖内切酶并分解病原菌细胞壁的蛋白;PR-3、PR-4、PR-8和PR-11均有几丁质酶活性;PR-6是以蛋白酶抑制剂形式,防御微生物、昆虫和线虫的损害[8];PR-15、PR-16具有超氧化物歧化酶活性参与抗性反应[9];PR-17蛋白具有锌-蛋白酶活性,还需要进一步功能研究[10]。PR10蛋白是不同于其他PR蛋白,唯一分布于细胞内,没有信号肽,具有核糖核酸酶功能有关的P-Loop(G-X-G-G-X-G-X-X-K)和抗真菌有关的Bet-v1结构域[11]。除了病原菌外PR10蛋白家族被水杨酸、乙烯等激素[12,13]诱导表达,是一种植物生长发育调节、抗病中多方面起作用的多功能蛋白家族。研究[14]发现PR10与细胞程序化死亡有关蛋白LRR1(leucine-rich repeat protein)相互作用,LRR1有助于PR10蛋白的正调控作用,能够提高PR10防御信号,能够有效的降低黄单胞杆菌(X.campestrispvvesicatoria)和霜霉菌(Peronosclerosporasacchari)对植物的损害。张桂荣等[15]发现,从棉花品种Pima90-53的全长cDNA文库筛选出来的PR10基因被黄萎病菌和ET、SA诱导显著表达。陈郦俊等[16]从黄萎病侵染的海岛棉根部克隆了一个GbPR10-1基因,并发现大肠杆菌表达的GbPR10-1蛋白在体外抑制黄萎病菌菌丝的扩展,黄萎病接菌的抗病和感病品种里GbPR10-1的表达量迅速增加。【本研究切入点】目前从海岛棉分离的PR10基因较少,研究海岛棉GbPR10基因,解析棉花抗枯萎病分子机制,培育抗病品种提高基因来源。【拟解决的关键问题】克隆GbPR10基因,进行生物信息学分析,枯萎病、ET、SA诱导下进行抗病表达分析。
1 材料与方法
1.1 材 料
所用9份海岛棉(Gossypiumbarbadenselinn)材料由新疆农业大学农学院遗传系提供,其中6份抗病、3份感病品种[17]。材料种植和枯萎病接菌按水培和根系侵泡法[18]进行。由于一些比较复杂的病原菌侵染和相关传导信号的交换发生在12~40 h[19],采取40 h枯萎病接菌和0 h的9份棉花材料根、茎、叶等组织后超低温保存待用。激素处理参照韩泽刚等[20]的方法:将抗病品种06-146和感病品种新海14号幼苗浸泡在乙烯(1 mmol/L)和水杨酸(50 μmol/L)处理,并分别在0、2、4、8、16和24 h时采取根组织,超低温保存待用。表1
1.2 方 法
1.2.1 提取总RNA及反转录合成cDNA
按RNAplant Plus Reagent(TIANGEN)植物总RNA提取试剂盒说明书进行提取9份品种根、茎、叶片和“06-146”、新海14号两种品种根部的总RNA,电泳检测并测OD值。使用TIANgel Midi Purification Kit(TIANGEN)普通琼脂糖凝胶DNA回收试剂盒纯化RNA。按Maxima H Minus Firt Strand cDNA Synthesis Kit(ThermoFishir)试剂盒说明书进行合成反转录DNA。表1
表1 海岛棉品种名称、抗病性和来源地
Table 1 The name,pathogen sensitivity and source of sea-island cotton
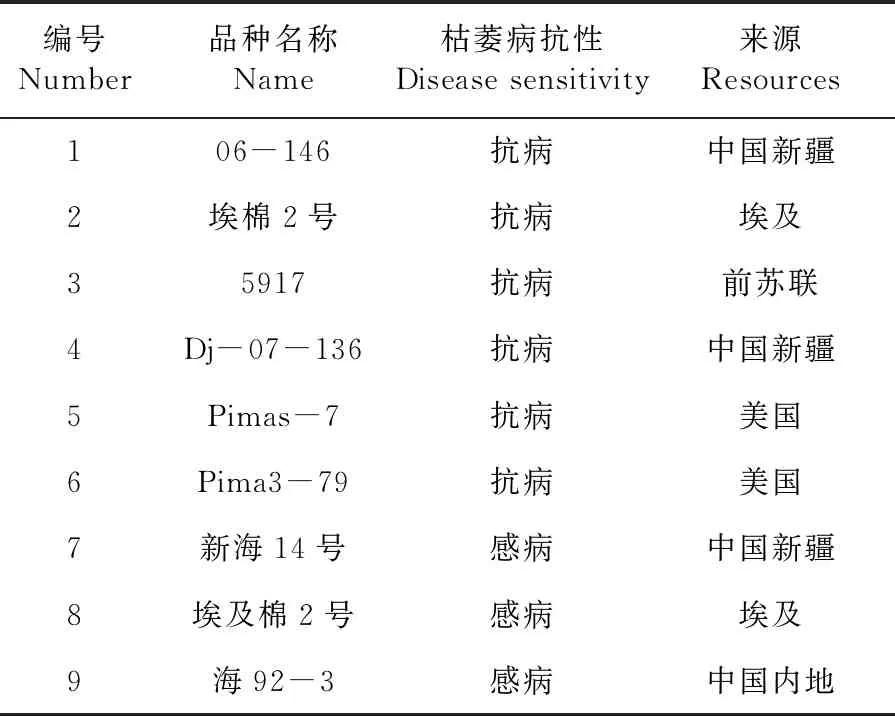
编号Number品种名称Name枯萎病抗性Disease sensitivity来源Resources106-146抗病中国新疆2埃棉2号抗病 埃及35917抗病前苏联4Dj-07-136抗病中国新疆5Pimas-7抗病 美国6Pima3-79 抗病 美国7新海14号感病中国新疆8埃及棉2号感病 埃及9海92-3 感病中国内地
1.2.2 目的基因克隆
根据前期转录组测序和抗病表达数据[18],从棉花EST数据库筛选出抗枯萎病有关的登录号为CD486053基因cDNA序列,在NCBI搜索与该基因同源性为94%的海岛棉抗病相关PR10基因(AY588276),用该序列的编码框设计引物GbPR10-F/R,从枯萎病接菌40 h根组织提取并反转录得到的“06-146”海岛棉cDNA为模板,Transgen公司的PCR试剂进行扩增目标片段,扩增体系为25 μL:cDNA 1 μL、Buffer(含Mg2+)2.5 μL、dNTPs 2 μL、Taq酶1 μL、上下引物个1 μL,无菌水16.5 μL;扩增程序:94℃预变形4 min、94℃变形40 s,56℃退火30 s、72℃延伸30 s,34个循环,72 ℃再延伸7 min,保存4℃。扩增产物用1%凝胶检测后成像仪拍照片,回收纯化目的条带,在PCR仪20℃下,15 min连接到pEASY-T1(Transgen)克隆载体上,转化大肠杆菌感受态,涂布于固体LB(含卡那霉素)平板上,挑取单菌落于内有卡那霉素的液体LB培养基,在摇床180~200 r/min转速12~14 h培养后进行菌落PCR,将与目的基因一致的样品送华大基因公司测序。表2
1.2.3 生物信息学
将测序得到的序列与原序列在DNAMAN软件里进行比对。使用ProtParam(http://web.expasy.org/protparam/)在线程序计算海岛棉GbPR10基因编码蛋白的理化参数。使用EMBL的InterProScan(http://www.ebi.ac.uk/Tools/pfa/iprscan/)及ExPASy的PROSITE(http://prosite.expasy.org/)对推导出的GbPR10蛋白的功能结构域进行预测。在NCBI找到与该基因同源性高的不同生物序列并在DNAMAN里进行同源比对分析。用MEGA4.0软件构件基因进化树。用Prot Comp-Version9.0(http://linux1.softberry.com/)在线软件对该蛋白质的亚细胞定位进行分析。
1.2.4 qPCR
根据GbPR10基因的ORF序列在Pimer3v.0.4.0(http//Frodo.wi.mit.edu/)软件设计荧光定量PCR引物qGbPR10-F/R,以GhUBQ7-F/R为内参引物。利用TransStart Top Green qPCR SuperMix(Transgen)试剂盒进行该基因对不同海岛棉的抗病性表达。qPCR体系为20 μL:cDNA模板2.5 μL、2Top Green qPCR SuperMix缓冲液10 μL、Passive Reference Dye校正溶液0.4 μL,Forward/Reverse引物个1 μL、6.3 μL无RNA酶水。实验要用专用PCR板子,进行在ABI 7500 Fast 荧光定量PCR仪(ABI公司),使用两步法程序:94℃、30 s,94℃、5 s,60℃、30 s,总共40个循环,每个模板样品为3次重复。采用2-△△Ct=2—[(Ct目的基因-Ct内参基因)处理组-(Ct目的基因-Ct内参基因)对照组]进行表达分析。表2
表2 引物序列
Table 2 Primer sequences
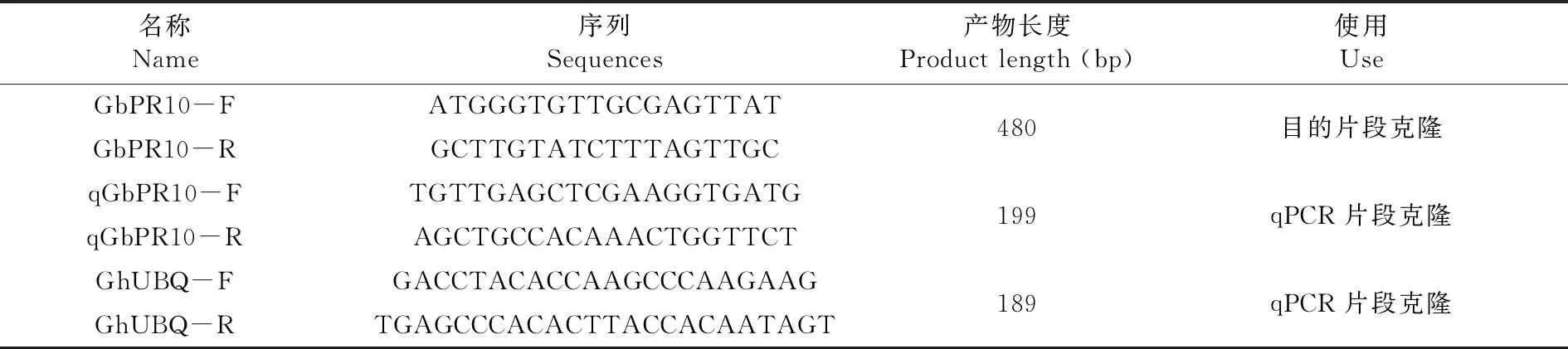
名称Name序列Sequences产物长度Product length (bp)使用UseGbPR10-FATGGGTGTTGCGAGTTATGbPR10-RGCTTGTATCTTTAGTTGC480目的片段克隆qGbPR10-FTGTTGAGCTCGAAGGTGATGqGbPR10-RAGCTGCCACAAACTGGTTCT199qPCR片段克隆GhUBQ-FGACCTACACCAAGCCCAAGAAGGhUBQ-RTGAGCCCACACTTACCACAATAGT189qPCR片段克隆
2 结果与分析
2.1 目的基因克隆及其蛋白质
以“06-146”海岛棉枯萎病40 h处理的cDNA为模板,根据引物GbPR10-F/R(表1)进行RT-PCR扩增,得到480 bp长度的目的基因编码框序列(图1),在DNAMAN翻译推到159个氨基酸序列(图2);分子量为17 300.62,预测的分子式为C786H1 203N189O240S5,等电点为4.83,该蛋白中含量多的氨基酸是Ala(17个,10.7%)、Glu(14个、8.8%)、Ser(13个,8.2%),带正电荷总体残基(Arg+Lys)为21个,带负电荷总体残基(Asp+Glu)为13个。亲水性平均数为-0.057,为亲水蛋白;用NCBI SmartBlast结构域预测表明,该蛋白具有致病相关的Bet-v1功能区和核酸酶活性有关改变的甘氨酸环P-Loop(GXASXG)。二级结构分析表明(图3-a),该蛋白有2个α螺旋,其中一个位置在C端,另一个接近于N端的β-折叠,6个β-折叠散布在中间,说明该蛋白属于PR10蛋白家族,三级结构进一步显示(图3-b)该蛋白与其他PR10蛋白相似性高。图1~3
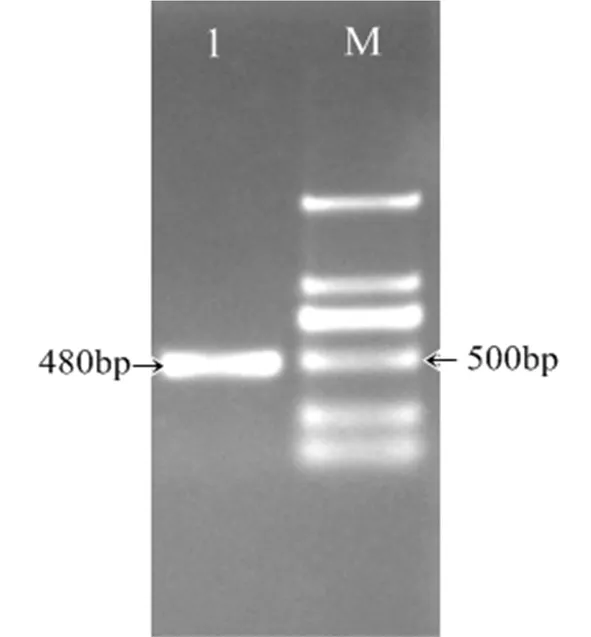
注:M.Marker;1、2.GbPR10产物
Note: M.Marker;1、2.GbPR10 Products
图1 GbPR10扩增
Fig.1 Electrophresis of PCRproduct GbPR10
2.2 GbPR10蛋白质同源性及进化树
经过NCBI搜索与GbPR10相似性高的其他物种蛋白序列,并在DNAMAN里进行同源。
研究表明,GbPR10与可可树(Theobroma cacao,EOY06619.1)、葡萄(Vitis vinifera,CAN79558.1)、石榴(Punica granatum,OWM71176.1)、甜樱桃(Prunus avium,XP_021806242.1)、欧洲山毛榉(Fagus sylvatica,ACJ23865.1)、橡胶树(Hevea brasiliensis,XP_021637260.1)、枣(Ziziphus jujuba,AGL07712.1)等植物同源性为79%、59%、56%、54%、55%、52%。比对显示,GbPR10蛋白质甘氨酸环中间的两个GG改变为AS,与Bet-v1结构域一致的序列都覆盖为黑。图4
通过MEGA4.0软件对GbPR10蛋白及其它物种进行构建进化树,研究表明,该进化树分为2个大组,GbPR10与陆地棉(GossypiumhirsutumAAG18454.1)亲缘关系最近,与雷蒙德氏棉(GossypiumraimondiiKJB84222.1)、异常棉(GossypiumarboretumKHG17625.1)分布在一个分支上,与除棉花外其它生物在不同大组上。图5
2.3 GbPR10蛋白亚细胞定位
经ProtComp Version 9.0在线软件对GbPR10蛋白预测表示,该蛋白位于细胞质的可能性86.2%,在细胞核内的可能性非常低(0.3%),在其他细胞器里分布可能性13.5%,在细胞外没有可能性,表明该蛋白在细胞质发挥作用。
2.4 GbPR10在不同抗病、感病及其不同组织的表达
GbPR10基因在枯萎病40 h诱导的不同海岛棉品种不同组织上的表达量有明显的差异并不均匀,在不同海岛棉品种根上的表达量看出,除了抗病棉花Dj-07-136和5917出现较高的表达量上调趋势外,其它抗病、感病品种表达量很低并没有显著差异;在不同品种茎上的表达量看出,抗病品种06-146、5917的表达量显著高于其它抗/感品种,抗病品种埃棉2号也出现明显的表达趋势,而且其它品种的表达量很低并彼此之间无表达差异;在不同品种叶片上的表达量看出,每个抗病品种几乎出现高表达趋势,其中抗病品种埃棉2号、5917、Pimas-7的表达量最高,感病品种新海14号的表达量显著高于其它两个感病品种埃及棉24号、海92-3和抗病品种Dj-07-0136。
GbPR10在抗病品种的不同组织上出现较高而不均匀的表达量,但是感病品种几乎没有表达趋势。图6

图2 GbPR10核算序列和氨基酸序列
Fig.2GbPR10nucleicacidandaminoacidsequences
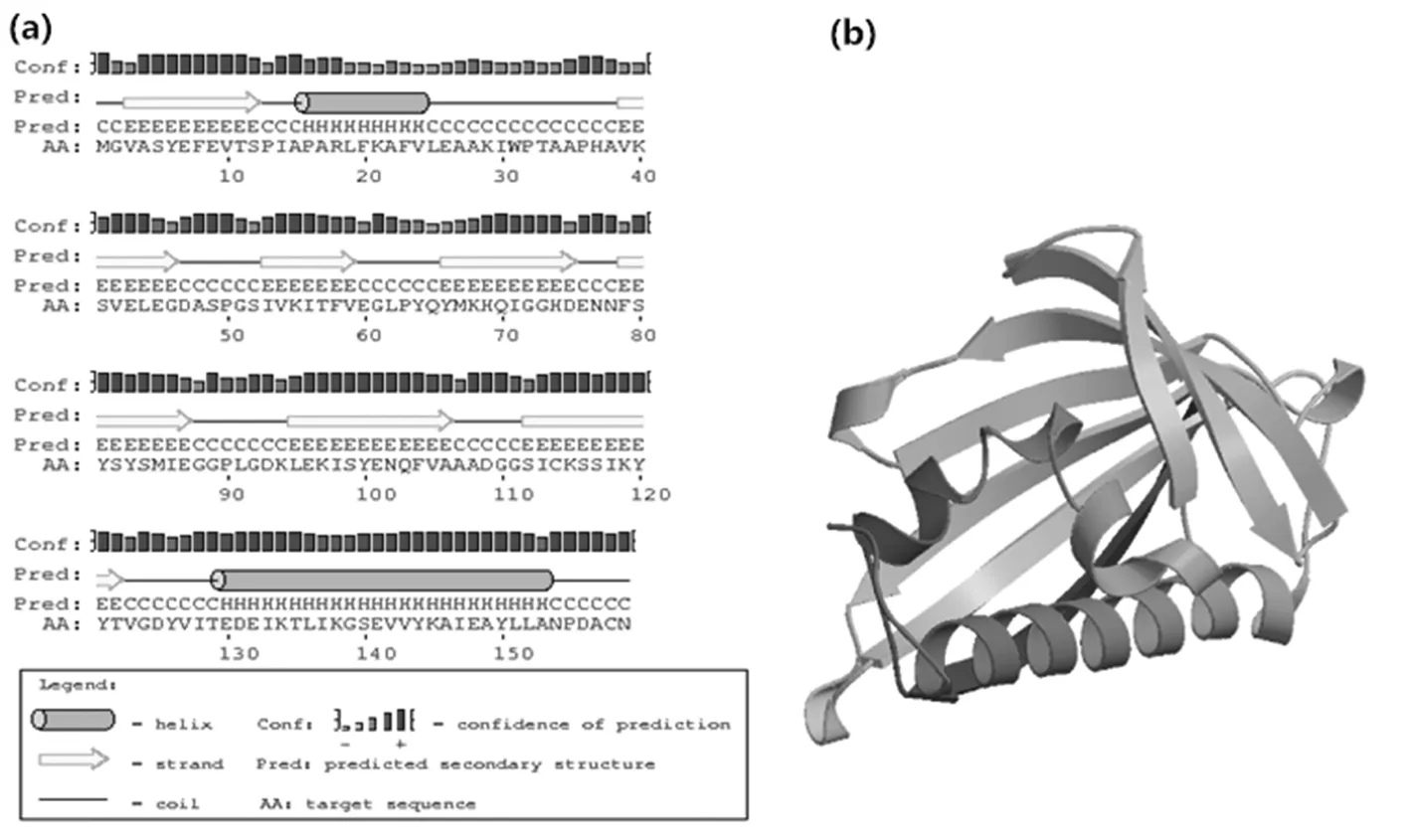
图3 GbPR10蛋白质二级结构(a)和三级结构(b)
Fig.3 GbPR10 Protein secondery structure(a)and 3D structure(b)

TcPR10:可可树Theobromacacao(EOY06619.1);VvPR10:葡萄Vitisvinifera(CAN79558.1);PgPR10:石榴Punicagranatum(OWM71176.1);PaPR10:甜樱桃Prunusavium(XP-021806242.1);HbPR10:橡胶树Heveabrasiliensis(XP-021637260.1);ZjPR10:枣Ziziphusjujube(AGL07712.1);方框表示P-Loop;下划线表示Bet-v1结构域核心序列; The Activation-Loop is boxed;Bet-v1 conserved domain is underlined
图4 GbPR10与其他物种同源比对
Fig.4 GbPR10 homologous analyses with other plants
2.5 GbPR10基因在乙烯和水杨酸诱导下表达
乙烯处理后,GbPR10在抗病海岛棉品种06-146表达出现先增后降的趋势,8 h时表达量显著高于其它时期;在感病品种新海14号的表达量不均匀,2、4和8 h时都表达量下调并低于处理前期(0 h),16 h时表达量升高并达到最高值,之后缓慢下降。GbPR10在不同时期抗病品种的表达量显著高于感病品种。
在水杨酸的诱导下,GbPR10在抗病品种06-146被诱导2 h时没有表达,4 h时诱导后才出现表达量逐渐升高缓慢下降的趋势;在感病品种新海14号中,虽然处理后期出现表达量趋势,但是全处理时期的表达量都低于处理前(0 h)的表达量。每个时期抗病品种的表达量显著高于感病品种。图7
表3 GbPR10亚细胞定位预测
Table 3 GbPR10 Subcellular localization analyses

蛋白质扩散部位Protein located position可能性(%)Probability细胞质86.2细胞核1.9叶绿体0.3液泡0.7细胞膜0.7线粒体6.7内质网3.3细胞外0.0过氧化物酶体0.0高尔基体0.0
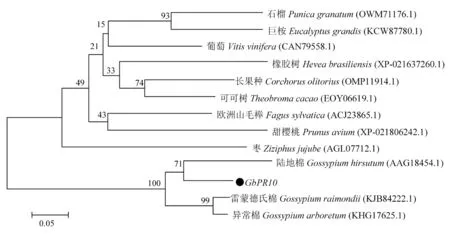
图5 GbPR10与其他植物相关蛋白系统进化树
Fig.5 Phylogenetic analyses of GbPR10 protein with other diffiren plants
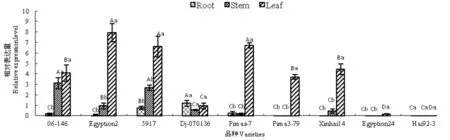
注:不同小字母表示不同组织间显著差异,不同大字母表示不同品种间显著差异,均在0.05水平差异显著
Note:Different small letters in The same coloum indicate significant difference between tissues, Different big letters in The same space indicate significant difference between varieties,all equally described in 0.05 level
图6 GbPR10基因在枯萎病接菌不同海岛棉品种根、茎、叶片中表达
Fig.6 GbPR10 expression in Fusarium oxysporum disposed Root、Stem and leaf of diffiren sea-island cotton
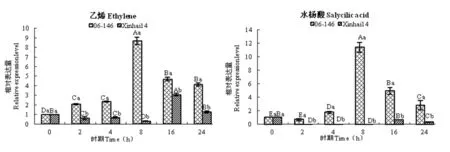
注:不同小字母表示不同品种间显著差异,不同大字母表示不同时期间显著差异,均在0.05水平差异显著
Note:Different small letters in The same coloum indicate significant difference between varieties, Different big letters in The same space indicate significant difference between times,all equally described in 0.05 level
图7 GbPR10基因在激素处理的海岛棉根中表达
Fig.7 GbPR10 expression in hormone disposed Root of sea-island cotton
3 讨 论
Markovic等研究证明,大部分PR10基因ORF序列约456~489 bp,推倒的氨基酸约为151~162个,分子量约在15~18 kDa,是一种分布于细胞质的酸性蛋白[21]。研究克隆的GbPR10具有480 bp编码框序列,翻译成159个氨基酸,分子量为17 300.62,存在于细胞质的亲水性蛋白,此结果与前人的研究结果一致。Zhou等[22]发现棉花GaPR10蛋白的P-Loop中的氨基酸Glu-148和Tyr-150被替换后,其P-Loop活性几乎丧失。但研究发现[23]刺茄SsPR10蛋白中,Glu97、Glu149和His151改变后并未丧失活性,分析认为该蛋白中Asp76、Gly111和Gly112可能替代形成了这一结构。研究的GbPR10蛋白活性环P-Loop(G-X-G-G-X-G-X-X-K)变为G-X-A-S-X-G-X-X-K,这与陈郦俊[16]克隆的海岛棉PR10-1蛋白有相似性,但是这对该蛋白表达有无影响还需要进一步的研究分析。
作为病程相关蛋白的一个成员,PR10参与不同外源病原菌的诱导表达[24]。Park等研究发现,由辣椒疫霉菌诱导后辣椒CaPR10基因的表达量明显的升高。Chadha等[25]发现原核表达的花生AhPR10融合蛋白具有抗F.oxysporum(尖镰孢菌)和R.solan(纹枯病菌)菌活性。虽然很多PR10蛋白都是在病原体侵染条件下表达,但研究表明PR10在营养组织中也可以组成型表达。研究枯萎病侵染的6份抗病和3份感病海岛棉品种根、茎、叶上对新克隆的GbPR10进行荧光定量表达分析,结果显示,GbPR10基因在不同抗病品种叶片上的表达量显著高,在感病品种选择性表达,而无论是抗病或者感病品种根和茎上几乎没有显著性表达。研究发现[24]刺茄SsPR10存在组成性表达,当幼叶被TMV接种后,SsPR10在叶片中表达量最高,根,茎的表达量较低。又研究报道[26]玉米ZmPR-10和ZmPR-10.1在根上的表达量高于茎和叶片的表达量。说明GbPR10病原体诱导下也存在组成型表达,在不同品种和不同组织上的表达量有差异,抗、感品种表达量差异有可能与PR蛋白在抗病品种自身合成,感病品种与外源胁迫相互作用合成的特征有关系[27]。
植物激素在植物抗病途径中的作用是很重要。Raskin等[28]证明SA是植物病程相关蛋白增强抗病性所必须的信号分子,提高植物系统获得性抗性(Systemic Acquired Resistance,SAR)的前提,ET的诱导使植物体内产生一些小肽,并通过提高诱导系统抗性(Induced Systemic Resistance,ISR)抑制病原菌的危害[29]。研究通过ET和SA处理一对抗病和感病海岛棉品种对GbPR10进行表达,表明ET诱导后在抗病品种出现先增后降的表达量趋势,感病品种处理后期出现表达;SA诱导8 h达到最高表达量后逐渐下降,而感病品种几乎没有诱导表达。研究说明ET诱导GbPR10的表达,而感病品种的表达量比较晚;外源施加的SA提高GbPR10的表达量,而抗病品种对SA敏感性比感病品种高。这种激素诱导可能与GbPR10蛋白的氨基酸序列或者抗病、感病海岛棉品种本身组织结构、抗病性有关,这需要进一步的研究。
研究推测海岛棉GbPR10基因可能在枯萎病抗病途径和相关信号途径中发挥一定的作用。
4 结 论
从高抗病海岛棉中克隆了GbPR10基因,通过生物信息学发现该蛋白含有突变的甘氨酸活性环G-X-A-S-X-G-X-X-K和特有的Bet-v1保守结构域,GbPR10蛋白与其他物种有高度的相似性,基因进化树表明与陆地棉PR10蛋白亲缘关系最近,在海岛棉抗病、感病组织上不同程度地由枯萎病和ET、SA诱导表达,在海岛棉生长过程中具有抗病性作用。
