维持血液透析患者腹主动脉钙化与血清FGF⁃23、Klotho蛋白相关性
2018-07-27郭正勇赵观进张慧泽江波张宇许洪涛
郭正勇 赵观进 张慧泽 江波 张宇 许洪涛
南京梅山医院(南京210039)
慢性肾功能衰竭维持性血液透析(MHD)的患者逐渐增加,在MHD患者中,心血管事件是主要的死亡原因,血管钙化已成为MHD患者心血管事件增加的独立危险因素。传统的动脉粥样硬化因素包括吸烟、高血压病、糖尿病及高脂血症,被大家知晓。现在有研究表明成纤维细胞生长因子23(FGF⁃23)和可溶性Klotho蛋白(sKL)参与了血管钙化[1],但是其与MHD患者腹主动脉钙化相关性研究较少。本研究通过横断面研究,探讨MHD患者腹主动脉钙化发生与FGF⁃23、sKL相关性,为临床防治提供依据。
1 资料与方法
1.1 研究对象 选取2015年1月至2017年6月在梅山医院门诊MHD患者137例,透析时间大于3个月。排除标准:(1)合并自身免疫性疾病者;(2)近期使用激素或免疫抑制剂者;(3)合并恶性肿瘤者;(4)已行甲状旁腺切除术者;(5)活动性肝炎或肝硬化者;(6)活动性炎症性疾病;(7)其他影响到体内钙化状态及软组织钙化的伴随疾病(如肉瘤样结节病变、多发性骨髓瘤、HIV和淀粉样变性);(8)精神疾病或因其他原因无法配合检查者。所有患者均接受金宝透析机AK⁃96,进行碳酸氢盐血液透析,透析器为尼普洛150⁃G,每周治疗2~3次,每次4 h,血管通路均为自体动静脉内瘘,血流量为250~280 mL/min,透析液流量为500 mL/min,透析液钙浓度为1.50 mmol/L。每次透析超滤以达到临床估计的干体重为目标。本研究经本院伦理委员会批准,所有患者均签署知情同意书。
1.2 临床生化指标测定及一般资料收集 收集患者的性别、年龄、透析龄、基础肾脏疾病、体质指数、有无吸烟、血压等。所有患者采集透析前空腹静脉血检测血红蛋白(Hb)、血糖(GLU)、血钙(Ca)、血磷(P)、白蛋白(ALB)、三酰甘油(TG)、总胆固醇(TC)、全段甲状旁腺激素(iPTH)、C反应蛋白(CRP)等,同时计算校正钙、钙磷乘积(Ca×P)、尿素清除指数(Kt/V),校正钙(mg/dL)=血清总钙(mg/dL)+0.8×[4⁃血清白蛋白(g/dL)]。FGF⁃23、Klotho蛋白、25(OH)2D3均采用酶联免疫吸附法(ELISA)测定,ELISA试剂盒采购于上海蓝基生物科技有限公司。
1.3 腹主动脉钙化积分具体评价方法 采用腹部侧位X平片,利用Kauppila对腹主动脉钙化评分,从L1到L4每个腰椎相邻主动脉瓣钙化积分用每个椎体上方和下方间隙的中点评估,病变用以下方法分级:0,没有主动脉钙化沉积;1,小的散在的钙化沉积,少于动脉壁纵轴长度1/3;2,1/3或更多,但少于2/3钙化;3,2/3或更多钙化。钙化评分分别从动脉前后壁采集,每个椎体水平范围为0~6分,总的AACS评分范围为0~24分。由2位有经验的放射科医师单盲法进行腹主动脉钙化评分(AACS)评定,取平均值。根据AAC得分情况分为无钙化组(AAC=0),轻度钙化组(0<AAC ≤ 4),中度钙化组(5≤AAC≤15),重度钙化(AAC≥16)。
1.4 统计学方法 采用SPSS 19统计软件进行分析处理,正态分布计量资料以均数 ±标准差表示,偏态分布资料以中位数表示,计数资料组间比较应用卡方检验。计量资料组间比较采用t检验或方差分析,两组间相关性分析应用Pearson直线相关分析,并进行逐步多元回归分析。P<0.05认为差异具有统计学意义。
2 结果
2.1 患者一般情况 本研究共收入137例研究对象,男72例(52.55%),女65例(47.45%),年龄21~84岁,平均(55.17±13.26)岁。原发疾病:慢性肾小球肾炎57例(41.61%)、糖尿病肾病53例(38.68%)、高血压良性小动脉肾硬化12例(8.76%)、其他病因15例(10.94%)。见表1。
2.2 AAC患者与非AAC患者临床资料及实验室检查指标比较 与非AAC患者比较,ACC患者的年龄和透析龄较大(P<0.01);原发病为糖尿病肾病比例较高(P<0.05);脉压差大(P<0.05);AAC患者FGF⁃23水平(634.18± 210.87)pg/mL,明显高于非AAC患者(527.03±257.45)pg/mL,两组差异具有统计学意义(P<0.01);AAC患者sKL水平(361.68±54.33)pg/mL,明显低于非 AAC患者(403.56±65.69)pg/mL,两组差异具有统计学意义(P<0.01),见表1。
2.3 患者腹主动脉钙化发生率及不同程度AAC组间临床指标比较 137例患者中98例(71.53%)发生腹主动脉钙化,无钙化组(AAC=0)39例(28.47%),轻度钙化组(0<AAC≤ 4)21例(15.33%),中度钙化组(5≤ AAC≤ 15)54例(39.41%),重 度 钙 化 组(AAC ≥ 16)23例(16.79%)。MHD患者的年龄、透析龄、脉压在各组间比较,差异具有统计学意义;且腹主动脉重度钙化组患者年龄大、透析龄长、脉压差大、糖尿病患者比例高。FGF⁃23、sKL蛋白、P、Ca×P在各组间比较差异有统计学意义,其中重度钙化组FGF⁃23、P、Ca×P较高,sKL蛋白较低。见表2。
2.4 腹主动脉钙化因素相关性分析及多元回归分析 Pearson相关分析显示,腹主动脉钙化与年龄(r=0.486,P< 0.01)、透析龄(r=0.424,P<0.01)、糖尿病(r=0.233,P< 0.01)、钙磷乘积(r=0.538,P< 0.01)、IPTH(r=0.466,P< 0.01)、FGF⁃23(r=0.564,P< 0.01)等呈正相关,与Klotho蛋白(r=-0.572,P< 0.01)呈负相关,血清Klotho蛋白与FGF⁃23呈负相关(r=-0.523,P< 0.01)。多元逐步回归分析显示年龄、透析龄、FGF⁃23、Klotho蛋白进入了回归方程。见表3。
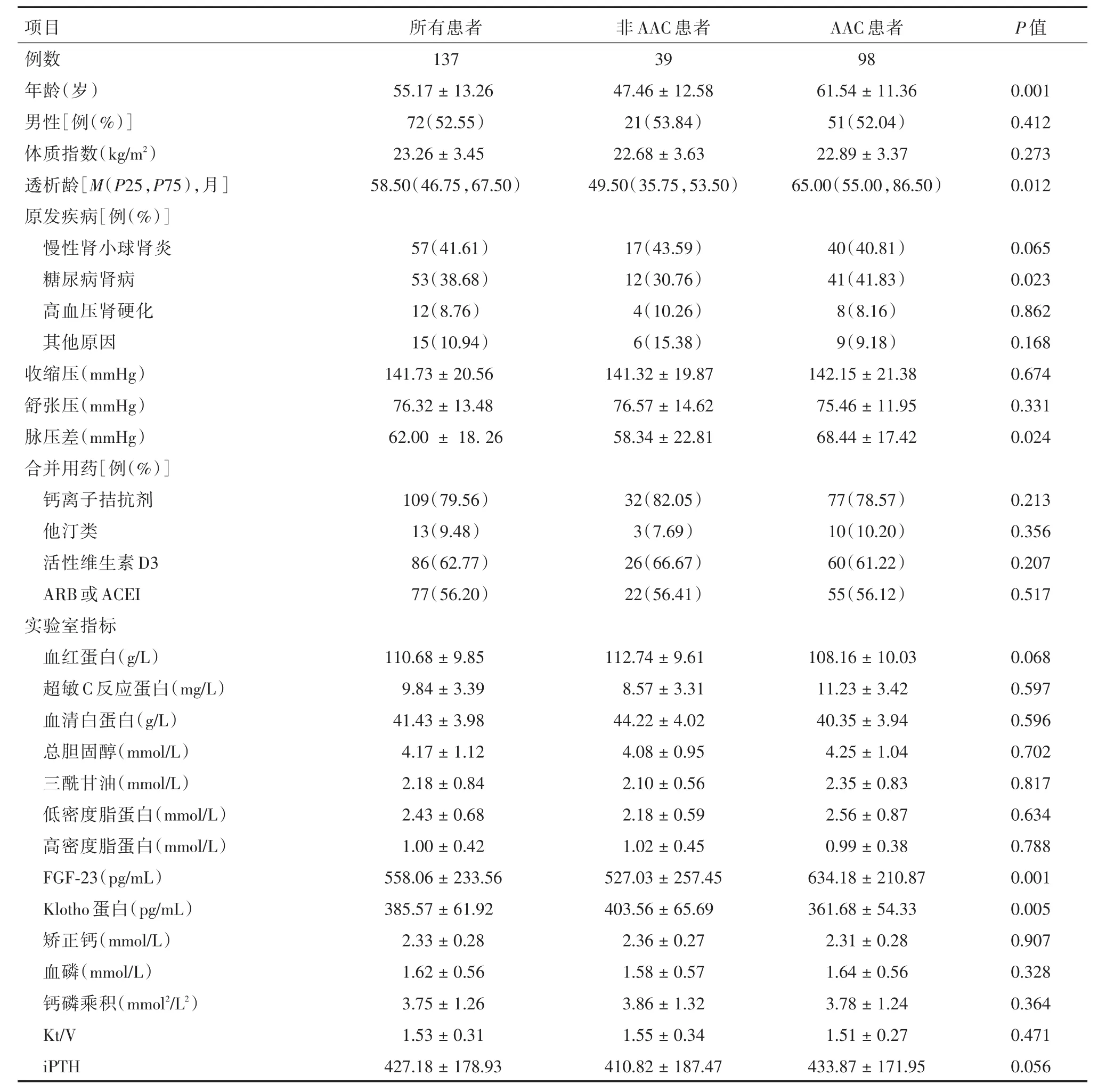
表1 患者一般资料及实验室检查指标比较Tab.1 Comparison of clinical indexes between AAC group and non⁃AAC group x ± s
3 讨论
本研究显示,本组腹主动脉钙化发生率为71.53%,重度钙化为16.79%(钙化累及3个节段及以上)。国外研究发现血液透析患者AAC的发生率为81.0%~94.4%[2⁃3];国内有学者对血液透析患者行腹部侧位X线平片检查,结果发现68.9%的患者存在 AAC[4]。周艳等[5]研究腹膜透析患者中有57.3%存在AAC。与上述研究相比,本组血液透析患者的AAC患病率与国内其他研究的血液透析患者相近,低于国外研究,这可能与国外ERSD的首要病因是糖尿病肾病有关,国内ERSD的主要病因为慢性肾小球肾炎,而糖尿病是传统的导致血管钙化危险因素之一。血液透析患者的AAC发病率高于腹膜透析患者,我们推测血液透析患者的残余肾功能越差,对于血磷及炎性因子的清除少,钙磷乘积增高,体内尿毒症毒素残留多,造成体内诱导血管钙化的因素增加,容易促进血管钙化。
TAKAYAMA等[6]的研究提示MHD患者中,高龄、透析龄、合并冠心病是AAC的独立危险因素。本研究结果显示,MHD患者AAC与年龄、透析龄、血脂、糖尿病相关,与传统因素所致血管钙化一致。近年来研究发现Klotho和FGF⁃23作为重要的钙磷代谢调节剂,参与了慢性肾脏病矿物质代谢紊乱的发生发展[7]。FGF⁃23的生理功能主要是促进尿磷排泄和抑制肠道对磷的吸收,它通过近端肾小管的钠磷共转运蛋白 NaPi⁃2a与 NaPi⁃2c的胞吞作用来增加磷酸的外分泌,通过抑制1⁃α羟化酶与24⁃催化羟基酶的合成,减少血1⁃25羟维生素D的浓度,抑制肠道对磷的吸收。有研究数据显示在 CKD2期,患者的 FGF⁃23 水平即开始升高[8],CKD患者血磷浓度升高,高PTH血症,导致骨质细胞的活化,释放大量FGF⁃23,其升高本来是CKD患者对自身高磷血症的一种代偿机制,用以促进肾脏排磷。FGF⁃23与磷、PTH、维生素D、钙之间作用密切,互相影响,且呈现整体效应,但是随着病情进展,不断升高的FGF⁃23会对靶器官造成损害,有研究表明高水平的FGF⁃23促进动脉粥样硬化,且左心室肥厚相关[9]。本研究显示AAC患者FGF⁃23水平明显高于非AAC患者水平,两组差异具有统计学意义(P< 0.01),FGF⁃23水平越高,腹主动脉钙化程度越重,相关分析显示FGF⁃23与腹主动脉钙化呈正相关,是其高危因素之一。本研究还显示FGF⁃23与钙磷乘积正相关,与PTH无相关性。有动物实验研究表明FGF⁃23可诱发继发性甲状旁腺功能亢进[10],敲除FGF⁃23基因后的老鼠血清中PTH水平降低[11],说明FGF⁃23与PTH之间存在正相关性。但本研究未发现FGF⁃23与PTH的相关性,可能与使用活性维生素D有关。
表2 腹主动脉不同钙化程度组间实验室相关指标比较Tab.2 Comparison of clinical indexes among groups with different degrees of AAC ±s

表2 腹主动脉不同钙化程度组间实验室相关指标比较Tab.2 Comparison of clinical indexes among groups with different degrees of AAC ±s
注:与轻度钙化组比较,*P<0.05;与中度钙化组比较,#P<0.05
项目年龄(岁)性别男性[例(%)]透析龄[M(P25,P75),月]糖尿病[例(%)]收缩压(mmHg)舒张压(mmHg)脉压差(mmHg)血红蛋白(g/L)超敏C反应蛋白(mg/L)血清白蛋白(g/L)总胆固醇(mmol/L)三酰甘油(mmol/L)低密度脂蛋白(mmol/L)高密度脂蛋白(mmol/L)FGF-23(pg/mL)Klotho蛋白(pg/mL)矫正钙(mmol/L)血磷(mmol/L)钙磷乘积(mmol2/L2)Kt/V iPTH轻度钙化组(n=21)57.68±10.64 9(42.86)61.50(48.75,82.50)9(42.85)143.58±22.46 75.32±14.38 67.17±17.45 110.31±11.83 9.53±2.16 41.44±5.72 4.13±0.81 2.07±1.03 2.46±0.75 1.00±0.38 568.71±160.37 387.34±50.05 2.30±0.18 1.55±0.33 3.56±1.27 1.88±0.37 394.70±202.54中度钙化组(n=54)60.67±12.38*37(68.52)*63.00(54.00,81.50)*21(38.89)145.39±23.67 74.57±15.56 70.34±18.83*106.16±8.94 10.05±3.35 40.65±6.13 4.52±1.14 2.32±1.65 2.38±0.82 0.98±0.27 628.97±161.26*365.93±49.58*2.34±0.17 1.67±0.36*4.13±0.95*1.77±0.54 415.76±189.13重度钙化组(n=23)61.50±14.16*14(60.87)*72.00(56.75,86.50)*#11(47.82)147.72±22.38 73.46±14.87 74.44±19.47*#102.27±14.25 10.62±3.41 40.11±5.88 4.35±1.45 2.49±1.60 2.27±1.04 0.92±0.31 684.49±168.91*#341.60±51.56*#2.32±0.19 2.03±0.37*#5.11±1.20*#1.73±0.28 432.55±217.80
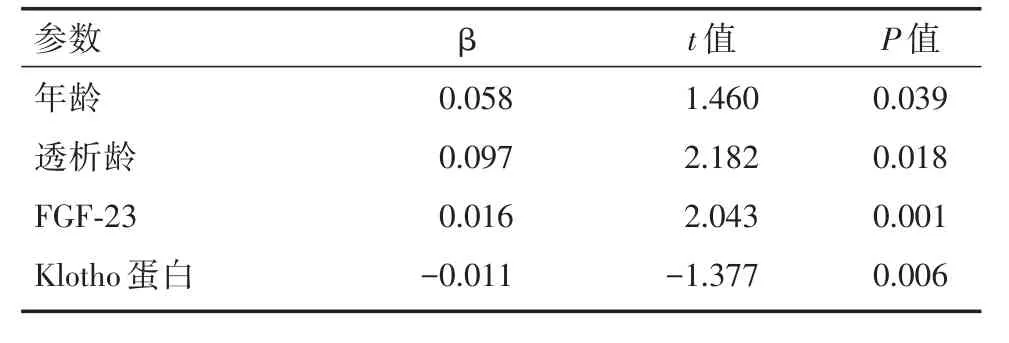
表3 腹主动脉钙化影响因素的多元回归分析Tab.3 Multivariate linear regression analysis of risk factors of AAC
sKL作为FGF⁃23信号转导通路的关键因子,与FGF⁃23密切相关。sKL不仅参与FGF⁃23与其受体结合,也参与了磷的调控。sKL直接作用于肾小管上Ca通道和P转运体,减少磷的重吸收,另外与FGF⁃23受体构成FGFR⁃Klotho复合体,强化FGF⁃23降低血磷的作用[12]。sKL还可减轻高磷诱导的血管平滑肌细胞的成骨细胞转化、钙化作用[13]。SUN等[14]分别给予尿毒症小鼠及离体肾小管细胞尿毒素吲哚酚处理,发现sKL基因超甲基化,sKL表达减少;而应用DNA甲基转移酶可减少尿毒素诱导的sKL基因甲基化,增加sKL表达,提示尿毒症患者sKL表达的减少可能是由于sKL基因甲基化所致。尿毒症患者机体内环境处于氧化应激和微炎性反应状态,使sKL基因甲基化而抑制其表达。血液透析患者随着肾功能的丧失及sKL表达的减少,使FGFR⁃Klotho复合体减少,导致磷的重吸收增加,排泄减少,导致血管钙化。sKL水平降低导致血管内皮细胞功能失调,加重过氧化氢诱导的内皮细胞衰老和凋亡,促进动脉硬化的发生[15]。我们已发现MHD患者sKL降低可增加腹主动脉钙化发生风险。本研究结果提示MHD患者sKL与AAC呈负相关性;且随着sKL的降低,AAC程度加重,故高sKL水平是AAC的保护因素。综上所述,MHD患者腹主动脉钙化的发生率高,高水平血清FGF⁃23、低水平血清sKL是MHD患者发生腹主动脉钙化的高危因素。可以将血清FGF⁃23、sKL作为MHD患者发生血管钙化的重要生物指标。由于属于横断面研究,且样本量较小,没有远期随访资料,本研究存在一定局限性,需要以后更加深入探讨。
