Reversine对小鼠乳腺癌4T1细胞增殖和凋亡的调控及相关作用机制的研究
2018-07-27黄迪黄宇翁杰锋黄子圣麦振豪赵俐古维立
黄迪 黄宇 翁杰锋 黄子圣 麦振豪 赵俐 古维立
1广州医科大学附属广州市第一人民医院普通外科(广州510180);2广州消化疾病中心(广州510180);3华南理工大学第二附属医院普通外科(广州510180)
乳腺癌是一种严重危害女性健康的常见恶性肿瘤。近40年来,乳腺癌的发病率位居全球首位,全球每年有140万妇女被确诊为乳腺癌[1]。近几十年来,尽管放疗、化疗及多种生物治疗手段有了长足发展,然而,乳腺癌转移、复发及化疗耐药等仍是乳腺癌治疗的难题。有证据表明[2-4],reversine可以抑制肿瘤细胞增殖,诱导肿瘤细胞凋亡,但是目前国内应用reversine作用乳腺癌的研究极为少见,特别是用于三阴性乳腺癌41T细胞的研究尚未见报道。因此,本研究旨在探讨rever⁃sine对小鼠乳腺癌4T1细胞的增殖和凋亡的影响,并探究其可能的作用机制。
1 材料与方法
1.1 材料和试剂 小鼠乳腺癌4T1细胞株(中山大学动物实验中心);药物reversine(SIMGA公司);CCK⁃8试剂盒(上海东仁化学科技有限公司);DMEM培养基干粉、胎牛血清、DMSO(美国Sigma公司);TGF⁃beta、TIMP1、MMP9抗体(Abcam公司);Caspase⁃3、bax、bcl⁃2 抗体(Cell Signaling公司);Aurora B 抗体(Novusbio公司);Annexin⁃V⁃FITC/PI凋亡试剂盒(南京凯基生物科技发展有限公司);RIPI裂解液(碧云天生物技术公司);Millipore聚偏二氟乙烯(PVDF)膜、电化学(ECL)发光液、垂直电泳槽、Western blot电泳仪、Western blot转膜仪、FACS Calibur流式细胞仪(美国BD公司);多功能酶标仪(香港基因有限公司);IX51倒置相差显微镜(日本Olympus)。
1.2 实验方法
1.2.1 细胞培养及分组 4T1细胞用体积分数为10%胎牛血清加1%双抗的高糖DMEM培养基,于二氧化碳培养箱(37℃,5%CO2)中培养,隔天换液,传代时间为3~4 d,传代前用2.5 g/L的胰酶消化。以加入DMSO的4T1细胞作为正常对照组;以reversine终浓度分别为 10、25、50 μg/mL 为实验组,每组药物干预时间为24 h。
1.2.2 CCK⁃8法检测 取对数期生长的细胞,设立空白对照组,24 h后加入CCK⁃8试剂,与培养基按1∶10的比例加入,于培养箱中培养1 h后,多功能酶标仪检测波长为450 nm处的吸光度OD值。实验重复3次。细胞抑制率计算方法:细胞抑制率=1-(加药组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。
1.2.3 流式细胞仪检测 取对数期生长的细胞,按照分组情况加入药物干预,24 h后胰酶消化收集细胞,1×PBS洗涤细胞2次,制成细胞悬液,用300目滤网过滤,收集滤液,计数取1×105个细胞,离心后用500 μL的Binding Buffer重悬细胞,加入5 μL Annexin V⁃FITC以及5 μL PI,混匀,室温避光反应15 min,1 h内完成检测。每组实验重复3次。
1.2.4 Western blot检测 分别收集各组细胞,提取蛋白质后,进行SDS⁃PAGE电泳(分离胶10%,浓缩胶5%),每孔加入50 μg蛋白质,恒压100 V电泳至分离胶底部,转移到硝酸纤维素膜上,脱脂牛奶室温封闭1 h,按照抗体说明书稀释抗体,4℃孵育过夜,PBST洗涤3次,每次15 min。再加入1∶2 000稀释的二抗,室温摇床振摇1 h,PBST洗涤3次,ECL试剂显色、曝光并拍照,扫描后用Image⁃Pro⁃Plus图像分析软件进行光密度积分值(Integral of optical density)分析。
1.3 统计学方法 运用SPSS 13.0软件,多组间均数差异性比较采用单因素方差分析(One⁃way ANOVA),数据均以±s表示,P<0.05为差异有统计学意义。
2 结果
2.1 reversine对小鼠乳腺癌4T1细胞的增殖抑制作用 如图1所示,随着浓度的增加,reversine对4T1细胞的抑制率也随之增加,在同一浓度下,reversine干预48 h比干预24 h对细胞的抑制更强,呈现时间剂量对应关系。不同浓度reversine对细胞形态的影响见图2。
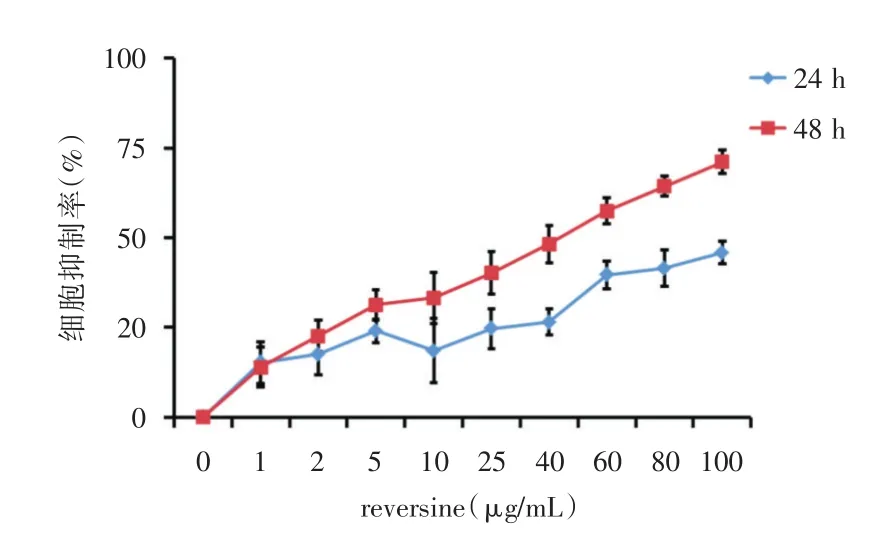
图1 reversine对小鼠乳腺癌4T1细胞的增殖抑制作用Fig.1 Effect of reversine on proliferation of mouse breast cancer 4T1 cells
2.2 reversine对小鼠乳腺癌4T1细胞凋亡率的影响 流式细胞检测凋亡结果如图3,不同浓度reversine对小鼠乳腺癌4T1细胞早期凋亡率、晚期凋亡率和总凋亡率的情况见表1。低浓度组(10 μg/mL)细胞早期、晚期以及总凋亡率有所增加,但是差异无统计学意义。中浓度组(25 μg/mL)及高浓度组(50 μg/mL)细胞早期、晚期以及总凋亡率明显增加,与对照组相比,差异有统计学意义(P<0.05)。
2.3 Caspase⁃3、bax、bcl⁃2 蛋 白 表 达的变化Western blot检测各组细胞中 Caspase⁃3、bax、bcl⁃2蛋白表达如图4所示,利用IPP图像分析软件对各蛋白条带定量,结果(图5)应用reversine能够显著增加活化的Caspase⁃3的表达,随着加药浓度的增加bax/bcl⁃2的比值也增大。

图2 reversine对4T1细胞形态的影响Fig.2 Effect of reversine on mouse breast cancer 4T1 cells

图3 reversine对小鼠乳腺癌4T1细胞凋亡率的影响Fig.3 Effect of reversine on apoptosis of mouse breast cancer 4T1 cells

表1 不同浓度reversine对小鼠乳腺癌4T1细胞早期凋亡率、晚期凋亡率和总凋亡率的影响Tab.1 Flow cytometry was adopted to detect the effect of reversine on the apoptosis of mouse breast cancer 4T1 cells
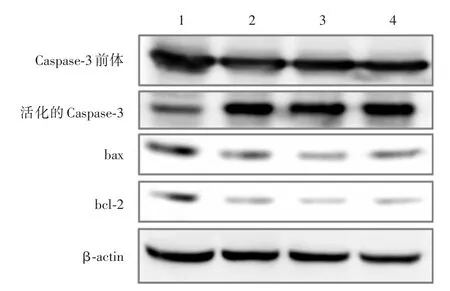
图4 Western blot检测各组细胞中Caspase⁃3、bax、bcl⁃2蛋白的表达情况Fig.4 Western blot was conducted to detect the expression of Caspase⁃3,bax,bcl⁃2 protein

图5 活化的Caspase⁃3和bax/bcl⁃2比值定量分析情况Fig.5 Expression of Caspase⁃3 and bax/bcl⁃2 ratio of reversine on mouse breast cancer 4T1 cells
2.4TGF⁃β1、TIMP1、MMP9和Aurora B蛋白表达情况 Western blot检测各组细胞中TGF⁃β1、TIMP1、MMP9和Aurora B蛋白表达(图6),利用IPP图像分析软件对各蛋白条带定量,结果(图7)发现应用reversine后 TGF⁃β1表达无差别,rever⁃sine能够下调4T1细胞中TIMP1、MMP9和Aurora B蛋白的表达,差异有统计学意义(P<0.01)。
3 讨论
Reversine是一种人工合成的小分子的嘌呤衍生物,它可以令已分化的细胞转变为未分化的祖细胞[5],这一特性使得该药物在再生医学方面受到广泛关注[6-10]。近年来研究发现reversine在体外细胞实验具有抗肿瘤作用,对甲状腺癌细胞[2,4]、口腔鳞状细胞癌[3]、宫颈癌[11]、骨髓癌[12]等的治疗具有一定作用。

图6 Western blot检测各组细胞中TGF⁃β1、TIMP1、MMP9和Aurora B蛋白的表达情况Fig.6 Western blot was conducted to detect the expression of TGF⁃β1,TIMP1,MMP9 and Aurora B protein
4T1细胞是一种雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体-2(Her⁃2)均为阴性的乳腺癌细胞。三阴性乳腺癌发病年龄小,最具侵袭性、转移率高且预后不良,常规标准的化疗治疗预后较差,仍为临床上治疗的难点。虽现阶段研究发现具有BRCA1/2基因变异的三阴性乳腺癌应用铂类效果较佳,但三阴性乳腺癌仍为当今乳腺癌治疗的挑战。本研究利用reversine对小鼠乳腺癌4T1细胞进行体外实验,结果发现reversine可以抑制小鼠乳腺癌4T1细胞的增殖,高浓度组(50 μg/mL)处理48 h后,50%的细胞生长受到抑制。Aurora B是一种促进细胞有丝分裂的关键蛋白,既往针对reversine的研究发现该药物是通过Aurora B这一通路使细胞去分化。本实验中west⁃ern blot检测发现reversine能显著下调4T1细胞Aurora B蛋白的表达来抑制细胞增殖。流式细胞术结果发现reversine可以促进4T1细胞凋亡,其作用机制与促进活化的 Caspase⁃3 表达、增加 bax/bcl⁃2比值有关。
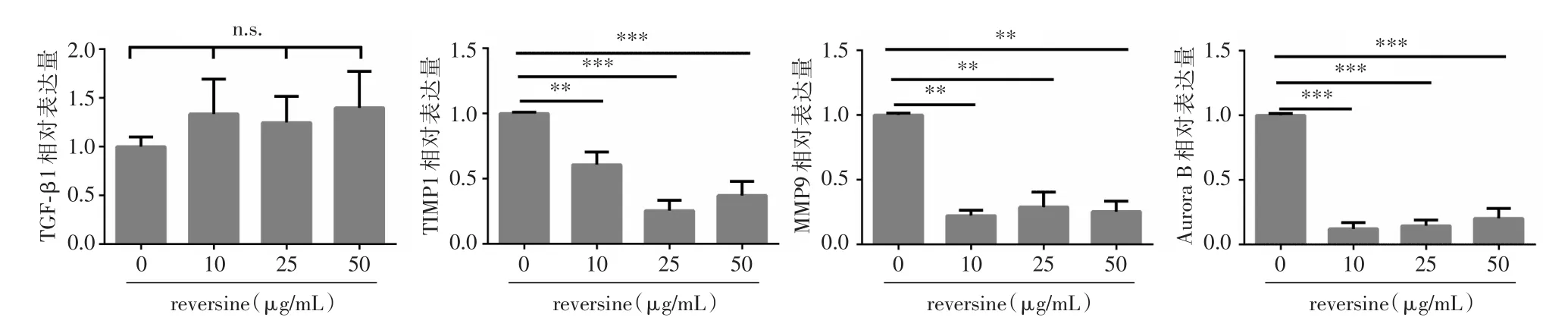
图7 TGF⁃β1、TIMP1、MMP9和Aurora B蛋白定量分析Fig.7 Expression of TGF⁃β1,TIMP1,MMP9和Aurora B protein of reversine on mouse breast cancer 4T1 cell
乳腺癌转移是多步骤发展的过程,表现为:具有侵袭转移能力的乳腺癌细胞脱离原发灶开始浸润周围组织,穿透血管壁进入血液,通过血液循环进行远处转移,最后在远处器官上形成新的转移灶。现阶段的研究发现影响乳腺癌转移的因素包括转化生长因子-β(TGF⁃β)、基质金属蛋白酶(MMPs)、组织金属蛋白酶抑制物(TIMPs)和外泌体等。转化生长因子TGF⁃β1是人体组织细胞内具有调控功能的细胞因子,在细胞增殖及凋亡中发挥重要的调节作用[13],既往的研究也发现rever⁃sine对细胞的作用机制与TGF⁃β1相关[14]。有研究表明TGF⁃β1的表达与多种恶性肿瘤的进展和预后有关[15-17]。本研究发现reversine对4T1细胞TGF⁃β1的表达没有影响。肿瘤的侵袭转移是其难以根治的主要原因,基质金属蛋白酶MMPs与TIMPs间活性的平衡决定着细胞外基质(ECM)降解与否。有研究表明,MMP9和TIMP1表达失衡与乳腺癌浸润及淋巴结转移密切相关[18-19],乳腺癌组织中的TIMP1含量越高其预后越差[20]。本研究通过应用reversine干预4T1细胞,了解reversine作用乳腺癌的相关机制,结果显示reversine可以显著减低4T1细胞中MMP9和TIMP1蛋白的表达,提示re⁃versine有可能通过下调乳腺癌细胞中MMP9和TIMP1蛋白的表达来减少细胞侵袭,但具体通路尚待进一步研究。
综上所述,reversine可以抑制小鼠乳腺癌4T1细胞的增殖,诱导细胞凋亡,reversine可能成为一种治疗乳腺癌的潜在药物,其具体的机制仍有待进一步研究。
