miR-29a抑制前列腺癌细胞恶性表型的分子机制
2018-07-27阎成全才胜勇王鹏飞赵超飞刘逸飞
阎成全, 才胜勇, 孟 斌, 王鹏飞, 李 林, 赵超飞, 刘逸飞, 孟 昕
(河北医科大学附属唐山市工人医院泌尿外科,河北 唐山 063007)
前列腺癌(prostate cancer,PCa)是全球男性最常见的恶性肿瘤之一,其发病率和死亡率分别位居所有恶性肿瘤的第2位和第6位[1]。流行病学资料表明,我国前列腺癌的发病率和死亡率呈逐年增加趋势[2],好发于50岁以上的男性[3]。目前前列腺癌的治疗方法包括手术切除、放化疗和内分泌治疗,但这些方法对晚期转移性前列腺癌的预后效果较差,且易复发,患者表现出对放疗和化疗药物的耐药性。因此,寻找和研发有效治疗前列腺癌的靶向药物迫在眉睫。
微小RNA(microRNAs,miRNAs,miR)是一类长度为18~25个核苷酸的单链非编码RNA。越来越多的研究发现miRNAs的异常表达与大多数肿瘤的发生发展密切相关,在肿瘤细胞增殖、凋亡、转移、侵袭及耐药等方面发挥重要作用[4-6]。miR-29a是最新研究发现的miR-29s家族成员之一,miR-29s在急性淋巴瘤[7]、慢性淋巴细胞白血病[8]、鼻咽癌[9]和乳腺癌[10]中低表达,表明miR-29a可能是一个肿瘤相关因子并在肿瘤发生发展中发挥重要作用。下调miR-29a可抑制p85a和CDC42的表达进而降低p53的抗凋亡活性,导致细胞恶性表型[11];miR-29a低表达能抑制DNA甲基转移酶(DNA methylatransferase,DNMT)3A/3B的活性以及胞外蛋白的表达促进细胞增殖和转移[12]。miR-29a的异常表达与前列腺癌细胞的恶性表型密切相关,目前miR-29a在前列腺癌发生发展中的生物学功能鲜有报道。Li等[13]的研究发现,赖氨酸(K)特异性去甲基化酶[lysine (K)-specific demethylase, KDM]5B在前列腺癌组织和细胞中高表达,miR-29a与KDM5B mRNA的3’非转录区域(3’UTR)结合可抑制KDM5B的表达,进而抑制前列腺癌细胞LNCaP和PC3的增殖并诱导细胞凋亡。KDM4B是KDM家族成员之一,是组蛋白H3第4位赖氨酸三甲基化(H3K4me3)的主要去甲基化酶,研究发现H3K4me3的水平与前列腺癌的低分化有关[14]。目前关于KDM4B在前列腺癌中的生物学功能仍不清楚。本研究运用基因芯片、生物信息学及分子生物学技术探讨miR-29a在前列腺癌发生发展中的生物学功能及其分子机制,为以miR-29a为靶点研发治疗前列腺癌的靶向药物提供科学依据。
材 料 和 方 法
1 材料
选取2005~2015年唐山市工人医院泌尿外科前列腺癌手术后经病理证实为前列腺癌的组织标本,其中前列腺癌组织33例,癌旁组织28例。用于miRNA提取的组织经尿道前列腺电切术及耻骨弓上前列腺切除术中迅速收集,置于液氮中保存。本研究经河北医科大学附属唐山市工人医院伦理委员会批准,并签署患者知情同意书。
人前列腺癌细胞系PC3、DU145、LNCaP和ArCaP及正常前列腺细胞株RWPE-1购自ATCC;高糖型DMEM培养基(Gibco);胎牛血清和双抗(青霉素和链霉素)购自北京鼎国昌盛生物技术有限责任公司;胰蛋白酶、MTT和DMSO购自Sigma;Transwell 板购自Corning;脂质体2000购自Invitrogen;抗KDM4B抗体购自Cell Signaling Technology;抗GAPDH抗体购自北京中杉金桥生物技术有限公司;Annexin V-FITC/PI试剂盒、mirVana miRNA分离试剂盒和TaqMan miRNA试剂盒购自Applied Biosystems;反转录试剂盒(PrimeScriptTMRT reagent Kit with gDNA Era-ser)和real-time PCR 试剂盒(SYBR® Premix Ex TaqTMⅡ)购于TaKaRa;BCA蛋白浓度检测试剂盒购自Thermo。
2 方法
2.1miRNA芯片的筛选 按照mirVana miRNA试剂盒说明书提取前列腺癌组织和癌旁组织中的miRNA,送公司进行miRNA芯片杂交扫描,采用Agilent Human miRNA Microarray Rel12.0单标芯片,按公司规定要求进行标记和杂交,结果由Agilent Scan Control软件和仪器进行扫描,图像经Agilent Feature Extraction 9.5.3 软件进行处理分析,输出原始表达数据。运用GeneSpring 11软件导入上述原始数据,处理生成归一化数据。设定样本的属性,配对统计输出P<0.05,差异倍数>1.5的miRNA分子。运用Cluster 3.0进行聚类分析,将miRNA依照各自的表达谱自主归入相关信号转导链中,通过生物信息学方法(TargetScan、Gene Ontology和Pathway Analysis)挖掘和筛选前列腺癌组织和癌旁组织中具有差异表达的miRNA作为后续研究靶点。
2.2Real-time PCR 将生长良好的PC3、DU145、LNCaP、ArCaP和RWPE-1细胞消化计数后,以细胞密度为每孔1×106个接种到10 cm培养皿中,置于37 ℃、5% CO2及饱和湿度的培养箱中,待细胞融合度达到90%时收集细胞;并取前列腺癌组织和癌旁组织各30 mg于研磨器中,加入液氮研磨至匀浆,按照mirVana miRNA分离试剂盒提取细胞和组织中miRNA;运用TaqMan miRNA检测试剂盒检测miR-29a的表达,采用SYBR GreenⅡ荧光染料法和IQ5TMReal-Time PCR Detection System(Bio-Rad)进行real-time PCR数据分析,引物序列见表1。miR-29a结果经U6校正,KDM4B的mRNA表达经GAPDH校正,两者相对表达量用2-ΔΔCt表示。进行3次独立重复实验。
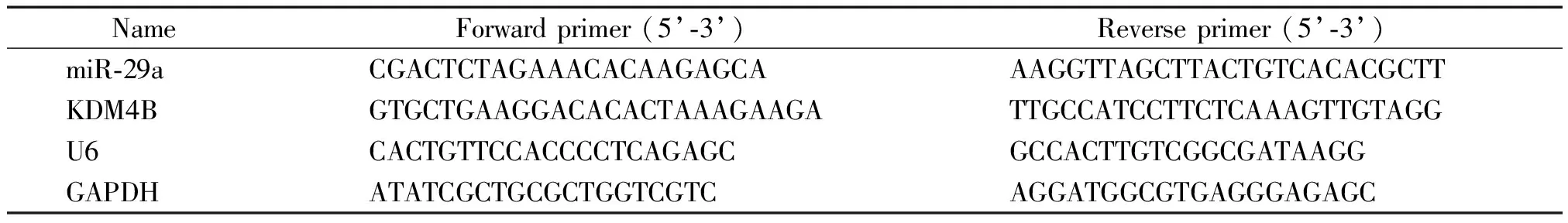
表1 Real-time PCR引物序列
2.3细胞转染 pGenesil-1-miR-29a表达质粒由本实验室构建。将生长良好的PC3、DU145、LNCaP和ArCaP细胞消化计数后,以细胞密度为每孔2×105个接种到6孔板中,置于CO2培养箱中,待细胞融合度达到85%左右时按照脂质体2000说明书进行pGenesil-1-miR-29a细胞转染。转染的细胞培养4 h后换成完全培养基,转染的细胞命名为PC3-miR-29a、DU145-miR-29a、DU145-miR-29a和LNCaP-miR-29a;以转染pGenesil-1质粒为阴性对照(negative control,NC)组,未转染的细胞为空白对照(blank control)组,细胞置于培养箱中培养用于后续实验。
2.4MTT实验检测细胞活力 PC3-miR-29a、DU145-miR-29a、LNCaP-miR-29a和ArCaP-miR-29a细胞及阴性对照组细胞经消化计数后,以细胞密度为2.5×107/L接种于96孔板中,分别培养12 h、24 h、48 h、72 h和96 h时进行MTT实验,同时设空白对照组,每孔加入20 μL MTT(5 g/L),37 ℃继续培养4 h,弃掉培养液,每孔加入150 μL DMSO,置于摇床上室温震荡5 min,用酶标仪测定492 nm处的吸光度(A),按下式计算细胞活力抑制率:细胞活力抑制率(%)=(对照组A值-实验组A值)/对照组A值×100%。
2.5集落形成实验 PC3-miR-29a、DU145-miR-29a、LNCaP-miR-29a和ArCaP-miR-29a细胞及阴性对照细胞经胰酶消化计数后,以每皿200个接种于10 cm细胞培养皿中,置于37 ℃、5% CO2孵箱中,每个剂量设3个平行,培养至通过肉眼能清晰观察到可见的细胞克隆(约2周);将培养基倒掉,PBS洗涤,甲醇固定10 min,PBS洗涤,吉姆萨染色10 min,自来水清洗,晾干后计数,按下列公式计算细胞集落形成率:集落形成率(%)=细胞集落平均值/铺板细胞数×100%。
2.6流式细胞术检测细胞凋亡 PC3-miR-29a、DU145-miR-29a、LNCaP-miR-29a和ArCaP-miR-29a细胞及阴性对照细胞消化计数后以细胞密度每孔4×105个接种到6孔板中,培养72 h后弃掉培养基,PBS洗涤,用无EDTA的胰酶消化收集细胞,加入PBS制成细胞悬液。按照Annexin V-FITC/PI试剂盒说明书操作,先加入500 μL Binding Buffer重悬细胞,再加入5 μL FITC标记的Annexin V和5 μL PI混匀,室温下避光孵育15 min,上流式细胞仪检测细胞凋亡。
2.7Western blot检测蛋白水平 PC3-miR-29a、DU145-miR-29a、LNCaP-miR-29a和ArCaP-miR-29a细胞及阴性对照细胞经消化、离心收集细胞,用RIPA(50 mmol/L Tris-HCl, pH 7.5,150 mmol/L NaCl,1% NP-40,0.5%脱氧胆酸钠,0.1% SDS)重悬细胞,超声破碎,12 000 r/min、4 ℃离心10 min,按照BCA试剂盒说明书测定总蛋白浓度。每个样本取30 μg进行SDS-PAGE,将蛋白转移到PVDF膜上,5%脱脂奶粉室温封闭1 h,分别孵育 I 抗,以GAPDH为内参照,4 ℃过夜。TBST洗膜、孵育 II 抗,室温孵育1 h。ECL显影后扫描,蛋白相对表达量经内参校正后经Quantity One软件分析。
3 统计学处理
每个实验进行3次独立重复试验。应用SPSS 17.0统计软件进行相关数据分析,结果用均数±标准差(mean±SD)表示。组间的比较采用t检验,多组间的比较采用单因素方差分析(one-way ANOVA),以P<0.05为差异有统计学意义。
结 果
1 miR-29a在前列腺癌及癌旁组织中的差异表达
运用miRNA芯片筛选出在前列腺癌组织和癌旁组织中差异表达的miRNA,结果显示,28种miRNA在前列腺癌组织和癌旁组织中呈不同程度的差异表达,其中miR-29a在3例前列腺癌组织中的表达水平与对应癌旁组织中的表达水平明显不同,miR-29a在前列腺癌组织中显著下调,见图1A;real-time PCR结果进一步证实miR-29a在前列腺癌中的平均表达水平较癌旁组织显著降低,差异有统计学意义(P<0.05),见图1B。

Figure 1. The differential expression of miR-29a in prostate cancer tissues and their adjacent tissues. A: miRNA chip screening; B: the expression of miR-29a detected by real-time PCR. PC1: paracarcinomatous tissue 1; PC2: paracarcinomatous tissue 2; PC3: paracarcinomatous tissue 3; T1: prostate cancer tissue 1; T2: prostate cancer tissue 2; T3: prostate cancer tissue 3; PC: paracarcinomatous tissues.
图1miR-29a在前列腺癌及癌旁组织中的差异表达
2 瞬时转染介导miR-29a在前列腺癌细胞中高表达
Real-time PCR结果发现,miR-29a在前列腺癌细胞系PC3、DU145、LNCaP和ArCaP中的表达水平均显著低于RWPE-1细胞(P<0.01),见图2A。瞬时转染pGenesil-1-miR-29a质粒48 h后,real-time PCR结果显示,与阴性对照组比较,miR-29a在PC3-miR-29a、DU145-miR-29a、LNCaP-miR-29a和ArCaP-miR-29a细胞中的表达水平均显著上调(P<0.05),见图2B。
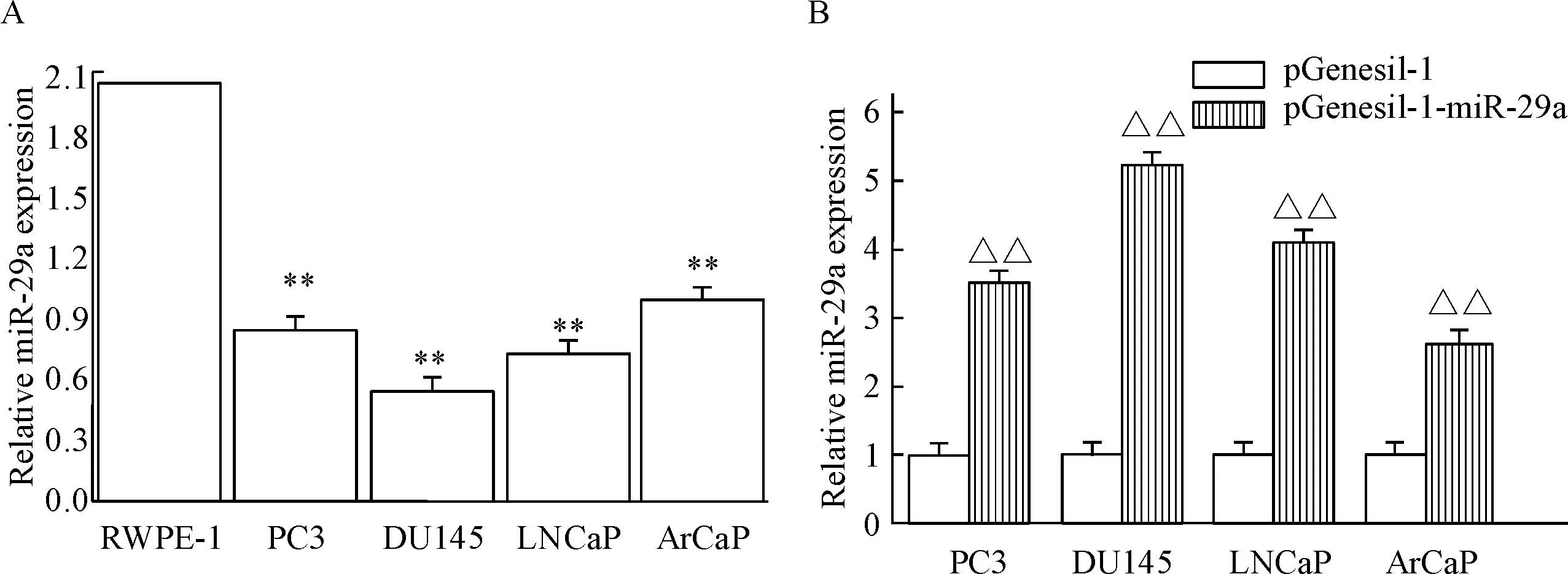
Figure 2. The expression levels of miR-29a in the prostate cancer cells were detected by real-time PCR. A: the miR-29a expression in different prostate cancer cell lines; B: the miR-29a expression before and after transfection. Mean±SD.n=3.**P<0.01vsRWPE-1 group;△△P<0.01vspGenesil-1 group.
图2Real-timePCR检测miR-29a在前列腺癌细胞中的表达水平
3 miR-29a过表达对前列腺癌细胞活力的影响
MTT实验结果显示,miR-29a过表达显著抑制前列腺癌细胞活力,转染的4组前列腺癌细胞培养12 h、24 h、48 h、72 h和96 h时的细胞活力,与pGenesil-1组比较均显著降低(P<0.05),见图3。
4 miR-29a过表达对前列腺癌细胞集落形成的影响
培养14 d时,集落形成实验结果显示,miR-29a过表达明显抑制4种前列腺癌细胞的集落形成能力,见图4A;PC3-miR-29a、DU145-miR-29a、LNCaP-miR-29a和ArCaP-miR-29a细胞的集落形成率与对照组细胞比较显著降低(P<0.05),见图4B。
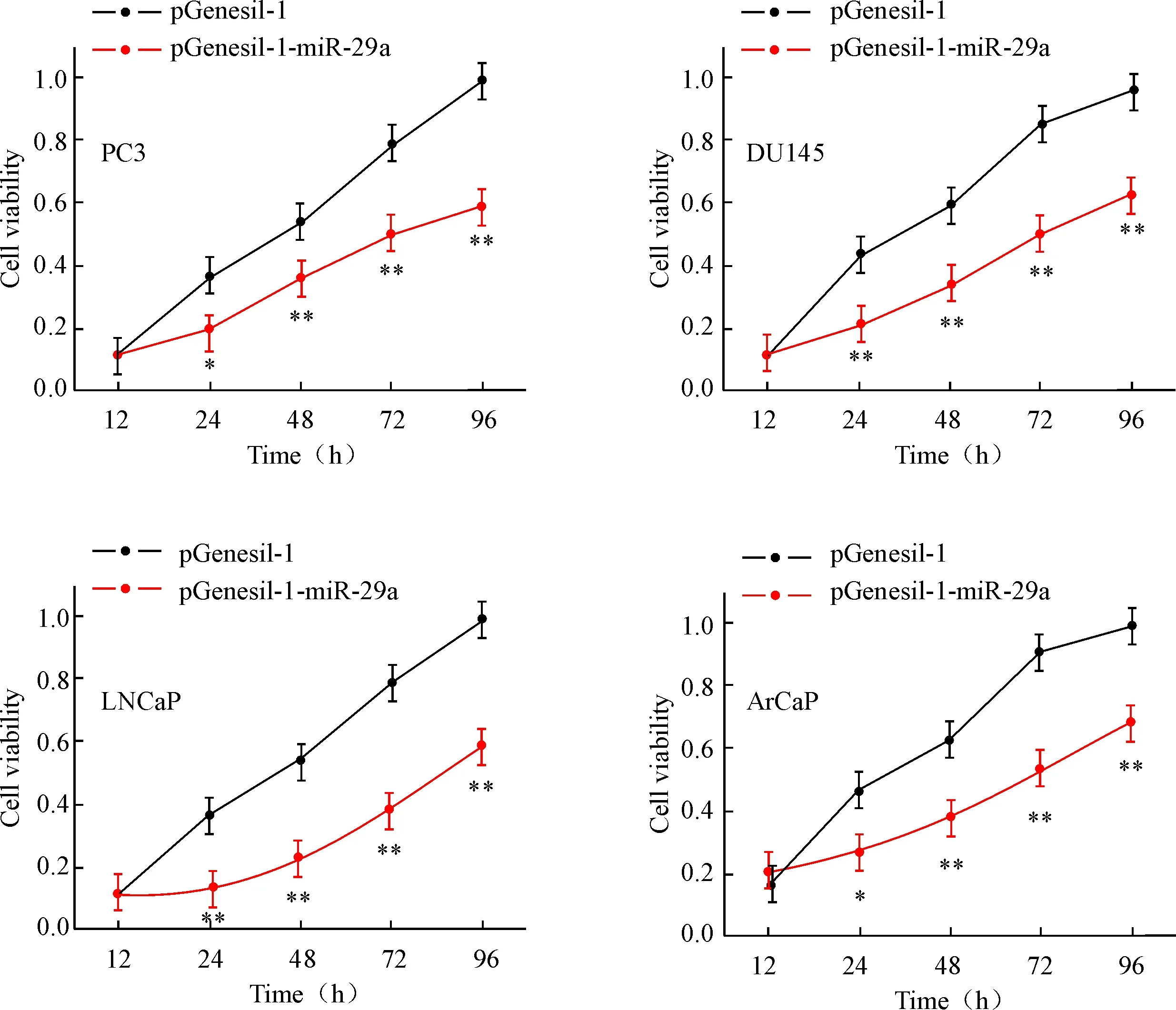
Figure 3. The effect of miR-29a over-expression on the viability of prostate cancer cells. Mean±SD.n=3.*P<0.05,**P<0.01vspGenesil-1 group.
图3miR-29a过表达对前列腺癌细胞活力的影响
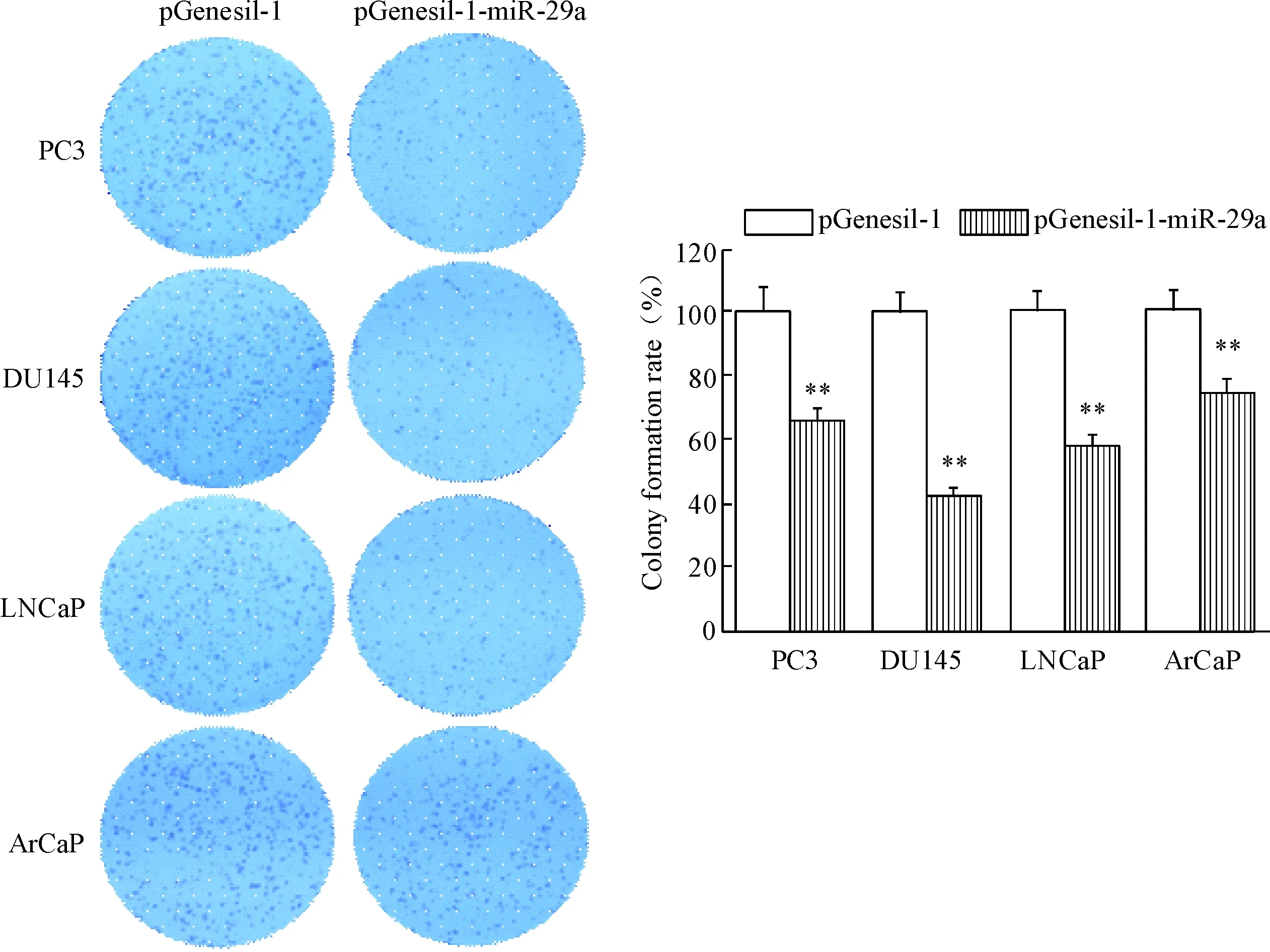
Figure 4. The effect of miR-29a over-expression on colony formation of prostate cancer cells (×20). Mean±SD.n=3.**P<0.01vspGenesil-1 group.
图4miR-29a过表达对前列腺癌细胞集落形成的影响
5 miR-29a过表达对前列腺癌细胞凋亡的影响
Annexin V-FITC染色及流式细胞术结果显示,miR-29a过表达显著诱导前列腺癌细胞凋亡,转染的细胞培养72 h时,PC3-miR-29a、DU145-miR-29a、LNCaP-miR-29a和ArCaP-miR-29a细胞的凋亡率较对照组细胞显著升高(P<0.05),见图5,提示miR-29a过表达诱导前列腺癌细胞凋亡。

Figure 5. The effect of miR-29a over-expression on the apoptosis of prostate cancer cells. Mean±SD.n=3.*P<0.05,**P<0.01vspGenesil-1 group.
图5miR-29a过表达对前列腺癌细胞凋亡的影响
6 miR-29a过表达抑制前列腺癌细胞KDM4B的蛋白水平和细胞生长特性
Real-time PCR结果发现KDM4B的mRNA水平在前列腺癌组织和细胞中较癌旁组织和正常前列腺细胞表达上调(P<0.05或P<0.01),见图6A、B;Western blot结果进一步证实KDM4B蛋白水平在前列腺癌组织和细胞中较癌旁组织和正常前列腺细胞高表达(P<0.05),见图6C、D。为了进一步了解miR-29a与KDM4B之间的关系,我们在miR-29a过表达的前列腺癌细胞中发现,miR-29a过表达显著抑制KDM4B的蛋白水平(P<0.05),见图6E;同时MTT实验和流式细胞术分析结果发现,miR-29a过表达抑制KDM4B蛋白水平的同时前列腺癌细胞活力被显著抑制,细胞凋亡率显著增加,而上调KDM4B的表达部分逆转miR-29a过表达对细胞活力和凋亡的作用,与对照组比较差异均有统计学意义(P<0.05),见图6F、G。这些结果提示抑制KDM4B蛋白水平可能是miR-29a过表达抑制细胞恶性表型的分子机制之一。
讨 论
miRNA是一种非编码的短链RNA,可以通过降解靶基因和抑制靶基因翻译来实现转录后的基因沉默。miRNA在肿瘤中异常表达通过对下游靶基因调控在肿瘤发生、发展中行使着重要的癌基因或抑癌基因的功能[15],提示恶性肿瘤的发生过程与miRNA表达谱的改变密切相关。大量研究发现miRNA在肿瘤细胞的分化、凋亡、转移、耐药以及代谢等多种生物学行为中发挥重要的调节作用[16-19]。
miR-29a在多种肿瘤组织和细胞中低表达如胆管细胞癌、急性淋巴瘤、肺癌以及鼻咽癌等[7-10],提示miR-29a是一个肿瘤相关因子参与肿瘤的发生与发展。研究发现恢复miR-29a的表达能增强急性淋巴瘤细胞对促凋亡药物的敏感性[11];miR-29a过表达明显抑制肺癌细胞的增殖[20]。miR-29a调控靶蛋白如胶原、转录因子及甲基转移酶的表达,调控细胞的增殖、转移,从而影响肿瘤的发生与发展。本研究基因芯片结果显示miR-29a在33例前列腺癌组织中异常表达,real-time PCR结果进一步证实miR-29a在33例前列腺癌组织和4种前列腺癌细胞系中的表达水平显著低于28例癌旁组织和正常前列腺细胞,说明miR-29a低表达与前列腺癌的发生发展密切相关。为了进一步研究miR-29a在前列腺癌发生发展中的生物学功能,我们通过瞬时转染使miR-29a在4种前列腺癌细胞中过表达,发现miR-29a过表达显著抑制前列腺癌细胞的活力和集落形成以及诱导细胞凋亡,表明miR-29a是一个肿瘤抑制因子,抑制前列腺癌细胞的生长和诱导细胞凋亡。
越来越多研究发现miRNA的异常表达参与肿瘤的发生与发展,其机制可能通过表观遗传学机制调控关键靶基因的转录和翻译影响肿瘤的进程[21-22]。通常认为表观遗传学机制不会改变DNA碱基序列,通过组蛋白修饰和DNA甲基化水平调控基因表达[23]。最新研究发现miRNA通过表观遗传学机制调控靶基因的转录和翻译促进前列腺癌细胞的增殖和转移[24]。有报道H3K4me3修饰水平与前列腺癌的低分化有关[14],KDM4B是H3K4me3的去甲基化酶,其过表达能降低H3K4的甲基化水平。研究证实组蛋白甲基化通过表观遗传学调控关键靶基因表达在肿瘤的发生发展中发挥重要作用[25]。本研究发现KDM4B在前列腺癌组织和细胞中高表达,与文献报道[8]相符。进一步研究发现miR-29a与KDM4B的表达水平呈负相关,同时miR-29a过表达明显抑制KDM4B的蛋白表达,提示KDM4B是miR-29a的作用靶点之一。细胞表型研究发现上调miR-29a抑制KDM4B表达,细胞活力被抑制,细胞凋亡率明显增加,同时KDM4B过表达时能部分逆转由miR-29a过表达对细胞的活力和细胞凋亡的作用。本研究结果提示miR-29a发挥抑制肿瘤细胞恶性表型至少部分是通过抑制KDM4B而实现。研究发现mi-29a通过抑制KDM5B抑制前列腺癌细胞的增殖和诱导细胞凋亡[13]。本研究发现mi-29a过表达的前列腺癌细胞中上调KDM4B的表达只是部分逆转这一作用,提示KDM4B是miR-29a作用靶点之一,还存在其它靶点如KDM5B[13]。miR-29a过表达可能通过抑制KDM4B的表达进而抑制前列腺癌细胞的生长和诱导细胞凋亡,因此miR-29a是研发治疗前列腺癌药物的新靶点。本研究为以miR-29a为靶点研发治疗前列腺癌的靶向药物提供了新思路。
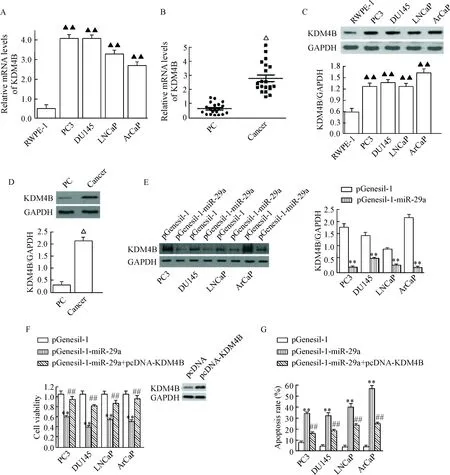
Figure 6. Over-expression of miR-29a inhibited the protein expression of KDM4B and the viability of prostate cancer cells. A: the re-lative mRNA expression of KDM4B in different prostate cancer cell lines; B: the relative mRNA expression of KDM4B in different tissues; C: the protein expression of KDM4B in different prostate cancer cell lines; D: the protein expression of KDM4B in different tissues; E: the protein expression of KDM4B before and after transfection; F: the cell viability before and after transfection; G: the cell apoptosis before and after transfection. PC: paracarcinomatous tissues. Mean±SD.n=3.▲▲P<0.01vsRWPE-1 cells;△P<0.05vsPC group;**P<0.01vspGenesil-1 group;##P<0.01vspGenesil-1-miR-29a group.
图6miR-29a过表达抑制前列腺癌细胞KDM4B的蛋白水平和细胞生长特性
