胶原纤维基多孔碳纤维用于电化学产双氧水
——酸处理对产双氧水性能的影响
2018-07-26赵仕林四川师范大学化学与材料科学学院四川成都60066西南土地资源评价与监测教育部重点实验室四川成都60066
兰 洋,王 凯,邓 艳,雷 藐,马 骏,2*,赵仕林,2** (.四川师范大学化学与材料科学学院,四川 成都 60066;2.西南土地资源评价与监测教育部重点实验室,四川 成都 60066)
电化学产H2O2的反应机理是基于碳材料表面的活性位点发生氧气得到 2个过氧化氢(H2O2)作为一种环境友好的氧化,与Fe2+发生Fenton反应生成高活性的羟基自由基(·OH)[1-3],几乎可以降解所有有机污染物,且不产生二次污染.·OH 具有很高的氧化电位(2.80eV),仅次于氟(2.87eV),在降解有机污染物时表现出强氧化性和非选择性.电化学法原位产 H2O2,不仅可以控制降解有机物的进程,还大大降低 H2O2在合成、运输、储存中的成本.
电子的氧还原反应(ORR),其反应如式(1)所示.
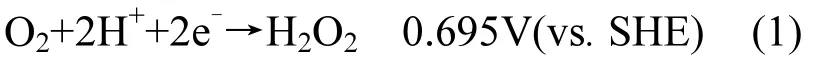
目前用于电化学产 H2O2的碳材料包括:石墨烯(GO)、碳纳米管(CNT)、炭黑等.Liu 等[4]利用石墨烯掺氮合成气体扩散电极构建新型电芬顿阴极电产双氧水量为5~25mg/L.Tang等[5]将CNT经硝酸处理后获得掺氮碳纳米管利用泡沫镍(NF)为基底材料合成气体扩散电极在100mA电流下120min电产H2O2累积可达 307mg/L,余方可等[6]利用以辊压法制备了炭黑-聚四氟乙烯(PTFE)空气阴极在pH=7时,2h后该阴极产 H2O2质量浓度可达 589mg/L.其中,纤维状的碳材料,因为具有导电性能优良等特性而被广泛应用于电化学[7].Cho等[8]以Pt/Ti为阳极,利用碳纤维电产双氧水,在pH为6时表现出优异的电化学活性.尽管如此,碳纤维仍然存在电产双氧水效率偏低不足,限制其获得广泛应用.因此,探讨工艺简便、成本较低、环境友好、电产H2O2效率高的碳材料的制备方法,显得尤为迫切与重要.
皮胶原纤维(Collagen fiber)来源于家畜动物的皮,是自然界中资源量最大的可再生动物生物质[9].制革化学领域中无机金属盐鞣制理论和实践已证实,皮胶原能与金属离子发生交联作用[10].胶原纤维分子结构中规整地分布大量的功能基团,如-COOH、-NH2、-OH等,这些活性基团可以与金属离子发生配位结合,从而将金属离子固载到胶原纤维上[9,11-12].本课题组研究发现,胶原纤维以及与金属离子反应后的胶原纤维,经无氧焙烧可制备出结构规整的碳纤维[13],具有优良的导电性能及化学稳定性.酸处理负载有金属氧化物的碳纤维,具有对碳纤维的造孔效果,使得多孔碳纤维材料具有大的比表面积和孔体积,可以增加暴露的活性位点,缩短O2的扩散路径,从而有利于ORR反应产 H2O2.硝酸处理碳材料还可以提高其亲水性,有利于 O2的吸附[14].同时,胶原纤维分子中均匀分布的较高含量-NH2,通过控制热处理条件可望获得均匀掺氮的碳纤维,据文献报道,由于氮元素的电负性高于碳元素,氮的掺杂有助于提高碳的电负性,从而提高 O2在碳表面的吸附能力,最终增强产 H2O2性能[15-17].
本文利用胶原纤维分子中—COOH、—NH2等官能团负载铁离子,碳化后获得负载氧化铁的掺氮碳纤维材料,再经过不同浓度的硝酸酸浸除氧化铁造孔,获得PCFs-x.通过扫描电镜(SEM)、AAS(原子吸收光谱分析)、X 射线衍射仪(XRD)、元素分析(EA)、比表面测定仪(BET)等仪器手段考察了硝酸浓度对催化剂结构特征的影响,并考察了该碳材料应用于电化学原位产的性能和电子转移数的计算.实验结果表明基于胶原纤维制备的PCFs-x具有优良的产H2O2性能,有望为多孔碳材料的制备提供新的方法与思路.
1 实验部分
1.1 材料与试剂
皮胶原纤维(自制), Nafion 117 (Sigma-Aldrich(上海)有限公司),硫酸铁、戊二醛、甲酸、异丙醇、氢氧化钠、浓硫酸、高氯酸、N-甲基吡咯烷酮、聚偏氟乙烯、乙醇及其他试剂(成都市科龙化学试剂有限公司)均为分析纯.
电化学分析仪(上海辰华仪器有限公司,CHI620E),紫外分光光度计(上海谱元仪器有限公司,ALPHA-1500),电热鼓风干燥箱(上海一恒科学仪器有限公司,DHG-9245A),管式炉(合肥科晶材料技术有限公司,GS-1900s).
1.2 多孔碳纤维材料(PCFs-x)的制备
称取 5.0g皮胶原纤维于 250mL烧杯内,加入100mL蒸馏水,磁力搅拌均匀.用甲酸溶液调节pH值至3.0后加入50mL质量浓度为2.0%的戊二醛溶液,继续搅拌4h.再用NaHCO3溶液调节pH至7.0并保持 2h,在 40℃下持续搅拌 10h.之后 H2SO4溶液调节pH值为 2.0后,加入皮胶原纤维 1.0w %的Fe2(SO4)3·7H2O,常温下反应 4h.用 NaHCO3溶液调节pH值为4.0并保持 4h,在40℃下搅拌 10h.反应完成后过滤,用去离子水和乙醇洗涤产物并干燥,得到CF/Fe.称取适量 CF/Fe样品于管式炉中进行真空焙烧,升温速率5/min℃,升温至800℃且保持2h,得到CF-FexOy.
称取0.1g CF-FexOy样品分别加入40mL不同浓度(0.5,1.0,2.0,4.0mol/L)稀 HNO3溶液中,保持 48h,间歇使用超声促进铁氧化物溶解,过滤并用蒸馏水和无水乙醇洗涤并烘干,得到PCFs-x.标记为PCFs-x(x表示酸溶液浓度),如样品PCFs-0.5,表示0.5mol/L HNO3溶液处理的PCFs-x.
1.3 PCFs-x的结构表征
碳纤维的外观形态采用场发射扫描电子显微镜(FESEM,JSM25900LV)观测;比表面积及孔径采用比表面积测定仪分析(BET,Micromeritics ASAP 2010);碳纤维中铁载量由电感耦合等立体测定(ICP,PerkinElmer Optima 8000);X-射线衍射(XRD,Philips X’Pert Pro-MPD)分析碳纤维负载的铁氧化物的形态,元素分析仪(EA,EuroVector/EA3000)分析碳纤维中的氮元素含量.
1.4 电极的制备
电化学分析用电极的制备:称取 2.0mg PCFs-x加入到异丙醇与水的混合溶液(1mL,异丙醇与水体积比为 1:3)中,超声 30min以上至完全分散.取 75µL此分散状混合物逐滴滴加到玻碳电极上,使材料的最终负载量为 630µg/cm2,再在其表面滴加 10µL 5%Nafion溶液以固定.待其自然干燥后,得到用于扫描循环伏安曲线的电极.
电产双氧水用阴极电极的制备:称取 0.2g NMP于烧杯中,加入5.0mg PVD后搅拌溶解后,加入10mg PCFs-x,充分搅拌至粘稠状,将其均匀涂抹于泡沫镍(2.0cm×2.5cm),在 80℃下真空干燥后,得到用于电产H2O2的阴极电极.
1.5 电化学性能考察
循环伏安实验时,K3[Fe(CN)6]为电解液(50mL,0.05mol/L),饱和甘汞电极为参比电极,铂电极为对电极,所制备的电极为工作电极,扫描速率为 10mV/s,电压范围为-0.6~0.8V.参考文献[18]测定氧还原反应中的电子转移数,电解液换为0.1mol/L的KOH溶液,利用旋转圆盘电极做线性电位扫描,扫描速率为10mV/s,电压范围为-0.6~0.8V,获得所制备电极在不同转速下的LSV曲线,利用K-L方程(如公式(2)和(3)所示)即可算出电极发生ORR反应时的电子转移数.

式中:J为测出的电流密度;JL为极限扩散电流密度;JK为动力学极限电流密度;ω为角速度;n为电子转移数;F为法拉第常数(96485C/mol);DO2为溶解氧浓度;v为电解液黏度;
1.6 电产H2O2性能考察
电产H2O2实验是在Na2SO4电解液中(0.05mol/L,100mL,pH为6),以自制PCFs-x电极为阴极,铂电极为阳极.磁力搅拌下持续通氧30min后调整稳流电源的输入电压和电流分别为4V和20mA,开始产H2O2.之后每隔15min取电解液测其中的H2O2浓度.H2O2的浓度采用硫酸钛盐分光光度法测定,其原理为酸性介质中H2O2与Ti4+生成橙色络合物,在400nm处有最大吸收.
电产H2O2的能耗(CE)按照如下计算方法得到.

式中:n为氧气发生还原产生 H2O2转移的电子数目,等于2;F为法拉第常数(96485C/mol);c为产生的H2O2浓度,mol/L;V为电解质溶液的体积,L;I为电流强度,A;t为时间,s .
2 结果与分析
2.1 多孔碳纤维(PCFs-x)的制备
PCFs-x的制备过程如图1所示.三股螺旋结构的胶原纤维结构中规整地分布功能基团,如-COOH、-NH2(图1a所示),利用这些官能团与三价铁离子(Fe3+)之间的配位作用负载三价铁离子,得到 CF-Fe(III)(图1b),在碳化过程中,铁络合物被氧化为金属氧化物,胶原纤维被碳化为碳纤维,得到 CF-FexOy(图 1c),最后硝酸浸出可溶性铁氧化,获得多孔碳纤维 PCFs-x(图1d).铁离子在多孔碳纤维的制备过程中起到造孔剂的作用.
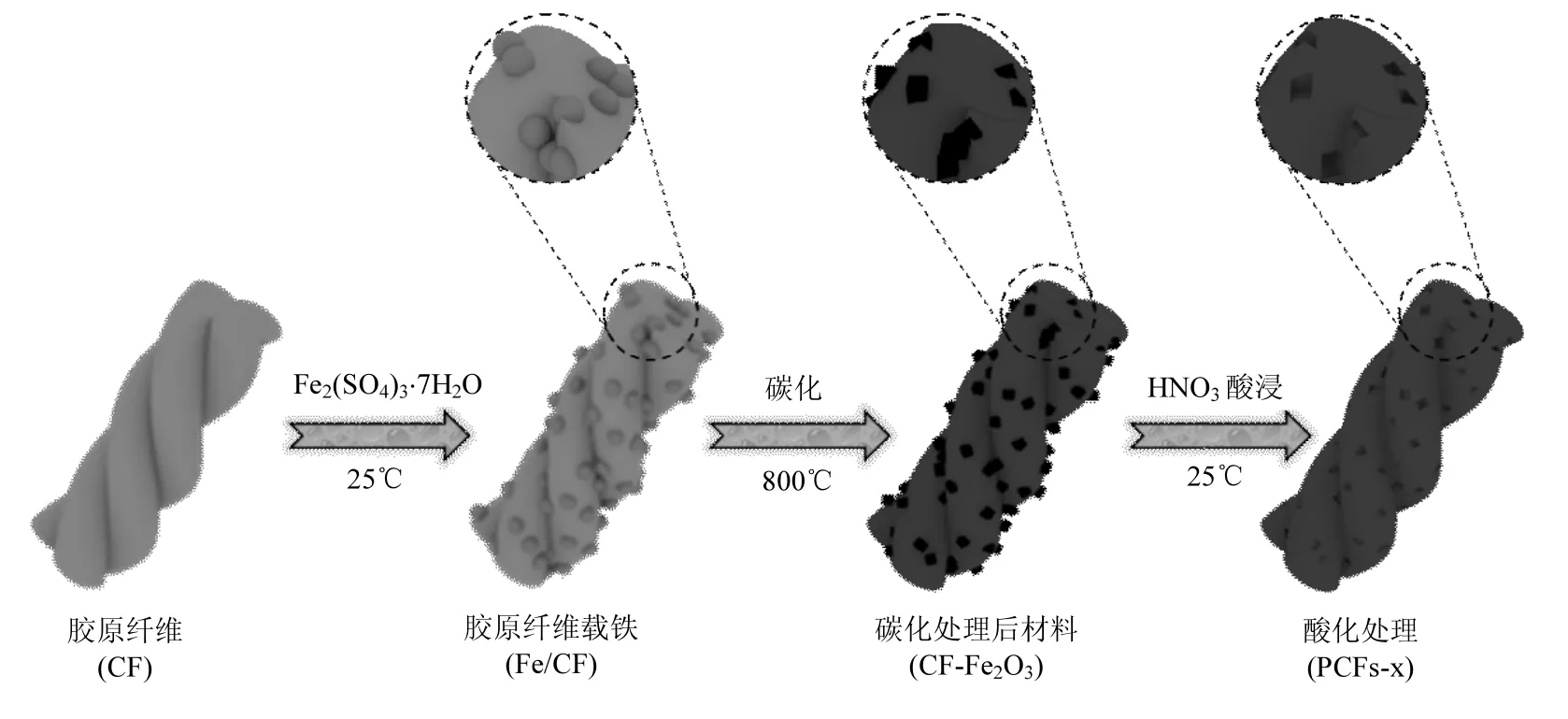
图1 PCFs-x的制备示意Fig.1 Proposed preparation mechanism of PCFs-x
2.2 PCFs-x的表征
2.2.1 各材料中铁含量分析 CF-FexOy和 PCFs-x中铁元素含量如表 1所示.可以看出,硝酸浸取前CF-FexOy的铁含量为 468.80mg/g,经过 0.5mol/L 硝酸浸取后的碳纤维材料 PCFs-0.5的铁含量较低,为51.21mg/g,表明 0.5mol/L硝酸可以浸除碳纤维中可溶性 FexOy,而夹杂、包裹于碳纤维中的铁氧化物因受到碳纤维的空间保护而不易浸出.而随着硝酸浓度由 1.0mol/L增加至 4.0mol/L,铁含量呈现先增加后减小的趋势,原因在于1.0mol/L和2.0mol/L的硝酸不仅溶解了可溶性FexOy,还腐蚀了碳纤维载体,使得铁含量增加;而 4.0mol/L的硝酸还具有较高的氧化性,将碳纤维表面氧化形成诸多含氧基团,如-COOH等,间接增加碳纤维载体的重量,从而使得铁含量略有降低.

表1 PCFs-x中铁元素含量Table 1 The content of ion element in PCFs-x
2.2.2 XRD CF-FexOy和 PCFs-x中铁氧化物的XRD分析情况如图2所示.可以看出,CF-FexOy材料在 2θ=30.12°、35.48°、43.12°、53.50°、57.03°、62.03°处有明显的的晶体衍射峰,分别对应于 Fe3O4晶体的(220)、(311)、(400)、(422)、(511)、(440)晶面(Fe3O4晶体标准卡片,PDF#75-0033),表明负载于碳纤维上的氧化铁晶体为尖晶石结构的 Fe3O4.不同浓度的硝酸浸取后CF-FexOy的碳纤维均具有Fe3O4的晶体衍射峰,且随着酸浓度由1.0mol/L增至4.0mol/L衍射峰强度逐渐减弱,说明PCFs-x均含有未能溶出的Fe3O4,且增加硝酸浓度可增强溶Fe3O4的溶出量.
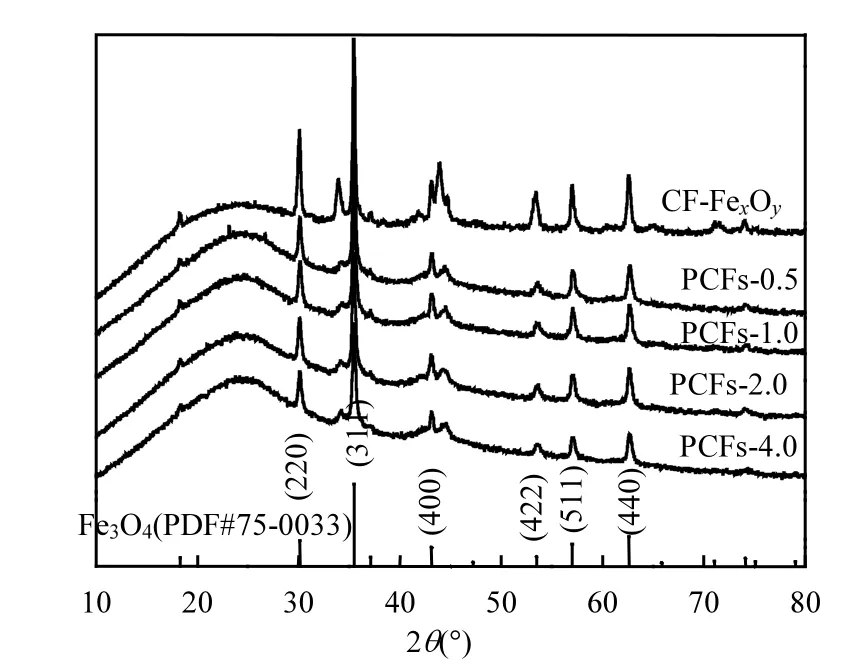
图2 PCFs-x的XRD图谱Fig.2 XRD patterns of PCFs-x
2.2.3 SEM CF-FexOy和PCFs-x的形貌如图3所示.可以看出,热处理后的 CF-FexOy与不同硝酸浓度浸取后的 PCFs-x均保持较好的纤维状,同时CF-FexOy表面较光滑,没有明显的孔道结构.而PCFs-x表面多孔,且随着酸浓度由 0.5mol/L增至2.0mol/L,表面孔道数量呈现先增加后减少的趋势.此现象表明低浓度硝酸(0.5mol/L 和 1.0mol/L)可有效的地溶解碳纤维载体表面的 Fe3O4,起到很好的造孔效果,使得碳纤维的比表面积增加;浓度增加至2.0mol/L后,硝酸对碳材料的氧化,堵塞了Fe3O4溶出形成的孔道,使得孔道结构减少.
2.2.4 BET分析 表2为PCFs-x的比表面积和吸附平均孔径表征结果.由表可见,酸浸处理前的CF- FexOy的 BET为243.02m2/g,随着硝酸浓度由1.0mol/L增至4.0mol/L,样品的比表面积增大后减小.其中,PCFs-1的比表面积最大,达到375.627m2/g,BJH吸附平均孔径为63.6Å;继续增加浓度比表面积逐渐减小,PCFs-4的比表面积仅为60.815m2/g,与SEM分析相一致.
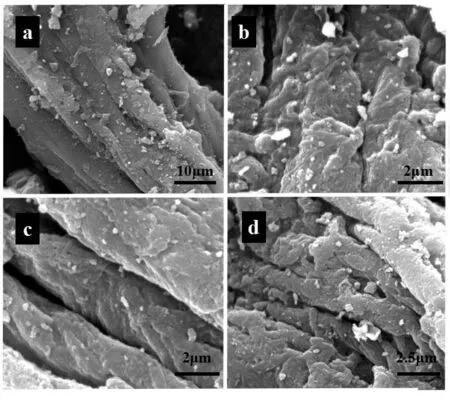
图3 SEM图:(a) CF-FexOy,(b)PCFs-0.5, (c)PCFs-1.0,(d)PCFs-2.0Fig.3 SEM images of CF-FexOy (a), PCFs-0.5(b), PCFs-1.0(c),PCFs-2.0 (d)
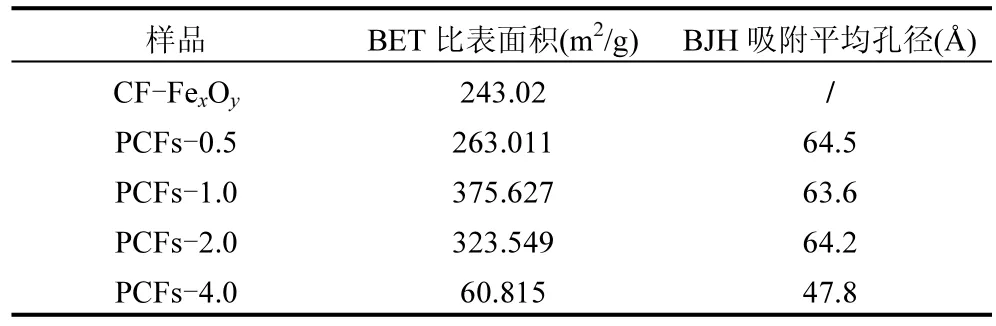
表2 PCFs-x的BET分析Table 2 BET analysis of PCFs-x
2.2.5 EA分析 CF-FexOy和PCFs-x的氮元素含量如表 3所示.可以看出,经 800℃热处理后 CF-FexOy的氮元素含量仍高达 3.521%,PCFs-1中氮元素含量增至4.578%,说明0.5mol/L硝酸浸出碳纤维中氧化铁(来自于原子吸收分析对铁含量的分析结果)后使得氮元素含量增加;而硝酸浓度高于0.5mol/L会腐蚀碳材料,造成氮含量降低.硝酸浸取作为氮元素的外源加入,使氮元素随硝酸浓度的增加含量略有提高.因此,基于胶原纤维分子中-NH2,以及硝酸的浸取带入氮元素,可实现氮元素对碳纤维中碳元素掺杂,有利于增加碳元素电负性,促进电解液中 O2的吸附,从而有望提高碳纤维材料的ORR活性.

表3 PCFs-x中氮元素含量分析Table 3 The content of N element in PCFs-x
2.3 电化学性能考察
2.3.1 循环伏安曲线 由图4可以看出,CF-FexOy的电化学活性很低,在-0.5eV时具有较弱的还原峰.PCFs-0.5与PCFs-1.0表现出较高的还原能力,还原峰强度及起始电位明显提高,而 PCFs-2.0与PCFs-4.0还原能力又大幅度降低.结果表明,PCFs-0.5与PCFs-1.0具有最高的ORR活性,原因在于其具有丰富的孔道结构,N掺杂提高活化氧气的能力[15-16].因此,可以预期,这两个材料在电产 H2O2过程中将具有较好的性能.需要说明的是,图中 PCFs-2.0的循环伏安曲线是重复实验10次的曲线,与第1次实验基本重合,说明PCFs-2.0材料尽管尚含有一定量的铁元素(ICP表征结果),但是这部分铁被碳材料包裹镶嵌,在循环伏安实验中不会参与反应,不影响循环伏安曲线.
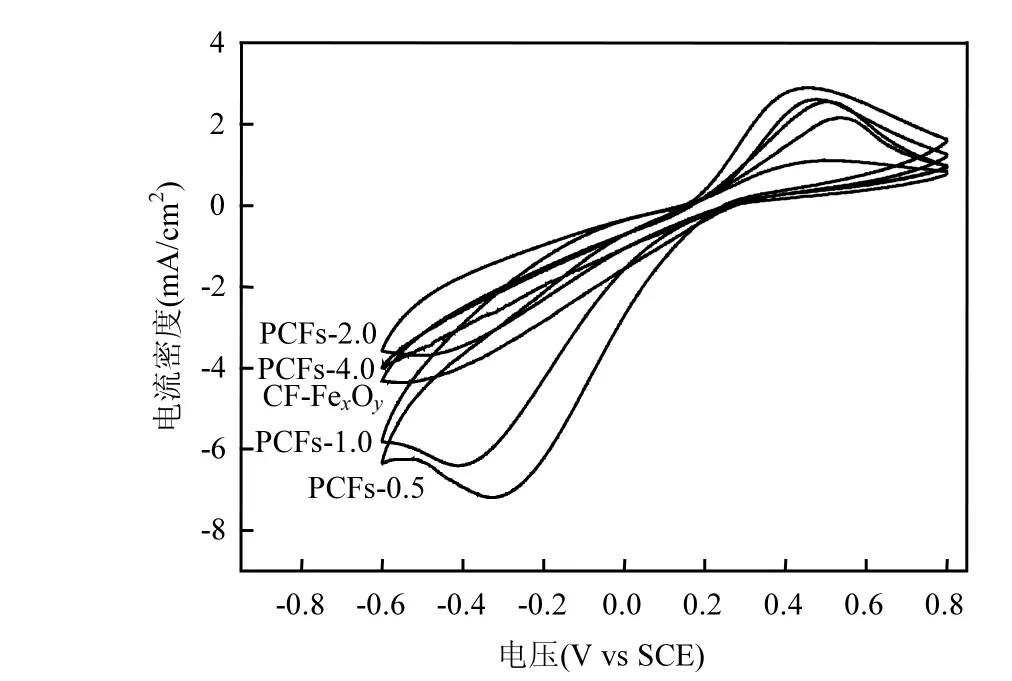
图4 PCFs-x的CV曲线Fig.4 Cyclic Voltammetry of PCFs-x
2.3.2 电子转移数测定 通过图 5的 LSV曲线及K-L公式可以计算出,所制备的 PCFs-1.0材料在ORR反应生成 H2O2的电子转移数 n为 2.4.表明PCFs-1.0生成双氧水时具有较高的选择性,发生ORR反应时主要通过2电子还原途径生成了双氧水,很小部分发生了非预期的4电子还原的副反应.

图5 PCFs-1.0的LSV扫描曲线及K-L方程Fig.5 LSV curve and the corresponding K-L image of PCFs-1.0
2.4 PCFs-x的电产双氧水性能
从图6a可以看出,CF-FexOy用于电产H2O2,反应150min后H2O2的累积浓度达到56mg/L,随硝酸浓度的增加,电产 H2O2的累积浓度呈现先增加后减小的趋势,PCFs-1的性能最佳,因其有理想的碳纤维多孔结构及适度的氮掺杂量,其两电子的 ORR反应活性最高,150min后H2O2的累积浓度达到148.81mg/L,而PCFs-4的性能最差,相同实验条件下H2O2的累积浓度只有45.6mg/L.

图6 PCFs-x性能比较Fig.6 Performance comparison between PCFs-x
由图 6b可见,PCFs-x的电流效率呈现与电产H2O2累积浓度相似的规律,即,随硝酸浓度的增加,电产 H2O2的电流效率呈现先增加后减小的趋势,PCFs-1的电流效率最高,PCFs-4的效率最差.
为体现所制备材料的电产 H2O2的性能优势,将所制备的碳纤维材料的H2O2累积浓度、电流效率与相关文献数据进行比较.由表4可见,在相近的实验条件下,PCFs-1具有比文献报道的碳材料更高的 H2O2累积浓度与电流效率,表现出优良的电产H2O2性能.
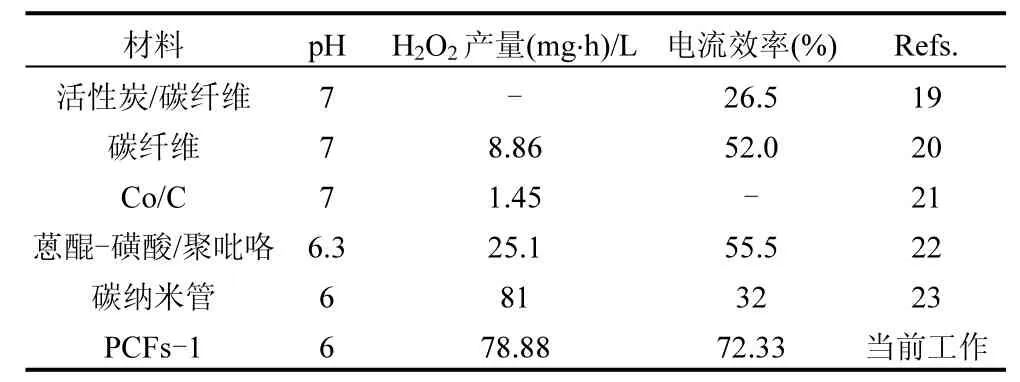
表4 PCFs-1与文献报道材料的电产H2O2性能比较Table 4 Performance comparison between the materials reported and the present work
4 结论
4.1 基于生物质胶原纤维制备 PCFs-x(PCFs-x),利用胶原纤维对金属离子的反应特性,实现均匀负载铁离子,并且经过高温碳化及后续硝酸酸浸处理达到碳纤维的造孔效果;
4.2 利用胶原纤维分子自身的-NH2实现碳元素的自掺杂.硝酸浓度对于碳纤维的结构及电产 H2O2性能具有重要的影响,1mol/L酸浸所获得的碳纤维PCFs-1表现出最优的电化学产H2O2性能,因为其具有利于导电的碳纤维状、丰富的孔结构、适当的氮掺杂量.与文献报道的碳材料相比,在 H2O2累积浓度与电流效率两个指标上,表现出更高的性能.
