加味补阳还五颗粒对脑梗死大鼠HMGB1/RAGE信号通路的影响*
2018-07-26何林全刘家云屈园利刘西涛李晓东
何林全 刘家云 屈园利 刘西涛 李晓东 龙 铟△
(1.空军军医大学第一附属医院,陕西 西安 710032;2.武警新疆总队克拉玛依市支队卫生队,新疆 克拉玛依 834000)
脑卒中,又称“中风”,是一种急性脑血管疾病。流行病学调查显示,脑卒中已成为我国第一大致死性疾病,同时也是全球第2大致死性疾病[1]。缺血性脑卒中(即脑梗死)的发病机制比较复杂,包括免疫炎性反应、细胞凋亡、能量衰竭和兴奋性氨基酸细胞毒性作用、半暗带去极化等。其中,急性脑梗死后触发的免疫炎性瀑布反应扮演着重要角色[2]。研究表明,在脑梗死早期,高迁移率族蛋白B1(HMGB1)可大量释放到细胞外并与晚期糖基化终末产物受体(RAGE)结合,促进炎性细胞的趋化作用,并通过激活促炎因子如核转录因子-κB(NF-κB)等诱导炎性反应[3]。 HMGB1/RAGE 信号通路在脑梗死引起神经细胞死亡中的作用已经成为目前研究的热点。中医学把脑梗死归于 “中风”“卒中”“偏枯”范畴[4]。气虚血瘀是脑梗死的重要病机,治法以益气活血,方药选用补阳还五汤。补阳还五汤由黄芪、当归、赤芍、地龙、川芎、桃仁和红花组成,是目前治疗中风应用频率最高的经典名方[5]。本文通信作者龙铟副教授结合多年临床经验对此方进行化裁,减去桃仁、红花,加丹参、茯苓、陈皮,天麻、杜仲,并采用免煎颗粒剂,临床用于治疗脑梗死已取得较好的疗效。本研究意在探讨加味补阳还五颗粒对脑梗死大鼠HMGB1/RAGE信号通路的影响。
1 材料与方法
1.1 实验动物 90只健康无特定病原体(SPF)级雄性SD大鼠,体质量(200±20)g,购自空军军医大学动物实验中心,生产批号:SCXK(军)2012-0007。
1.2 实验药物 加味补阳还五颗粒(组成:黄芪6.0 g,当归 3.0 g,川芎 1.3 g,赤芍 2.0 g,丹参 1.8 g,地龙 1.0 g,茯苓 0.5 g,陈皮 1.0 g,杜仲 0.7 g,天麻 2.0 g),每剂中药颗粒剂含药量19.3g,依据成人与大鼠体表面积换算(成人体质量按 60 kg 计算):19.3/60×6.25=2.01 g/kg。因此,以2.01 g/kg为中等剂量,倍之即4.02 g/kg为高剂量,减半即1.0 g/kg为低剂量。使用时应使用沸水冲化,充分搅拌,待至温时服用,均配制成1 mL药液。使用广东一方制药有限公司生产的免煎颗粒剂。尼莫地平(正大青春宝药业有限公司生产,批号H33022285,规格 20 mg/kg)。
1.3 试剂与仪器 HMGB1特异性抑制剂:重组大鼠HMGB1-A box蛋白由前期实验合成。RAGE特异性阻断剂:FPS-ZM1购自Selleck上海蓝木化工有限公司,批号:S8185010001001。HMGB1和RAGE ELASA试剂盒购自南京建成生物技术有限公司,批号:20170315。一抗:兔多克隆抗体Anti-HMGB1购自Abcam(ab18256)公司,批号:GR290497-2。内参抗体:Anti-β-Actin 鼠单克隆抗体购自Sigma公司。二抗:IRDye 800CW山羊抗兔抗体购自 Rockland公司,批号:C10324-01。IRDye 680山羊抗鼠抗体购自Rockland公司,批号:B50908-02。 封闭液(Odyssey Blocking buffer)购自 LICOR公司,批号:X0022。高速低温离心机,BIORIDGE,型号TGL-30M。双色红外激光成像系统,Odyssey公司,型号 X09A014362。 半干转膜仪,Invitrogen,型号Y12B035513。 超声粉碎机,SONICS,型号 VCX130。 干湿恒温器,杭州奥盛仪器有限公司,型号K10CD。
1.4 模型制备 采用线栓法制备大鼠大脑中动脉缺血模型(MCAO)[6]。12%水合氯醛,3 mL/kg 腹腔注射麻醉,成功后采用颈正中切口,钝性分离皮下组织,充分暴露右侧颈总动脉及颈外动脉,用血管夹夹闭右侧颈总动脉。采用线栓法经右侧颈外动脉-颈内动脉入路,至大脑中动脉入口处,固定线栓。2 h后拔去线栓,结扎右侧颈外动脉,开放右侧颈总动脉。神经功能缺损评分参考Longa五级四分法,1~3分为有效模型。假手术组不进行线栓栓塞,仅进行颈部皮下组织的钝性分离,以及皮肤缝合及消毒。剔除死亡、评分为0分和未麻醉成功的大鼠。
1.5 分组及干预方法 健康雄性SD大鼠90只,按体质量用数字表法随机分为正常组、假手术组、模型组、加味补阳还五颗粒低剂量组(1 g/kg)、加味补阳还五颗粒中剂量组(2.01 g/kg)、加味补阳还五颗粒高剂量组(4.02 g/kg)、HMGB1 抑制剂组 (GST-A,500 μg/只,腹腔注射)、RAGE 阻断剂组(FPS-ZM1,1.0 mg/kg,腹腔注射)、阳性药物组(尼莫地平,12.5 mg/kg)各10只。平衡饲养,加味补阳还五颗粒高、中、低剂量组分别按以上给药剂量,用煮沸蒸馏水充分溶解,待晾至室温后配制成等体积的药液,于造模前连续灌胃10 d,每日1剂,分两次灌胃给药。其余各组均给予同上等体积的蒸馏水灌胃10 d。造模成功后,加味补阳还五颗粒高、中、低剂量组、RAGE阻断剂组、HMGB1抑制剂组、阳性药物组按给药剂量连续给药2 d;正常组、假手术组和模型组给予蒸馏水灌胃2 d。以上各组给药体积相同。为保证最终实验结果统计需要适当增加大鼠造模数量。剔除造模及给药过程中死亡的大鼠,使最终每组大鼠数量为10只。
1.6 标本采集与检测 1)HMGB1、RAGE含量检测。造模后第3天,以12%水合氯醛3 mL/kg腹腔注射麻醉大鼠,经腹主动脉采血。血标本于室温放置20 min,3000 r/min离心15 min后取上清,于-80℃保存待用。ELISA法检测血清中HMGB1、RAGE含量,方法参照南京建成生物技术有限公司提供的酶联免疫检测试剂盒使用说明书。2)脑组织HMGB1/β-actin表达检测。采血后立即开颅取脑,置于冰生理盐水中5 min。切取梗死区脑组织并称重,置于研钵中,加入适量冰PBS充分研磨,制成10%的混悬液。4℃、8000 r/min离心10 min。取上清,用0.22 μm过滤器过滤,置干净的EP管中。各取 50 μL上清,分别加入 12.5 μL 5×蛋白上样缓冲液,100℃水浴10 min,完成后迅速放入冰盒中冷却 3 min。将 6 μL 蛋白 marker,20 μL 蛋白样品依次加入电泳槽中,初始电压为90 V,20 min。待marker和样品压缩为一条直线后,将电压设定为120 V,60 min。待marker各条带到达合适位置时终止电泳。电泳完毕后,将胶小心取下,放入干净的平底玻璃皿中,切除压缩胶,将分离胶裁剪至合适大小。采用半干转印法,按照滤纸-胶-膜-滤纸的顺序依次放置在半干转膜仪中,23 V,8 min。将硝酸纤维素膜小心裁剪至合适大小,小心取下,放置在盛有适量封闭液的容器中,室温于水平摇床60 r/min、2 h。加入兔抗HMGB1多克隆抗体(1∶10000)、Anti-β-Actin 鼠单克隆抗体(1∶5000),4℃冰箱中过夜;加入IRDye 800CW山羊抗兔荧光二抗(1∶10000)、IRDye 680 山羊抗鼠荧光二抗 (1∶10000),室温于水平摇床72 r/min孵育1 h;充分洗涤后,利用Odyssey双红外激光成像系统分别扫描胶与硝酸纤维素膜,采集图像。
1.7 统计学处理 应用SPSS13.0统计软件。计量资料以(±s)表示,采用非参数检验,组间多重比较采用Nemenyi检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠血清HMGB1、RAGE水平比较 见表1。模型组大鼠血清中HMGB1水平高于其他组,各给药组大鼠血清中HMGB1水平较假手术组有下降趋势。其中模型组大鼠血清中HMGB1水平明显高于正常组(P<0.05);加味补阳还五颗粒中剂量组、阳性药物组与模型组存在明显差异(P<0.05)。以上结果说明模型构建成功,中等剂量加味补阳还五颗粒可降低造模后大鼠血清中的HMGB1水平。对照组大鼠血清中RAGE水平高于其他组,各给药组大鼠血清中RAGE水平较模型组有下降趋势。其中模型组与正常组存在明显差异(P<0.01);加味补阳还五颗粒中剂量组、阳性药物组与模型组存在明显差异(P<0.05)。以上结果说明模型构建成功,中等剂量加味补阳还五颗粒可降低造模后大鼠血清中的RAGE水平。
表 1 各组大鼠血清 HMGB1、RAGE水平比较(ng/mL,±s)
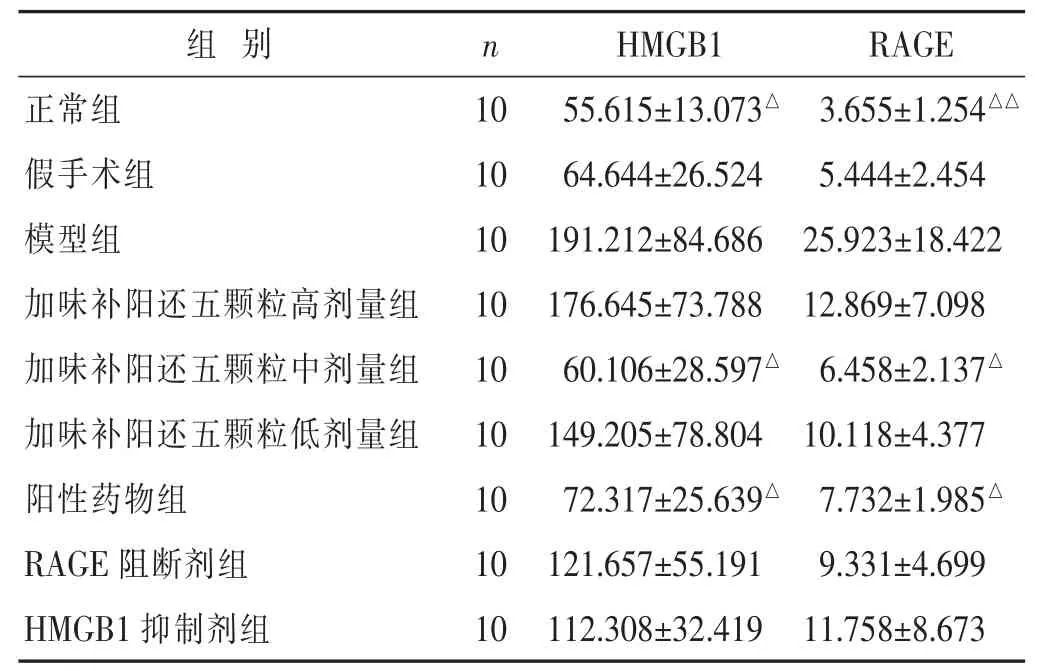
表 1 各组大鼠血清 HMGB1、RAGE水平比较(ng/mL,±s)
与模型组比较,△P<0.05,△△P<0.01。 下同
?
2.2 各组Western blotting结果比较 见表2,图1。对照组HMGB1/β-Actin对照比值明显高于正常组,差异明显(P<0.05);各给药组 HMGB1/β-Actin 灰度比值较模型组有下降趋势,差异明显,其中HMGB1抑制剂组与模型组存在明显差异(P<0.05),加味补阳还五颗粒中剂量组、阳性药物组与模型组存在明显差异(P<0.01)。以上结果说明模型构建成功,中等剂量加味补阳还五颗粒可降低造模后大鼠梗死区脑组织中HMGB1表达水平。
表2 各组大鼠脑组织HMGB1/β-actin表达比较(灰度值,±s)

表2 各组大鼠脑组织HMGB1/β-actin表达比较(灰度值,±s)
?

图1 各组大鼠脑梗死区组织Western Blotting结果
3 讨 论
综观本病,患者由于脏腑功能失和,气血素虚或痰浊、瘀血内生,导致瘀血阻滞、痰热内蕴,或阳化风动、血随气逆,引起脑脉痹阻,从而出现昏仆不遂,发为中风。往往因内因、外邪、情志不畅等而诱发。中风病病位在脑,与五脏密切相关。其病机有虚、火、风、痰、气逆、血瘀,多相互交织而复杂多变。病性多为本虚标实,上盛下虚。而其基本病机为气血逆乱,上犯于脑,脑之神明失用[7]。
治疗中风如无明显的标急现象,则往往二陈汤与四物汤同用,标本兼治,化痰不致伤阴,养血不致滋腻。晚清及近代医家张伯龙、张山雷、张寿甫等人结合西医理论,发现中风病主要发生于年老体衰之人,此时肝肾不足,水不涵木,肝阳化风,气血并逆,直冲犯脑。本研究的加味补阳还五颗粒是本文通信作者龙铟副教授根据以上名家理论,在补阳还五汤原方基础上减去桃仁、红花,加丹参、茯苓、陈皮,天麻、杜仲,并采用免煎颗粒剂而组成,既能补气活血、化痰通络,还能平肝息风。
补阳还五汤治疗脑梗死的机制主要表现在两个方面:脑保护作用及促进神经功能恢复。研究表明,补阳还五汤通过抑制与炎症及细胞凋亡相关的基因的表达[8],从而有效抑制脑梗死患者血清中 hs-CRP、IL-1β和MMP-9等炎性因子的释放,进而明显降低急性脑梗死患者血清IL-1β、IL-6及IL-18表达水平,从而有效抑制炎性反应,进而保护脑组织[9-10];可明显降低表达细胞周期蛋白,从而通过调节细胞周期信号通路发挥脑保护作用[11];能够通过抑制脑缺血/再灌注引起的促代谢性谷氨酸受体-5的表达,增加垂体腺苷酸环化酶激活肽(PACAP-38)的表达,从而显著增加谷氨酸转运蛋白1和和谷氨酰胺合成酶的表达,以此抑制兴奋性神经毒性,发挥脑保护作用[12-13]。研究表明,补阳还五汤能够激活内源性神经干细胞及抑制轴突生长抑制蛋白[14];能够明显上调双皮质素的表达,以增加细胞衍生因子和脑源性神经营养因子mRNA及蛋白的表达,从而促进神经干细胞从室管膜下层迁移[13,15];能够增加脑源性神经营养因子和血管内皮生长因子蛋白表达,明显增加脑梗死大鼠神经形成,促进脑梗死大鼠神经功能的恢复[16]。
本研究观察加味补阳还五颗粒对脑梗死大鼠的脑保护作用,特别是对HMGB1/RAGE信号轴的影响。通过构建MCAO大鼠模型,以血清和脑组织中HMGB1和RAGE表达水平作为观察指标;设置阴性对照组即模型组,阳性药物对照组即尼莫地平组,RAGE阻断剂组、HMGB1抑制剂组,分别从HMGB1和RAGE表达水平两个方面验证加味补阳还五颗粒对HMGB1/RAGE信号轴的影响;设置加味补阳还五颗粒高剂量组,加味补阳还五颗粒中剂量组,加味补阳还五颗粒低剂量组,进一步明确剂量与预后的关系。
本研究于造模第3天采血,ELISA结果显示模型组大鼠血清中HMGB1、RAGE含量明显高于其他组,可见在缺血性脑梗死急性期,HMGB1、RAGE表达水平是升高的。大鼠梗死区脑组织Western blotting结果显示,模型组HMGB1表达水平明显高于其他组,说明HMGB1及其信号通路参与了脑梗死后的炎症反应过程。ELISA和Western blotting结果中,加味补阳还五颗粒中剂量组HMGB1、RAGE表达水平均较模型组有显著差异,然而加味补阳还五颗粒高剂量组和加味补阳还五颗粒低剂量组与模型组比较,无显著差异,说明中等剂量的加味补阳还五颗粒可明显影响脑梗死大鼠的预后。中等剂量的加味补阳还五颗粒,折合人体剂量后每味药剂量如下:其中黄芪30 g,当归10 g,川芎6 g,赤芍 10 g,丹参 10 g,地龙 10 g,茯苓 10 g,陈皮 6 g,杜仲10 g,天麻10 g。成人每日1剂,分2次服用。
综上所述,中等剂量的加味补阳还五颗粒可能是最佳治疗剂量。加味补阳还五颗粒可能通过调控脑梗死大鼠HMGB1/RAGE信号通路而发挥脑保护作用。下一步我们将继续探讨HMGB1/RAGE信号通路对HMGB1/RAGE信号通路上下游分子的影响,进一步阐明加味补阳还五颗粒影响HMGB1/RAGE信号通路相关机制。
