DCE-MRI参考区域模型联合DWI对luminal型乳腺癌的应用研究
2018-07-25杨培常晓丹付姣慧汪帝
杨培, 常晓丹, 付姣慧, 汪帝
乳腺癌是女性最常见的恶性肿瘤,近年来发病率逐年升高,且发病年龄趋于年轻化[1]。不同分子亚型乳腺癌的预后及对放化疗的敏感性均存在显著差异,目前,基于对雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)和Ki-67增殖指数表达状态的免疫组织化学染色分类方法将其分为luminal型、HER-2过表达型和三阴性乳腺癌[2],其中,luminal型乳腺癌是最常见的亚型(约70%),临床上依据2013年St.Gallen共识将luminal型乳腺癌分为Luminal-A型乳腺癌(Luminal-A breast cancer,LABC)及Luminal-B型乳腺癌(Luminal-B breast cancer, LBBC),而两者在临床特点、治疗方式及预后方面均存在显著差异[3]。LABC对化疗敏感性低,但对内分泌治疗敏感;而LBBC对化疗及内分泌治疗均敏感[4],且Ki-67增殖指数越高的乳腺癌对化疗越敏感[5]。因此,在术前或化疗前准确判断luminal型乳腺癌的分型对其治疗方案的选择至关重要。
目前,临床上最常用的乳腺MRI检查方法是半定量动态增强MRI(dynamic contrast enhanced MRI,DCE-MRI),但不能反映病变及正常组织对比剂浓度的变化[6]。而DCE-MRI参考区域模型通过药代动力学模型定量计算具有生理学意义的定量参数,最终反映组织血管生成的程度[7];此外,扩散加权成像(diffusion weighted imaging,DWI)还可以反映组织微观结构特征及其变化[8]。已有研究表明,联合DCE-MRI和DWI较两者单独使用对乳腺病变良恶性的诊断准确性更高[9],但对于乳腺癌分子分型鉴别诊断的研究甚少。因此,本文联合DCE-MRI参考区域模型和DWI,探讨其对LABC和LBBC的鉴别诊断价值,并分析其定量参数与生物标志物Ki-67表达的相关性,为luminal型乳腺癌患者的早期诊断和治疗方案的确定提供影像学依据。
材料与方法
1.研究对象
回顾性分析大连大学附属中山医院2016年12月-2017年6月的102例经术后病理证实的luminal型乳腺癌患者,所有患者均满足:①术前均行DCE-MRI及DWI检查;②术后行免疫组化检测并获得免疫组化指标。排除标准:①行穿刺活检病理证实;②DCE-MRI及DWI扫描后数据获取失败或数据不全者;③怀孕期或哺乳期患者;④之前接受过乳腺癌治疗的患者。1例双乳单发病灶及3例单乳多发病灶,只纳入体积最大的病灶。最终77例女性患者的77个病灶纳入研究,患者年龄28~82岁,平均(53.74±11.88)岁。
2.检查设备及方法
采用Siemens 3.0T Magnetom Verio超导MRI扫描仪,16通道乳腺专用相控阵表面线圈。患者取俯卧位,双侧乳房自然悬垂于线圈内。常规横轴面、冠状面、矢状面定位扫描后,先采集横轴面T2WI脂肪抑制序列:TR 4000 ms,TE 70 ms,矩阵192×192,视野360 mm×360 mm,层厚5 mm,间距2 mm;横轴面T1WI脂肪抑制序列:TR 6 ms,TE 2.36 ms,矩阵192×192,视野360 mm×360 mm,层厚1.2 mm,间距1 mm。采集DWI,使用扩散加权平面回波成像(EPI)序列,TR 8300 ms, TE 85 ms,矩阵192×192,视野360 mm×360 mm,层厚5 mm,间距2 mm,采集b值为0和800 s/mm2。最后采集多期动态扫描序列DCE-MRI,先采集多翻转角图像,包括2°、15°,以获得T1原始图。采集动态序列,先采集2期平扫图像,然后注入钆双胺注射液欧乃影,剂量0.1 mmol/kg,注射流率3 mL/s,随后以同样流率注入20 mL生理盐水。参数:TR 4.14 ms,TE 1.42 ms,矩阵320×192,视野360 mm×360 mm,层厚1 mm,间距0.2 mm,翻转角10°。动态增强共11期图像,每期约28 s。
3.图像后处理及分析
由两名经验丰富的放射科副主任医师采用盲法对所有图像进行评估,意见不一致时,由第3名主任医师来评估。将所有患者的多翻转角和动态增强图像导入Omni-Kinetics软件进行后处理。结合T2WI、DWI及DCE-MRI图像明确病灶位置,取病灶最大层面及其上、下两个层面,避开囊变坏死区、血管及脂肪等结构,尽量包含病变强化最明显区域,勾画兴趣区(region of interest,ROI),取3个层面的平均值行统计学分析。以病灶兴趣区层面的对侧胸大肌获得动脉输入函数,呈不规则形[10],面积19~21 mm2(图1a),运用“参考区域模型”作为药代动力学模型,计算各病灶相对于肌肉组织的Ktrans和Kep等参数。
在DWI序列中评估ADC值,确定信号强度高于正常乳腺组织的病灶后,选取病灶最大层面及其邻近两个层面,手动绘制椭圆形或圆形ROI,避开囊变、坏死区,尽可能包含病灶,以三个层面的平均值作为最终的ADC值。
4.病理学分析
所有患者均手术切除乳腺癌,行前哨淋巴结活检和/或腋窝淋巴结清扫,通过常规HE染色镜检评估淋巴结有无转移。参照手术切除标本测定肿瘤大小、组织类型、腋窝淋巴结状态。运用SP法染色行免疫组化,检测ER、PR、HER-2及Ki-67的表达状态。判断标准:①ER和PR阳性肿瘤细胞核达到或超过1%为阳性,反之为阴性[11];②HER-2,染色强度评分记为0、1+、2+或3+。其中0或1+被认为是HER-2阴性,3+被认为是HER-2阳性,评分为2+的患者,进一步行荧光原位杂交(fluorescence in situ hybridization,FISH)检测,基因扩增者为阳性,无基因扩增者为阴性;③Ki-67的表达,随机选择10个高倍视野,计数500个以上细胞的细胞核着色判断为阳性,计算阳性细胞所占比例即为Ki-67增殖指数。
5.统计学分析
运用SPSS 20.0软件行统计学分析。定性资料采用卡方检验或Fisher确切概率法。定量资料运用Kolmoforov-Smirnov检验是否服从正态分布;正态分布的两两比较采用两独立样本t检验,非正态分布的两两比较采用Mann-Whitney U检验。采用Spearman相关分析评价DCE-MRI全定量参数及ADC值与Ki-67阳性表达率的相关性。根据受试者操作特征(receiver operating characteristic,ROC)曲线评估各定量参数的最佳阈值及曲线下面积(area under curve,AUC)。以P<0.05为差异有统计学意义。
结 果
1.LABC与LBBC的临床病理特征
纳入的77个病灶Ki-67增殖指数为1%~80%,30例为LABC,47例为LBBC,LBBC的阳性淋巴结转移高于LABC(P=0.002)。两组间年龄、月经状态、肿瘤直径及病理类型差异无统计学意义(表1)。
2.LABC与LBBC两组间定量参数的比较
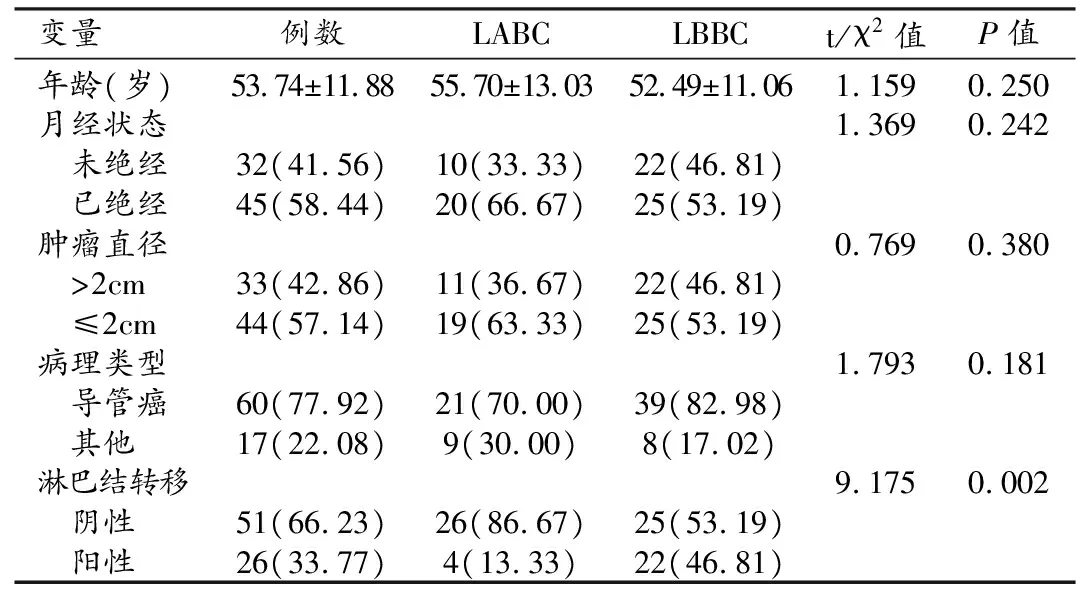
表1 LABC与LBBC的临床病理特征
LBBC平均Ktrans值明显高于LABC(P=0.002),平均ADC值明显低于LABC(P=0.000),两组间Kep差异无统计学意义(P=0.875,表2,图 1、2)。

表2 LABC与LBBC间DCE-MRI定量参数及ADC值的比较
3.Ktrans值、Kep值及ADC值与Ki-67增值指数的相关性
本研究77例Luminal型乳腺癌中,Ktrans值与Ki-67表达呈正相关(r=0.369,P=0.001),ADC值与Ki-67表达呈负相关(r=-0.465,P<0.0001),Kep值与Ki-67表达无相关性(P=0.392,图 3、4)。
4.Ktrans值和ADC值对Luminal型乳腺癌的鉴别诊断效能
ROC曲线分析显示,鉴别LABC和LBBC的Ktrans和ADC最佳阈值分别为0.724/min(敏感度74.5%、特异度63.3%、AUC=0.689、P=0.005)和0.853×10-3mm2/s(敏感度63.3%、特异度76.6%、AUC=0.741、P=0.000);联合Ktrans和ADC值的敏感度为71.0%、特异度为71.0%、AUC=0.777、P=0.000(表3、图 5)。

表3 联合ADC值对Luminal型乳腺癌的鉴别诊断效能
讨 论
本研究结果显示,LBBC比LABC更易出现腋窝淋巴结转移,与王学丽等[12]报道一致,淋巴结转移率高的乳腺癌预后较差,这可以为LBBC预后较LABC差提供依据。两组间年龄、月经状态、肿瘤直径、病理类型等无明显差异,与刘钟芬等[13]研究结果一致。

图1 女,53岁,左乳浸润性导管癌,ER、PR阳性,HER-2阴性,Ki-67表达10%。a) 横轴面DCE-MRI图; b) 为a图同层面处理后的Ktrans,病灶Ktrans=0.631/min; c) 为a图同层面处理后的Kep图,病灶Kep=0.171/min; d) ADC图,ADC=0.968×10-3mm2/s。 图2 女,47岁,右乳浸润性导管癌, ER、PR阳性,HER-2阴性,Ki-67表达35%。a) 横轴面DCE-MRI图; b) 为a图同层面处理后的Ktrans图,病灶Ktrans=1.102/min; c) 为a图同层面处理后的Kep图,病灶Kep=0.012/min; d) 为ADC图,ADC=0.723×10-3mm2/s。

图3 Ktrans值与Ki-67的相关性。 图4 ADC值与Ki-67的相关性。
乳腺癌是一种血管依赖性肿瘤,其生长、增殖、代谢和转移离不开肿瘤血管生成。全定量DCE-MRI可动态测定血管内外对比剂浓度的变化,衍生全定量灌注参数Ktrans和Kep,从而定量评价肿瘤血流灌注情况,更能准确反映肿瘤血管生成情况[14]。李丽环等[15]发现,LABC与LBBC的Ktrans值和Kep值差异无统计学意义,而本研究结果显示,LBBC患者Ktrans值高于LABC,差异有统计学意义,Kep值差异无统计学意义,推测其结果不一致的原因可能是药代动力学模型的选择不同[10]。此外,在本研究中,luminal型乳腺癌Ktrans值与Ki-67增殖指数呈正相关,而Kep值与Ki-67增殖指数无明显相关性,这与Shin等[16]研究结果类似。全定量参数Ktrans值反映肿瘤血管通透性和血管密度,Ki-67是一种核增殖抗原,反映细胞的增殖活性。乳腺癌中Ki-67表达状态与血管内皮生长因子(VEGF)受体2之间存在显著相关性,它在肿瘤血管生成中起重要作用,并诱导血管通透性升高[17],且Ki-67增殖指数越高的乳腺癌,肿瘤的微血管密度越大[18],表现出较高的血管生成活性和血管通透性,因此Ktrans值大,而Kep仅反映血管渗透性,提示Ktrans值对鉴别LABC与LBBC具有一定参考价值。本研究中Ktrans值鉴别诊断LABC与LBBC的AUC为0.689,敏感度、特异度分别为74.5%、63.3%,表明Ktrans值有一定诊断效能。

图5 Ktrans值、ADC值及Ktrans联合ADC值对luminal型乳腺癌诊断价值的ROC曲线。
DWI是一种检测活体组织内水分子扩散运动的非侵入性功能成像方法,能够间接反映组织的微观结构特征及其变化,其量化参数ADC值可定量评估局部组织变化及肿瘤的生物学特性[19]。国内外已有许多ADC值与乳腺癌生物学特性的相关研究[20-23],对于luminal型乳腺癌,谢宗玉等[21]认为ADC值无法鉴别LABC与LBBC,而Kato等[22]的研究显示LABC的最小ADC值显著高于LBBC,但该研究仅包括25例LBBC。本研究结果显示LABC患者ADC值高于LBBC,且ADC值与Ki-67表达呈负相关,与Mori等[23]报道一致。这可能是由于Ki-67表达越高,细胞增殖活性更强,细胞密度高,使细胞外容积减少,水分子扩散受限,导致ADC值降低。笔者通过ROC曲线分析,为ADC值鉴别诊断luminal型乳腺癌提供依据,结果显示AUC为0.741,敏感度和特异度分别为63.3%和76.6%,说明ADC值对luminal型乳腺癌有一定的鉴别诊断价值。
考虑到Ktrans值鉴别luminal型乳腺癌的敏感度高,但特异度低;而ADC值鉴别luminal型乳腺癌敏感度低,特异度高,因此本研究将Ktrans值和ADC值二者联合,显示敏感度、特异度分别为71.0%、71.0%,AUC为0.777,高于单独使用ADC值或Ktrans值的诊断水平,DCE-MRI联合DWI除了提供肿瘤的形态学特征外,还能显示肿瘤内部血管生成的程度和肿瘤微观结构的变化,更准确地反映肿瘤的整体特征,为luminal型乳腺癌提供了更多的定性、定量数据。
本研究不足之处在于: 本研究为回顾性研究,且样本量较小,无法避免选择偏倚;未来的研究将增大样本量,来探讨Ktrans值或ADC值是否与Ki-67增值指数独立相关; 本研究只着重于luminal型乳腺癌的灌注和扩散特征,没有探讨定量MRI参数与临床预后的相关性,高Ki-67增值指数与预后不良有关[24],进一步的研究将探讨定量MRI参数与临床预后的相关性; 本研究ROI为手动勾画,存在一定的主观性; 未将DCE-MRI参考区域模型与不同模型的定量MRI参数比较,有待进一步研究。
综上所述,Ktrans值及ADC值与Ki-67表达有明显相关性;DCE-MRI参考区域模型(Ktrans值)和DWI(ADC值)对LABC和LBBC有较高的鉴别诊断价值,联合Ktrans值与ADC值可进一步提高诊断效能,有助于luminal型乳腺癌患者的早期诊断和治疗。
