含离子液体二元体系气液相平衡数据的测定与关联
2018-07-25张志刚方荣丽张亲亲吴开放李文秀
张志刚, 程 晟, 方荣丽, 张亲亲, 吴开放, 李文秀
(沈阳化工大学 化学工程学院, 辽宁 沈阳 110142)
在现代化学工业中,原料的精制、中间产物的分离、产品的提纯以及工业排放物的回收和处理都离不开化工分离技术[1].但很多混合物常压下会形成共沸物,难以用普通精馏方法进行分离.萃取精馏以其分离效果好、操作简单、生产能力高的优点成为分离共沸物或近沸物常用的方法[2-4].但是,它也存在着许多有待进一步研究解决的问题,如:常规有机溶剂易挥发、对环境易造成污染、溶剂使用量大且能耗较高;无机盐易腐蚀设备、分离回收复杂.这些不足极大地阻碍了萃取精馏的发展.
离子液体作为一种新型的绿色化学品有着其独特的物理化学性质[5-7],如:较宽的液态范围、无可测蒸汽压、可调控的物化性能、较宽的电化学窗口等.这些特殊性能使得离子液体受到越来越广泛的关注,并且应用于较难分离的物系[8-10].离子液体作为新型萃取剂融合了有机溶剂与无机盐的优势(易操作、高选择性),在萃取精馏方面表现出了巨大的潜力,为萃取精馏带来了新的发展前景[11].
乙酸甲酯和甲醇均为重要的化工原料,然而二者在常压下会产生共沸现象,常规的精馏方法无法得到高纯度的产品[12-13].相平衡数据是采用萃取精馏分离方法分离乙酸甲酯-甲醇共沸物系的基础.然而,含离子液体体系的相平衡数据目前较为匮乏.本文测定了3种离子液体[1-己基-3-甲基咪唑氯盐([HMIM][Cl])、1-苄基-3-甲基咪唑氯盐([BzMIM][Cl])和1-己基-3-甲基咪唑溴盐([HMIM][Br])]分别与乙酸甲酯、甲醇的二元气液相平衡数据,并且使用NRTL模型方程对实验数据进行关联,以考察该模型是否适用于含离子液体体系的气液相平衡数据的拟合.本文的工作为实现离子液体在萃取精馏领域的应用提供了一定的理论依据.
1 实验部分
1.1 化学品
实验所用化学试剂如表1所示.

表1 化学试剂说明Table 1 Specifications of the chemical samples
注:GCa,气相色谱仪;KFb,卡尔费休水测定仪;LCc,液相色谱仪.
1.2 实验仪器及过程
使用CE-2型单循环气液平衡釜[14]进行离子液体与乙酸甲酯或甲醇的二元等压气液相平衡实验.由气体缓冲装置控制气压在101.3 kPa,偏差为0.1 kPa.平衡温度由石英温度计测定,偏差为0.05 ℃.共沸组分的二元实验数据由气相色谱仪(GC-7890A)测得,气相色谱仪配有一个SP-7800型毛细管柱(长30 m,外径2.5 mm,厚度2.5 μm)和一个FID检测器,载气为N2.分析条件为:进样口温度170 ℃;柱箱温度40 ℃,检测器温度200 ℃.使用电子分析天平(CAV264C-USA)称量样品质量,最小偏差为0.000 1 g.
每种离子液体与乙酸甲酯或甲醇的二元气液相平衡数据实验点都是通过不断向原始试样中添加离子液体得到,其操作步骤如下:将原始试样(乙酸甲酯或甲醇)加入到CE-2型单循环气液平衡釜中,加热到沸腾后,观察温度计示数,若温度保持不变且气相冷凝速率在2~3滴/s,则认为达到平衡,保持2 h后进行取样分析,之后向平衡釜中加入一定量离子液体,重复上述步骤,至得到完整气液相平衡数据.
由于离子液体的不挥发性,气相中全部为挥发性有机物(乙酸甲酯或甲醇),因此,只需测定液相中离子液体与乙酸甲酯或甲醇的含量.采用称重法进行测定,具体步骤为:取已知质量的离子液体+共沸组分的混合物,放入真空干燥箱中干燥24 h(温度:85 ℃,真空度:0.08 MPa).称剩余物的质量,进而求得离子液体和乙酸甲酯或甲醇在液相中的质量分数.
2 结果与讨论
2.1 实验数据
为验证实验中气液平衡釜的可靠性,对设备进行了校核:在平衡釜中进行乙酸甲酯-甲醇二元相平衡实验,得到在本实验条件下乙酸甲酯-甲醇的实验二元相平衡数据.通过与前人的实验数据[15-16]对比,可以看出本研究中得到的二元数据与文献中的数据具有良好的一致性,结果如图1所示.由图1可以看出实验装置是可靠的,可以进行下一步的相平衡实验研究.

图1 101.3 kPa下乙酸甲酯+甲醇二元等压气液平衡数据Fig.1 Comparison of VLE data for the binary system of methyl acetate(1)+ methanol(2)at 101.3 kPa
采用上述的称重法测定了不同离子液体与共沸组分,即乙酸甲酯(1)+[HMIM][Cl](3)、甲醇(2)+[HMIM][Cl](3)、乙酸甲酯(1)+[BzMIM][Cl](3)、甲醇(2)+[BzMIM][Cl](3)、乙酸甲酯(1)+[HMIM][Br](3)和甲醇(2)+[HMIM][Br](3)的二元相平衡数据,实验数据如表2至表7所示.
表2至表7中,x1、x2、x3分别表示的是液相中乙酸甲酯、甲醇、离子液体的摩尔分数.表中的活度系数由如下公式计算:
(1)
由于该实验在101.3 kPa(常压)下进行,因此,将气相近似看成是理想气体,则上述公式可简化为:
(2)
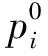
(3)

表2 101.3 kPa下乙酸甲酯(1)+ [HMIM][Cl](3)的二元气液相平衡数据Table 2 Vapor-liquid equilibrium data for temperature t, liquid-phase mole fraction of IL x3,activity coefficient γ for system methyl acetate(1)+ [HMIM][Cl](3) at 101.3 kPa

表3 101.3 kPa下甲醇(2)+ [HMIM][Cl](3)的二元气液相平衡数据Table 3 Vapor-liquid equilibrium data for temperature t,liquid-phase mole fraction of IL x3,activity coefficient γ for system methanol(2)+[HMIM][Cl](3) at 101.3 kPa
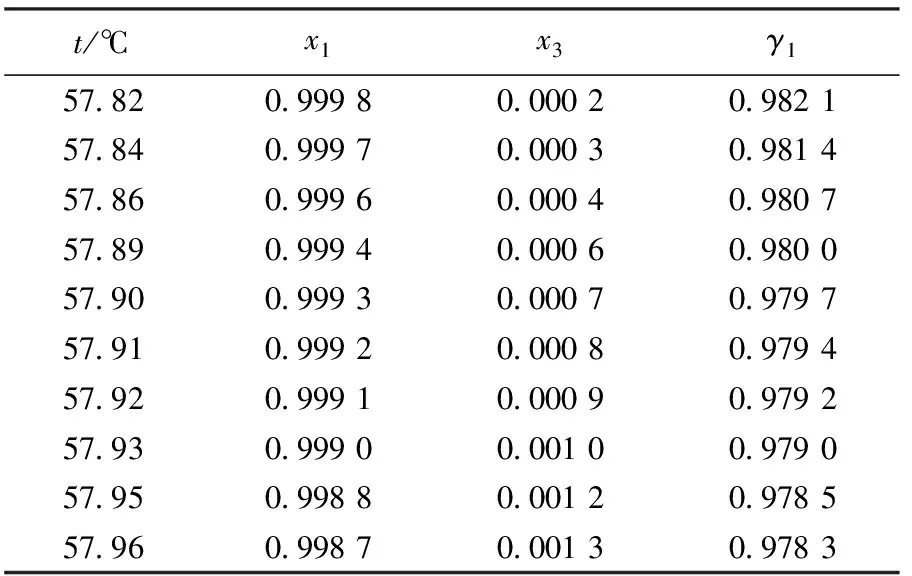
表4 101.3 kPa下乙酸甲酯(1)+ [BzMIM][Cl](3)的二元气液相平衡数据Table 4 Vapor-liquid equilibrium data for temperature t,liquid-phase mole fraction of IL x3,activity coefficient γ for system methyl acetate(1)+[BzMIM][Cl](3) at 101.3 kPa

表5 101.3 kPa下甲醇(2)+ [BzMIM][Cl](3)的二元气液相平衡数据Table 5 Vapor-liquid equilibrium data for temperature t,liquid-phase mole fraction of IL x3,activity coefficient γ for system methanol(2)+[BzMIM][Cl](3) at 101.3 kPa

表6 101.3 kPa下乙酸甲酯(1)+ [HMIM][Br](3)的二元气液相平衡数据Table 6 Vapor-liquid equilibrium data for temperature t,liquid-phase mole fraction of IL x3,activity coefficient γ for system methyl acetate(1)+[HMIM][Br](3) at 101.3 kPa

表7 101.3 kPa下甲醇(2)+ [HMIM][Br](3)的二元气液相平衡数据Table 7 Vapor-liquid equilibrium data for temperature t,liquid-phase mole fraction of IL x3,activity coefficient γ for system methanol(2)+[HMIM][Br](3) at 101.3 kPa

表8 乙酸甲酯和甲醇的安托因参数Table 8 Antoine’s parameters for methyl acetate and methanol
含离子液体体系的活度系数反映的是离子液体与共沸组分之间的相互作用,是含离子液体体系偏离理想溶液的程度,理想溶液的活度系数为1.由上式计算的不同离子液体与乙酸甲酯、甲醇体系的活度系数如表2至表7所示,从表中可以看出:同一种离子液体与乙酸甲酯、甲醇的作用不同,且随着离子液体浓度的提高,体系的温度提高;对于乙酸甲酯+离子液体体系而言,乙酸甲酯的活度系数趋近于1,溶液更趋向于理想性;对于甲醇+离子液体体系而言,甲醇的活度系数均小于1,即离子液体对甲醇有“捆绑”作用,使其挥发性降低,对拉乌尔定律呈负偏差,偏差随着离子液体浓度的增大而增大.
2.2 相平衡计算
非随机双液相(NRTL)活度系数模型是由Renon和Prausnitz[18]在1968年提出.二元物系的NRTL方程如下:
(4)
(5)
其中,τ12=(g12-g22)/RT,G12=exp(-a12τ12),τ21=(g21-g11)/RT,G21=exp(-a12τ21)
γ1和γ2由以上的拉乌尔定律简化式计算可得.关联结果如图2至图7所示.在图2至图7中,x3表示离子液体在液相中的摩尔分数.由图2至7可知:NRTL模型对含3种离子液体的二元气液相平衡都有很好的拟合效果.综上所述,NRTL模型适合关联含离子液体体系的二元气液相平衡数据.

图2 在101.3 kPa下甲醇(2)+ [HMIM][Cl](3)二元体系的x3-γ2关系曲线Fig.2 x3-γ2 diagram for methanol(2)+ [HMIM][Cl](3) at 101.3 kPa

图3 在101.3 kPa下乙酸甲酯(1)+ [HMIM][Cl](3)二元体系的x3-γ1关系曲线Fig.3 x3-γ1 diagram for methyl acetate(1)+ [HMIM][Cl](3) at 101.3 kPa

图4 在101.3 kPa下甲醇(2)+ [BzMIM][Cl](3)二元体系的x3-γ2关系曲线Fig.4 x3-γ2 diagram for methanol(2)+ [BzMIM][Cl](3) at 101.3 kPa

图5 在101.3 kPa下乙酸甲酯(1)+ [BzMIM][Cl](3)二元体系的x3-γ1关系曲线Fig.5 x3-γ1 diagram for methyl acetate(1)+[BzMIM][Cl](3) at 101.3 kPa

图6 在101.3 kPa下甲醇(2)+ [HMIM][Br](3)二元体系的x3-γ2关系曲线Fig.6 x3-γ2 diagram for methanol(2)+ [HMIM][Br](3) at 101.3 kPa

图7 在101.3 kPa下乙酸甲酯(1)+ [HMIM][Br](3)二元体系的x3-γ1关系曲线Fig.7 x3-γ1 diagram for methyl acetate(1)+[HMIM][Br](3) at 101.3 kPa
使用如下目标函数对测得的含离子液体的二元气液平衡数据进行迭代和回归,得到离子液体与乙酸甲酯、甲醇的二元能量交互参数,如表9所示.采用的目标函数为:
(6)
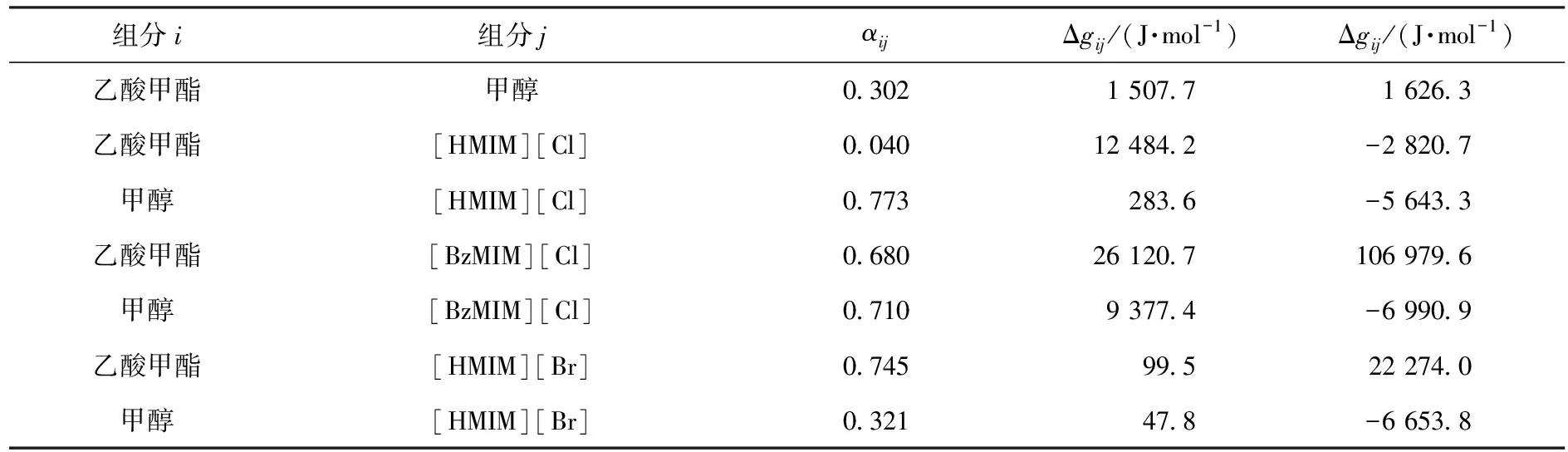
表9 NRTL模型中组分之间的二元能量交互参数Table 9 Nonrandom factor αi,j and binary energy parameter Δgi,j,Δgj,i for the NRTL model
2.3 误差分析
为了定量地评价NRTL模型对含这三种离子液体二元气液相平衡数据的拟合效果,利用已迭代出的模型参数,计算出了平均相对误差,结果如表10所示.

表10 NRTL模型回归平均相对误差Table 10 Mean absolute deviations between calculated data by NRTL model and experimental data
从表10可以看出:含离子液体体系的活度系数的实验值与NRTL模型拟合值的平均相对误差较小,说明NRTL模型适于含离子液体的二元体系相平衡研究.
3 结 论
在101.3 kPa下,测定了乙酸甲酯(1)、甲醇(2)分别与[HMIM][Cl]、[BzMIM][Cl]和[HMIM][Br]的二元气液相平衡数据,并通过NRTL模型与实验数据进行了关联.结果表明:实验值与NRTL模型计算值的误差较小,因此,NRTL模型适用于含离子液体体系的相平衡研究.同时回归出来的能量交互参数为离子液体作为萃取剂用于分离工程提供了一定的理论依据.
符号说明:
x——液相y——气相
Δg——NRTL方程交互作用参数/(J·mol-1)
T——平衡温度/K
上角标
exptl——实验值 calcd——计算值
下角标
i,j——组分变量
1——乙酸甲酯 2——甲醇
3——离子液体
