碳酸镁和氢氧化镁负载顺铂药物及其活性研究
2018-07-25邢家领苏俊琪高恩军
邢家领, 苏俊琪, 高恩军
(沈阳化工大学 应用化学学院 辽宁省无机分子基化学重点实验室, 辽宁 沈阳 110142)
肿瘤是影响人类健康的主要恶性疾病,列人类死亡的第一位[1-2].顺铂作为临床药物对多种肿瘤的治疗具有优良的效果,具有广谱性特点,成为治疗肿瘤患者的一线药物[3].该药物尽管具有优越性,但由于其低溶解性、高肾毒性并伴发恶心呕吐等不良症状,仍需对其结构进一步修饰或采取药物载体改善其不足.目前,就药物载体而言,主要有二氧化硅、环糊精和磁性氧化铁等[4-5].碳酸镁和氢氧化镁作为典型的食药级材料,是基于两种物质合适的粒径尺寸和丰富的比表面积.本文采用化学合成新方法,制备了符合于碳酸镁和氢氧化镁食药级国家标准的两种生物载药材料,通过荧光倒置显微成像技术、流失细胞手段和MTT酶标比色法测定了“载体-顺铂”对细胞的诱导凋亡能力和细胞活性剂量IC50值,通过荧光光谱学手段测定了药物复合体与靶向DNA之间的相互作用,得到了有价值的实验信息.
1 实验部分
1.1 试剂与仪器
实验所需的顺铂由专业药厂提供.菱镁矿石取自辽宁丹东某矿山.硫代亚硫酸钠、硫化钠为AR级试剂.HeLa细胞由本实验室传代培养符合测定条件,CT-DNA为生化级试剂.
岛津UV2550型紫外分光光度计,XD30A-RFL型荧光倒置显微镜,BD Accuri型流式细胞仪,ST-360型酶标仪,Perkin-Elmer LS55型荧光分光光度计,WP-RH-6100型多位平行反应合成仪.
1.2 碳酸镁和氢氧化镁的制备
按化学反应方程式摩尔配比,用精度±0.000 1的电子天平准确称取一定量的菱镁矿石,碎化成精细粉末,投入到多位平行反应合成仪烧瓶中,加水过程通入CO2至反应完全,生成碳酸氢镁,在反应后期加入已知少许准确剂量的硫代亚硫酸钠和硫化钠,溶液中的Fe3+还原成Fe2+,生成黑色FeS沉淀,该沉淀物具有丰富的比表面积,吸附了反应体系中的无机杂质.过滤后将所得滤液在95 ℃烘箱中烘干,得到优质碳酸镁样品,符合国家食药级标准GB 25587-2010.根据卫生部药品标准(二部)第五册所提供的检验方法对样品进行检测,测试结果:样品为白色粉末无味,氧化镁42.11 %(质量分数),氯化物0.02 %(质量分数),硫酸盐0.43 %(质量分数),氧化钙0.31 %(质量分数),可溶性盐类0.85 %(质量分数),重金属(以Pb计)8 μg/g,样品适合医药实验.将上述所得合格的碳酸镁样品在550 ℃下热解2 h,得到达到食药级指标要求的氢氧化镁,符合国家药品标准(WS-10001-(HD-0539)-2002).测试结果:样品为白色粉末,氯化物0.02 %(质量分数),硫酸盐0.43 %(质量分数),钙1.3 %(质量分数),可溶性盐类0.85 %(质量分数),重金属(以Pb计)8 μg/g,样品适合医药实验.
1.3 碳酸镁和氢氧化镁负载顺铂实验
分别称取准确剂量的碳酸镁和氢氧化镁粉末,与准确剂量的顺铂混合研磨,用水做分散剂,超声震荡至溶液分散均匀.用紫外分光光度计检测碳酸镁和氢氧化镁的载药含量和包封率[6-9],计算得到碳酸镁的载药量为30.32 %(质量分数),包封率为70.25 %(质量分数);氢氧化镁的载药量为31.56 %(质量分数),包封率为71.76 %(质量分数),达到了载药要求.
1.4 荧光倒置显微镜测定细胞凋亡实验
将负载药物与HeLa细胞在细胞培养箱中培养12 h后,用磷酸盐缓冲溶液(PBS)清洗,用FITC和PI进行染色,在倒置荧光显微镜上成像,观察细胞的形态学变化[10].
1.5 流式细胞法测定细胞凋亡实验
应用流式细胞仪测定负载药物的实验过程与1.4的实验操作相似,凋亡成像图形由四组象限表达[11].
1.6 MTT法测定药物对细胞的半数抑制浓度
负载药物在使用前配制成所需浓度溶液,用细胞培养液稀释成0.4、1.2、3.6、11、33 mg/L 五个质量浓度,将药物与HeLa细胞置于96孔培养板上,培养24 h后,每孔加入20 μL MTT,继续培养4 h后,每孔加入100 μL二甲基亚砜,震荡10 min使甲瓒充分溶解,最后使用酶标仪在波长为490 nm处检测吸光值,通过GraphPad Prism 5软件计算得到药物对HeLa细胞的IC50值[12].
1.7 药物与DNA相互作用的荧光猝灭实验
将2 mL浓度为5×10-5mol·L-1的DNA溶液与0.4 mL溴化乙锭(EtBr)溶液避光反应2 h,加入定量的负载药物置于pH值为7.4的Tris-HCl缓冲溶液中,定容到20 mL,继续避光静置2 h.在激发波长λex=526 nm下,检测发射波长λem=615 nm处的荧光猝灭曲线[13].
2 结果与讨论
2.1 药物的细胞凋亡效果
细胞凋亡是细胞死亡的另一种形式,是多种基因参与并由多种信号传递途径介导的程序化主动死亡过程,许多化疗药物的抗癌效果与诱导肿瘤细胞凋亡的能力相关,已成为评价抗癌药物的重要指标[14].图1为不同倍数下“载体-药物”与HeLa细胞作用12 h后的细胞凋亡效果图.

图1 不同倍数下的细胞凋亡形态Fig.1 Apoptosis morphology with different amplification ratio
从图1中可以看出:药物与HeLa细胞作用后,HeLa细胞形态发生变化,细胞核收缩并发生形变.表明以镁化合物载入的顺铂药物对HeLa细胞发生了抑制作用,产生了凋亡现象
流式细胞仪根据凋亡细胞DNA含量变化和细胞膜磷脂分布变动,采用荧光染色剂标记检测凋亡情况,结果如图2所示.

图2 药物与HeLa细胞作用12 h的流式凋亡图Fig.2 Flow cytometric analysis of drug and HeLa cells for 12 h
图中右下象限为早期凋亡,右上象限为晚期凋亡,左上象限为机械损伤细胞,左下象限为活细胞.分析(a),(b)两组象限细胞计数,碳酸镁负载顺铂对HeLa细胞的早期凋亡率(90.9 %)优于氢氧化镁(68.6 %),而氢氧化镁负载顺铂对HeLa细胞的晚期凋亡率(29.1 %)比碳酸镁(8.4 %)的更佳,12 h后,存活的HeLa细胞数不足3 %(0.7 %,2.2 %),由此说明两种镁化合物作为药物载体,成功负载了顺铂药物,使药物对HeLa细胞有较强的杀伤活性,产生了明显的细胞诱导凋亡现象.
2.2 药物的半数抑制浓度结果
药物对肿瘤细胞的体外活性实验通过MTT法实现,由半数抑制浓度IC50值评价.所有实验都在相同条件下重复3次并取平均值.单纯顺铂、碳酸镁负载顺铂和氢氧化镁负载顺铂得到的对HeLa细胞的IC50值分别为4.215±0.205、4.101±0.145和4.113±0.235.数据表明,顺铂对HeLa细胞有明显的抑制效果,两种镁药物载体载入顺铂药物后,同样对细胞有较强的抑制能力,其抑制活性分别提高了2.7 %,2.4 %.
综上实验结果表明,以临床顺铂对HeLa细胞的研究为对象,顺铂是已知抗肿瘤药物中的首选抑制剂.食药级的碳酸镁和氢氧化镁是顺铂药物的优良载体,由于粒径均匀和丰富的比表面积等特点,以分子间弱作用力对顺铂药物进行负载.在负载体系的组分进入HeLa细胞组织中,顺铂优先水解成顺式二胺二水中间产物,与肿瘤细胞中DNA靶向分子鸟嘌呤N7共价结合[15-16],阻碍了DNA复制,从而发挥了抑制肿瘤细胞的增长.而镁负载体将顺铂药物输送到肿瘤组织细胞后,少量与顺铂交联的镁化合物可能主要以静电方式与肿瘤细胞发生微弱作用,并适当增加顺铂对肿瘤细胞的抑制效果,而镁化合物主体部分在完成载药、送药和释药功能后,会与顺铂复合物自动拆分,游离在细胞组织液外.
2.3 荧光猝灭机理
溴化乙锭(EtBr)为扁平分子探针,可与DNA碱基对发生嵌插作用,从而使DNA-EtBr复合物荧光发射峰大为增强,被视为荧光生物分子探针[17].图3为载药后顺铂药物对DNA-EtBr复合物荧光猝灭趋势图谱.由图3可以看出:载药后的顺铂对DNA-EtBr的荧光有显著的荧光猝灭能力,表明顺铂药物与EtBr竞争,嵌入到DNA碱基对中,发生Pt—N7共价键合和嵌入作用两种协同作用模式,将EtBr从DNA分子中挤出,造成DNA-EtBr荧光值下降.实验条件下,在波长612 nm,617 nm处,碳酸镁负载顺铂和氢氧化镁负载顺铂对DNA-EtBr的猝灭率分别为25.72 %和27.69 %,即负载药物与靶向DNA发生了较强的作用.
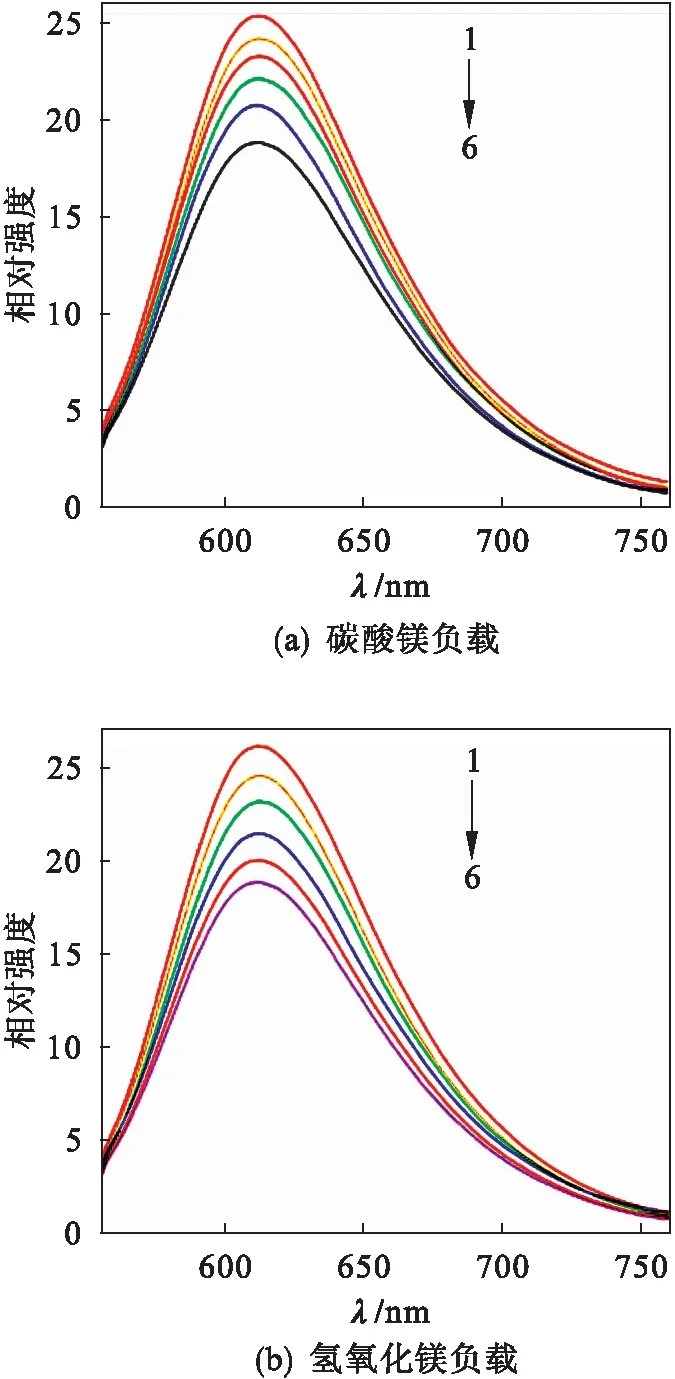
c(DNA)=5×10-6mol·L-1c(EtBr)1×10-6mol·L-11c(药物)=0 mol·L-12c(药物)=0.5×10-6mol·L-13c(药物)=1.0×10-6mol·L-14c(药物)=1.5×10-6mol·L-15c(药物)=2.0×10-6mol·L-16c(药物)=2.5×10-6mol·L-1
图3 药物与DNA作用的荧光图
Fig.3 Fluorescence of drug and DNA
3 结 论
通过化学合成和表征,碳酸镁和氢氧化镁达到了食药级标准.两种镁化合物对临床顺铂药物具有载药功能,并能将药物分子输送到肿瘤细胞组织中,对HeLa细胞有较强的细胞凋亡功能和细胞抑制活性.载药后的顺铂与单独顺铂对 HeLa细胞具有同样或略有提高的抑制效果,与IC50结果相佐证.荧光猝灭结果证实了载药后的顺铂药物与靶向DNA分子之间发生了Pt—N(7)共价键合和嵌入作用两种协同作用模式.
