不同催化剂在甲烷燃烧反应中的活性评价
2018-07-25郭红
郭红
陕西广播电视大学汉中分校,陕西 汉中 723000
随着时代的发展人们对能源的依赖越来越重,而传统的能源是有限不可再生的能源;同时人类在使用能源的同时,大多采用粗犷简单的燃烧,给环境和大气造成严重的污染,威胁人类自身发展。因此研究如何充分利用目前有限的能源提高其转换率,同时降低对大气环境的污染具有重要的意义。天然气主要的成份是甲烷,3含有少量的N元素和S元素,是目前公认的的未来代替煤炭和石油的能源之一。但是甲烷燃烧属于有焰燃烧,其缺点有两点:燃烧物质在燃烧时,氧自由基容易引起气相反应,引起电子激发态产物,反应生成的能量一部分以光能的形式扩散降低能量转化率;氧气自由基容易与天然气中的含有的N元素反应生成NOx,另外相对较低的燃烧转化率会导致反应生成HC和CO,这些产物都容易污染大气。因此如何降低气相自由基对燃烧反应不利影响,提高甲烷绿色燃烧、提高能量转化率成为众多学者研究的内容。本文所研究的催化反应是上个世纪国外学者提出的利用催化氧化反应与气相自由基相结合,降低气相自由基的不利反应。甲烷催化燃烧反应属于无焰燃烧的一种,相比传统有焰燃烧其优点是:低排放CO和HC,燃烧效率高;燃烧温度低下,进而降低NOx的生成,减少对大气的污染;燃烧过程稳定且容易控制,因此便于燃烧完全。虽然采用催化剂催化甲烷燃烧有诸多的优点,但是其催化反应过程中也存在相应的问题如:目前缺乏甲烷燃烧催化剂的寿命的评价办法,原因是甲烷燃烧的催化剂的寿命大于8000 h才具有商业价值,故需要建立催化剂寿命加速老化的标准;催化剂活性成份与高温热稳定性的关系,催化剂和高温蒸发之间的关系等都没有深入的研究;甲烷燃烧催化反应具有燃烧温度低、NOx低排放、燃烧效率高等诸多优点,但是催化燃烧反应不能完全代替传统燃烧,寻找甲烷燃烧的工业领域试用条件是未来研究的内容。本文主要研究三类催化剂:贵金属催化剂、矿物质催化剂、无机酸盐催化剂对甲烷燃烧性能影响,同时建立催化剂活性评价体系将活性数据收集整理,便于以后进行甲烷催化燃烧试验研究新型催化剂提供大量对比试验数据[1]。
1 材料及催化剂的制备
1.1 材料与设备
1.1.1 化学试剂与气体 本试验所采用化学试剂与气体均是市场购买,不做任何处理直接只用以保证原料不被污染和纯正性。具体见下表1。

表1 试剂与气体Table 1 Reagents and gases used in this study
1.1.2 试验设备 本实验设备包括:电子天平AY-220;数显电热鼓风干燥箱101A-1;马弗炉KSW-5-12A;多功能搅拌器HJ-5;中温炉-订制;石英固定床微型反应器-订制;气相色谱仪GC−14C;流量显示仪4D-ZM;流量控制器D07-7B;温度控制器XMT-3000D;K型热电偶-订制。
1.2 负载型贵金属催化剂的制备
等量的γ-Al2O3分别于同体积、相同合适浓度的Ce(CO3)3和Le(NO3)3浸渍,充分搅拌均匀,采用超声技术分散20 min,随后放在数显电热鼓风干燥箱干燥保持120℃状态下干燥24 h。完成之后研磨成粉在550℃下烘焙4 h,分别得到2wt%CeO2/γ-Al2O3和2wt%La2O3/γ-Al2O3,载体化合物。采用Pd(NO3)2等体积溶液浸渍γ-Al2O3、CeO2/γ-Al2O3和 La2O3/γ-Al2O3溶液,充分搅拌之后采用超声波分散20 min,在65℃的状态下干燥24 h,随后在马弗炉里保持550℃状态下烘焙4 h得到目标催化剂:1wt%Pd(Pt)/γ-Al2O3和1wt%Pd(Pt)/2wt%La2O3(CeO2)/γ-Al2O3,将得到的催化剂选择一定数量优秀的颗粒保存备用[2]。
1.3 矿物质型催化剂的制备
将La(NO3)3·6H2O、Sr(NO3)2和Mn(NO3)2按照化学质量分数比溶解于无离子水溶液中,充分搅拌溶解;并在搅拌状态时加入柠檬酸、其含量是溶液阳离子摩尔量的1.3倍数;加入适量的酸调节溶液pH值;在100℃状态下脱水直至形成深红色的湿凝胶;碳化并干燥、得到粉红色粉末;在900℃状态下烘焙12 h,得到催化剂:La0.8Sr0.2Co0.8Mn0.2O3、La0.8Ce0.2Co0.8Mn0.2O3和La0.7Ca0.3Fe0.3Mn0.7O3,选择优秀的科目保存备用。
1.4 无机盐型催化剂的制备
将La(NO3)3·6H2O、Ba(NO3)2(Sr(NO3)2和Al(NO3)2·9H2O按照化学质量分数比溶解于去离子水溶液中直至形成澄清溶液;加尿素沉淀形成pH值为8~9的溶液,在恒温下下搅拌2 h,然后去离子水洗涤在120℃高温状态下烘干24 h,在马弗炉子里烘焙2 h,在1200℃高温下灼烧4 h,形成催化剂:同样选取优秀的颗粒备用。
2 催化剂活性评价
在常压下利用一个具有流动性能的石英微型反应器对催化剂的活性进行检测评价。为了消除局部高温的现象,将催化剂与石英砂按照同等数目比例用石棉网固定在反应器的中部,用K型热电偶在催化剂床上端进行加热,在催化剂入口处测量温度,同时对反应器排放的气体进行气相色谱分析。检测条件是:催化剂用量是0.15 mL,气体比例CH4:O2:He=2:9:80。采用以下公式1计算CH4的转化率[3]。

2.1 催化甲烷燃烧反应活性
2.1.1 负载型贵金属催化剂 CH4中的化学键C-H键能大,需要的氧化活性能高,而催化剂的催化原理就是降低其燃烧所需要的反应活性能。负载型贵金属催化甲烷燃烧,通常是采用Pt和Pd催化,其催化燃烧活性高、需求条件相对温和而得到认可。本文研究1wt%Pd(Pt)/γ-Al2O3和1wt%Pt/γ-Al2O3催化甲烷燃烧的活性,同时研究催化剂的前驱体对催化甲烷燃烧活性的影响,其具体反应条件是:2Vol%CH4,8Vol%O2,90Vol%N2。具体见图1。
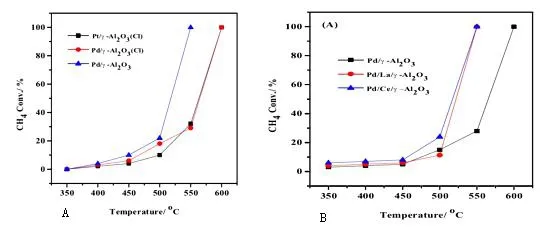
图1 负载型贵金属Pd和Pt催化剂的CH4催化燃烧活性Fig.1 CH4catalytic combustion activity of supported noble metal Pd and Pt catalysts
通过上图1A发现:Pt和Pd都能在一定温度下催化甲烷完全燃烧,区别只是催化甲烷完全燃烧时的温度状态不同,都具有较高的催化活性。Pd/γ-Al2O3催化甲烷燃烧完全转化温度是550℃左右;Pd/γ-Al2O3(Cl)和Pt/γ-Al2O3(Cl)催化反应完全转化温度则是在600℃左右,而且两则的催化状态基本一致;不含Cl制备的贵金属催化剂催化甲烷反应的催化活性明显高于含有Cl前驱体制备的贵金属催化剂。分析其中原因是:负载型贵金属催化活性和活性成分的分散状态有关,分散度越大催化性能越高;活性物质分散度和制备催化剂的前驱物质有关,采用PdCl2制备Pd催化剂时,残余的Cl-会降低催化活性成份Pd在载体上的分散度,残余的Cl-本身就降低活性物质的活性。为提高催化贵金属催化甲烷燃烧的活性,本文采用La和Ce元素去修饰催化剂,在制备过程中将催化剂在含有La和Ce的溶液中浸渍。随后得到的催化反应见图1B。图1B中,可以明显看出La和Ce对1wt%Pd(Pt)/γ-Al2O3和1wt%Pt/γ-Al2O3活性的提高,直观表现是CH4完全燃烧时候的温度大幅度降低。其原因是:稀土元素与贵金属之间形成协同作用,提高甲烷催化剂的反应活性。Pd/CeO2/γ-Al2O3的催化效果优于Pd/γ-Al2O3和Pa/La2O3/γ-Al2O3,具体原因是:Ce+4离子的配位不饱和性增加了其离子电子亲和力进而提高催化效果[4]。
2.1.2 矿物质型催化剂 Co、Mn、Ni、Fe等金属具有可变价态的过渡金属氧化物具有较强的催化甲烷燃烧活性。本文采用Co和Fe基钙钛矿型催化剂催化甲烷燃烧,分析催化活性。具体催化CH4燃烧反应结果数据统计如下图2。

图2 钙钛矿型催化剂的CH4催化燃烧活性Fig.2 CH4catalytic combustion activity of perovskite catalyst
从上图2可以看出Co基钙钛矿催化剂催化甲烷燃烧反应活性基本是和负载贵金属催化反应的活性基本相同,反应温度都是在600℃左右,但是相比之下Fe基钙钛矿催化剂催化甲烷燃烧反应活就低于负载型贵金属活性其反应催化温度是700℃左右。其中La0.8Sr0.2Co0.8Mn0.7O3催化活性最高,原因分析是:Sr能能够决定晶格氧的热稳定性;Sr+2半径和La+3基本一致,因此Sr+2取代La+3取代进入A位置受限因数较小,鉴于整个晶体是中性的,因此必然引起Mn+3转换成Mn+4或者形成O空位,这样引起离子半径变小导致晶胞变小,从而提高其反应催化活性;Sr+2离子势小于La+导致La-O键能大于Sr-O,当Sr+2取代La+3时晶格能量下降引起晶格内原子更加容易迁移,因此能够在相对低的温度催化甲烷燃烧反应。
2.1.3 无机酸盐催化剂 甲烷燃烧温度是800~1200℃,催化燃烧必然要求催化剂也具有较强的热稳定性,前文两种催化剂对于温度很敏感导致稳定性不高,而无机酸盐矿物质具有较强的耐高温性,六铝酸盐是代表。本文研究了六铝酸盐Mn和Co的取代为催化反应物,研究其催化性能,其反应催化结果如图3。

图3 Mn和Co取代的六铝酸盐催化甲烷燃烧活性分析Fig.3Activity analysis of Methane combustion catalyzed by Mn and Co substituted six aluminates
通过上图3发现,Mn和Co取代的六铝酸盐催化活性在400℃基本是没有任何活性的,甲烷的燃烧催化性能是0。在图3A中,Mn和Co取代催化反应开始温度基本是T=600℃左右;温度在T=700~770 ℃时候,活性排布是 Ba0.8La0.2MnAl11O19≈Sr0.8La0.2MnAl11O19>LaMg0.5MnAl11O19;在 770 ℃温度前后催化反应达到最大值。图3B是Co取代的Ba1-xLaxCoAl11O19催化剂活性分析图。根据该图发现:反应活性 Ba0.4La0.6CoAl11O19>Ba0.4La0.6CoAl11O19>Ba0.6La0.4CoAl11O19>Ba0.8La0.2CoAl11O19>LaCo Al11O19>BaCoAl11O19。因此Ba0.4La0.6CoAl11O19的反应活性最高。而经过对3A和3B的对比,我们发现Mn取代的催化剂活性稍微高于Mn取代的催化剂活性。研究其内部原因是:Mn+3具有活性性能的物质,在六铝酸盐晶体内Mn+3取代部分Al+3通过Mn2O3还原Mn3O4过程提供活性氧化物质,进而促进CH4燃烧;同时Mn+3能够在较低的温度下进行还原反应,因此整个CH4催化反应能够在较低的温度下进行[5]。
3 结 论
CH4是烯烃中最为稳定的物质,其燃烧需要能量破坏化学键进而反生燃烧,催化剂的作用就是降低其燃烧反应所要的反应活性能。本文设置了三种不同类型的催化剂,通过研究我们认为:负载型贵金属催化剂和矿物质型催化剂具有较高的性能,其催化甲烷燃烧所需要的温度相对较低;对于负载型贵金属催化剂其La/Ce前驱体比氯化物前驱体的甲烷燃烧性能高;对于钙钛矿催化剂中Sr的燃烧活性最高;六铝酸盐催化剂,Mn取代的六铝酸盐催化剂活性高于Co取代的活性。通过研究,本文认为所研究的结果和思路能够为以后继续寻找更加合适的催化剂催化甲烷燃烧提供思路和方法。
