转录因子-21对宫颈癌细胞放疗敏感性及凋亡的影响
2018-07-25佐合拉古丽木塔力甫阿依努尔色义提
佐合拉古丽·木塔力甫 阿依努尔·色义提
(新疆医科大学附属肿瘤医院妇科放射治疗二病区,新疆 乌鲁木齐 830011)
目前随着宫颈细胞学筛查的不断推广,宫颈癌的发病率有所下降,但仍然严重威胁女性的健康〔1〕。宫颈癌的治疗以手术治疗为主,由于大多数患者在确诊时已处于中晚期,放化疗已成为最为常用的辅助治疗方法。转录因子(TCF)-21是一种抑癌基因,在肝癌、卵巢癌、胃癌等癌组织中表达下调,能够影响肿瘤的生长〔2,3〕。有研究表明,TCF-21过表达后,肺腺癌细胞放化疗敏感性均增加,细胞凋亡增多〔4〕。蛋白激酶B(Akt)磷酸化水平与肿瘤细胞的凋亡有关,且能够调控肿瘤细胞的放疗敏感性〔5〕。本研究旨在探讨TCF-21对宫颈癌细胞放疗敏感性及细胞凋亡的影响。
1 材料与方法
1.1组织及细胞 收集新疆医科大学附属肿瘤医院在2015年1月至2017年2月收治的70例宫颈癌患者的宫颈癌组织及对应的癌旁组织,所有患者在切除手术前没有接受放疗及化疗,组织标本保存于液氮中,标本采集均经过患者及家属知情同意。宫颈癌细胞HeLa、CaSki、SiHa和正常宫颈上皮细胞End1/E6E7均购于中国科学院上海细胞库。
1.2主要仪器及试剂 胎牛血清购于美国Gibco;K-SFM培养基、RPMI1640培养基、胰蛋白酶均购于美国Sigma;TCF-21和甘油醛-3-磷酸脱氢酶(GAPDH)引物均由上海生工合成;pcDNA3.1空载体、TCF-21过表达载体(pcDNA3.1 TCF-21)均购于山东维真生物科技有限公司;活化的含半胱氨酸的天冬氨酸蛋白水解酶(酶切Caspase)-3单克隆抗体、Akt单克隆抗体、磷酸化Akt(p-Akt)单克隆抗体均购于美国Santa Cruz;紫外分光光度计、CO2培养箱均购于美国Thermo;RT-PCR试剂盒购于大连Takara;组织和蛋白提取试剂盒、二喹啉甲酸(BCA)蛋白浓度检测试剂盒均购于碧云天生物技术研究所;Lip2000转染试剂购于美国Invitrogen。
1.3细胞培养 宫颈癌细胞HeLa、CaSki、SiHa用含有10%胎牛血清的RPMI1640培养液培养,正常宫颈上皮细胞End1/E6E7用含有10%胎牛血清、0.1 ng/ml表皮生长因子的K-SFM培养液在37℃、饱和湿度、5% CO2培养箱培养。观察细胞密度超过90%时,用0.25%胰蛋白酶进行消化传代。
1.4qRT-PCR检测组织和细胞中TCF-21 mRNA表达水平 RNA提取:宫颈癌细胞HeLa、CaSki、SiHa和正常宫颈上皮细胞End1/E6E7培养至对数生长期后,按照每10 cm2细胞加入1 ml Trizol裂解细胞;宫颈癌组织及癌旁组织液氮研磨成粉状,按照每50 mg加入1 ml Trizol裂解组织。将裂解液转移到离心管中,放在室温环境下静置5 min,加入200 μl氯仿,上下剧烈振荡15 s,室温环境中静置5 min。4℃,12 000 r/min离心15 min,吸取上清液至EP管中,加入500 μl异丙醇,混匀后,室温静置10 min,4℃,12 000 r/min离心15 min,加入75%乙醇洗涤2次后,在室温环境中干燥。吸取1 μl用于检测RNA浓度及纯度(紫外分光光度计检测浓度及纯度)。根据qRT-PCR试剂盒检测TCF-21 mRNA水平。TCF-21上游引物5′-GGCAGATCCTGGCTAACGAC-3′,下游引物5′-CCTTTCCCAGACTCGCACC-3′。GAPDH上游引物5′-GGCAGATCCTGGCTAACGAC-3′,下游引物5′-CCTTTCCCAGACTCGCACC-3′。循环参数:95℃变性30 s,60℃退火30 s,72℃延伸30 s,25个循环。内参基因为GAPDH,2-△△Ct法计算TCF-21 mRNA水平。
1.5Western印迹检测组织和细胞中TCF-21蛋白表达水平 按照蛋白提取试剂盒提取宫颈癌细胞HeLa、CaSki、SiHa和正常宫颈上皮细胞End1/E6E7、癌旁组织及宫颈癌组织中的蛋白。蛋白样品浓度参照BCA蛋白浓度检测试剂盒检测。取蛋白样品与5倍上样缓冲液按照4∶1的比例混合后,煮沸变性。按照每孔加入40 μg蛋白样品进行电泳,72 V电压观察溴酚蓝进入分离胶和浓缩胶边缘时,把电压升高至120 V,观察溴酚蓝进入胶块下端边缘1 cm处,终止电泳。35 V电压转膜过夜。用含有5%牛血清白蛋白在室温,摇床封闭2 h。与500倍稀释的一抗在4℃孵育过夜后,与2 000倍稀释的二抗在室温环境中孵育90 min。显色后,用目的蛋白灰度值与GAPDH灰度值的比值表示目的蛋白表达水平。
1.6细胞转染及分组 SiHa细胞分为对照组、阴性组和过表达组,其中对照组不做处理,阴性组细胞转染pcDNA3.1空载体,过表达组细胞转染TCF-21过表达载体(pcDNA3.1 TCF-21)。在细胞转染前1 h用不含血清的细胞培养液孵育1 h,用Lip2000转染试剂将pcDNA3.1和pcDNA3.1 TCF-21转染至细胞中。48 h后,RT-PCR和Western印迹分别检测细胞中TCF-21 mRNA和蛋白水平。步骤参照1.4和1.5。将转染48 h后的SiHa细胞以6 MV光子线,100 cm源皮距,10 cm×10 cm照射野,剂量8 Gy放射处理。对照组细胞照射处理后为对照+放疗组,过表达组细胞照射处理后为过表达+放疗组。
1.7流式细胞术检测细胞凋亡 对照组、过表达组、对照+放疗组、过表达+放疗组处理后培养48 h,胰蛋白酶消化细胞,收集9×105个细胞,用200 μl结合缓冲液重悬,加入膜联蛋白(Annexin)V-FITC和碘化丙啶(PI) 各5 μl,混匀,放置室温环境下孵育10 min后,流式细胞仪检测细胞凋亡。
1.8细胞克隆实验检测细胞放疗敏感性 对照组、过表达组培养48 h后,调整细胞浓度为每毫升含有3×106个细胞。接种至12孔细胞培养板中,0、2、4、6、8 Gy剂量照射处理细胞后,在37℃,5% CO2培养箱中培养13 d。用肉眼观察细胞克隆形成后,将细胞培养液倒掉,用磷酸盐缓冲液(PBS)洗涤2次细胞,固定(甲醇,20 min),染色(结晶紫,20 min),用蒸馏水将染液冲洗掉,在显微镜下观察大于50个的细胞克隆数目,计算细胞克隆形成率和细胞存活分数,拟合存活曲线。细胞克隆率=克隆数量÷接种的细胞数,细胞存活分数=受照射的细胞克隆形成率÷对照细胞的克隆形成率,放射增敏比(SER)=(对照组D0/药物处理组D0)。
1.9Western印迹检测酶切Caspase-3、Akt、p-Akt蛋白表达 对照组、过表达组、对照+放疗组、过表达+放疗组处理后培养48 h,收集细胞,按照1.5中步骤检测酶切Caspase-3、Akt、p-Akt蛋白表达。
1.10统计学处理 应用SPSS19.0软件进行t检验、单因素方差分析。
2 结 果
2.1TCF-21在宫颈癌组织和细胞中的表达 TCF-21 mRNA和蛋白在宫颈癌组织中的表达水平(0.36±0.04,0.11±0.03)明显低于癌旁组织(1.00±0.09,0.35±0.04),差异有统计学意义(t=9.320,8.314,P<0.05)。End1/E6E7、HeLa、CaSki、SiHa细胞中mRNA水平(1.00±0.11、0.46±0.03、0.34±0.03、0.22±0.02)和蛋白水平(0.42±0.03、0.23±0.02、0.14±0.02、0.07±0.01)差异有统计学意义(F=99.441,153.111,均P=0.000),TCF-21 mRNA和蛋白在宫颈癌细胞HeLa、CaSki、SiHa中的表达水平均明显低于正常宫颈上皮细胞End1/E6E7(P<0.05),且在SiHa细胞中表达最低。后续选用SiHa细胞为研究对象。见图1,图2。

图1 TCF-21在宫颈癌组织中的表达

图2 TCF-21在宫颈癌细胞中的表达
2.2转染后细胞中TCF-21水平 对照组、阴性组、过表达组TCF-21 mRNA水平(1.00±0.08、1.01±0.12、2.17±0.14)和蛋白水平(0.10±0.02、0.09±0.04、0.58±0.06)差异有统计学意义(F=100.790,126.054,均P=0.000),阴性组mRNA和蛋白水平与对照组差异无统计学意义(P>0.05),过表达组均明显高于对照组(t=12.348,13.607,P<0.05)。见图3。
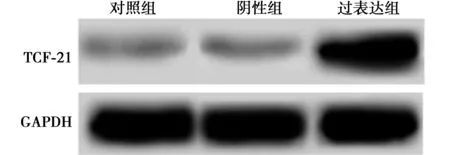
图3 转染后细胞中TCF-21表达水平
2.3TCF-21对细胞凋亡影响 对照组、过表达组、对照+放疗组、过表达+放疗组细胞凋亡率〔(8.77±2.58)%、(41.81±3.40)%、(36.63±2.63)%、(55.47±3.13)%〕差异有统计学意义(F=132.180,P=0.00),对照+放疗组、过表达组、过表达+放疗组明显高于对照组(t=11.547,13.694,19.355,P<0.05)。过表达+放疗组明显高于对照+放疗组(t=7.808,P<0.05)。
2.4放疗敏感性 过表达TCF-21能够降低细胞存活分数,提高放疗敏感性,SER为1.661。见图4,表1。
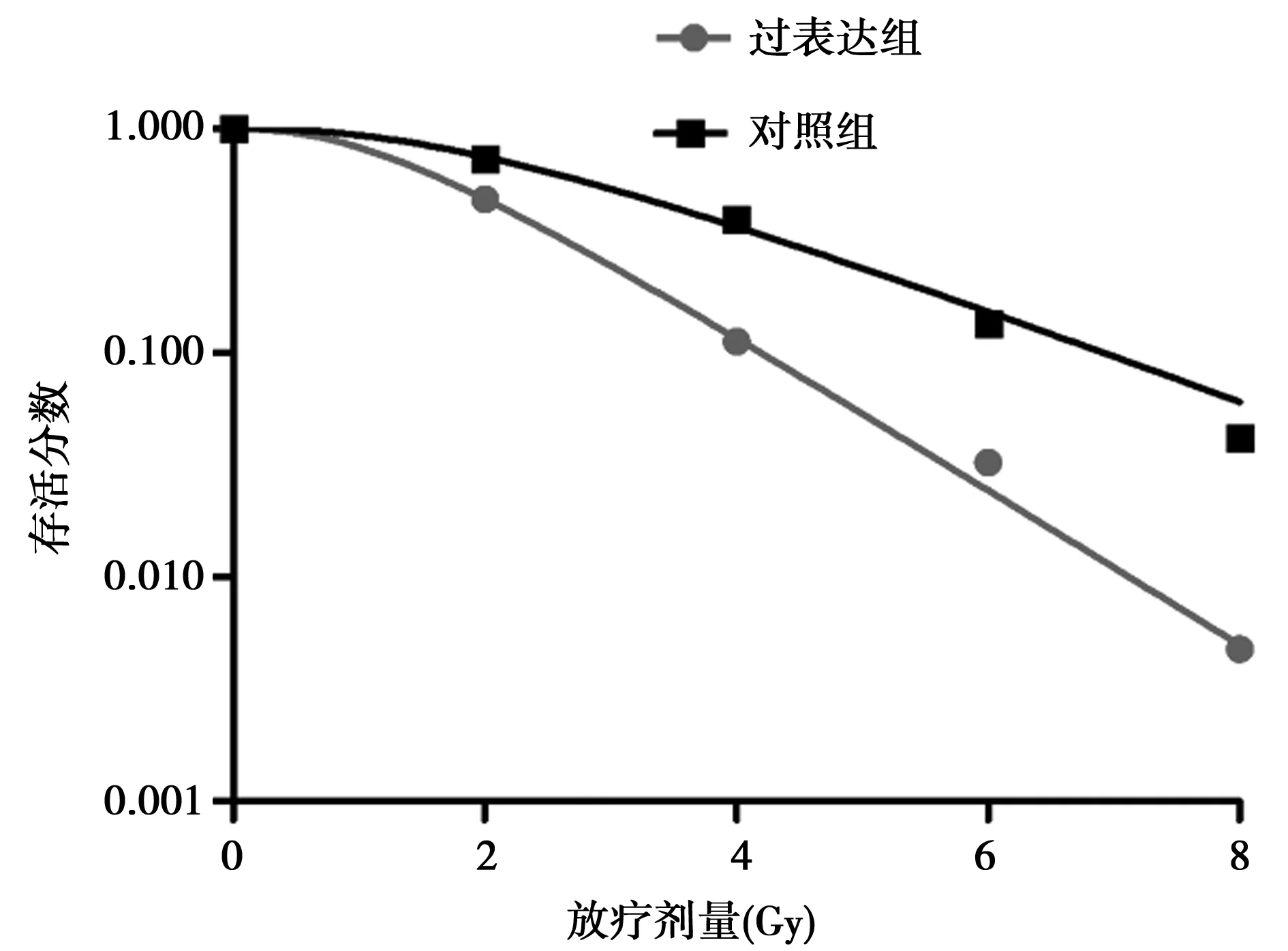
图4 细胞存活曲线

组别D0(Gy)Dq(Gy)NSF2kSER对照组2.0842.1942.8660.7490.480-过表达组1.2551.3482.9290.4860.7971.661
2.5细胞中酶切Caspase-3、Akt、p-Akt蛋白水平 4组酶切Caspase-3水平和p-Akt水平差异有统计学意义(F=65.427,45.114,均P=0.000),而Akt水平差异无统计学意义(F=0.233,P=0.871),对照+放疗组、过表达组、过表达+放疗组酶切Caspase-3水平明显高于对照组(t=3.062,3.242,13.147,P<0.05),过表达+放疗组明显高于对照+放疗组(t=10.085,P<0.05)。对照+放疗组、过表达组、过表达+放疗组p-Akt水平明显低于对照组(t=5.383,4.968,11.593,P<0.05),过表达+放疗组明显低于对照+放疗组(t=6.211,P<0.05)。见图5,表2。

图5 Western印迹检测酶切Caspase-3、Akt、p-Akt蛋白水平
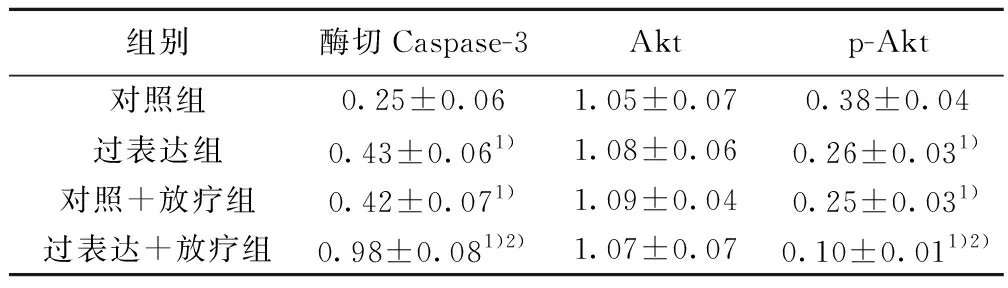
组别酶切Caspase-3Aktp-Akt对照组0.25±0.061.05±0.070.38±0.04过表达组0.43±0.061)1.08±0.060.26±0.031)对照+放疗组0.42±0.071)1.09±0.040.25±0.031)过表达+放疗组0.98±0.081)2)1.07±0.070.10±0.011)2)
与对照组比较:1)P<0.05;与对照+放疗组比较:2)P<0.05
3 讨 论
TCF-21基因定位于6q23-24,是碱性螺旋-环-螺旋家族成员之一,能够编码TCF-21,其在肺、肠、肾等均广泛表达〔6〕。最近的研究表明,TCF-21在多种癌症如肾透明细胞癌、乳腺癌、膀胱癌、黑素瘤、头颈鳞状细胞癌等组织中表达异常下调,且与肿瘤细胞的多种生物学特性有关〔7~9〕。胡松等〔10〕研究表明,TCF-21能够抑制肺癌细胞增殖,促进肺癌细胞凋亡。Tan等〔11〕发现肝癌细胞中几乎检测不到TCF-21 mRNA和蛋白,而过表达TCF-21后肝癌细胞SMMC-7721的凋亡率从12%上升至50%。朱清华〔12〕研究表明,TCF-21 mRNA和蛋白在卵巢癌组织中的表达水平明显低于正常的卵巢组织。本研究结果说明,TCF-21在宫颈癌中表达下调,可能是一种抑癌基因。
放疗是目前治疗肿瘤较为常用的辅助治疗手段,通过靶向基因提高肿瘤细胞放疗敏感性是目前较为常用的提高放疗敏感性的方法〔13〕。陆晓等〔14〕研究表明,促进肺腺癌细胞A549中TCF-21表达后,通过放射处理后,裸鼠成瘤体积减少一半,细胞凋亡增多。本研究结果提示TCF-21能够促进宫颈癌细胞凋亡,增加宫颈癌细胞放疗敏感性。
肿瘤细胞凋亡与细胞多种基因的严格调控有关,是一系列蛋白经过复杂调控的最终结果〔15〕。Caspase级联反应激活后能够促进细胞凋亡的发生,而在Caspase级联反应中Caspase-3发挥凋亡执行的作用,其活化后标志着细胞凋亡进入不可逆的阶段〔16,17〕。Akt信号通路在多种组织和器官中均存在广泛的生物学作用,参与细胞的生长、凋亡等过程〔18,19〕。在肿瘤组织中,Caspase-3活化水平受到抑制,P-Akt水平异常升高,Akt信号通路过度激活〔20〕。Zhang等〔21〕研究表明,Akt信号通路参与miRNA调控肝癌细胞放疗敏感性的过程。本研究结果提示,TCF-21可能通过抑制Akt信号通路增加宫颈癌细胞放疗敏感性,促进宫颈癌细胞凋亡。
综上,TCF-21在宫颈癌组织和细胞中无论是在基因水平还是蛋白水平均明显下调。TCF-21能够促进宫颈癌细胞凋亡,且对放疗诱导的宫颈癌细胞凋亡具有协同作用,能够增加宫颈癌细胞放疗敏感性。
