养殖大菱鲆红斑溃疡病病原菌的生物学特性研究
2018-07-24郭羿叶仕根王诗瑶邢震宇荆笛高东旭黎睿君刘娟
郭羿,叶仕根,王诗瑶,邢震宇,荆笛,高东旭,黎睿君,刘娟
(大连海洋大学 水产与生命学院,大连市海珍品疾病防控重点实验室,农业部北方海水增养殖重点实验室,辽宁 大连 116023)
大菱鲆Scophthalmusmaximus隶属于鲽形目Pleuronectoidei、菱鲆科Scophthalmidae、瘤棘鲆属Psetta,其具有耐低温、无攻击力、生长快、抗逆性较强、味道鲜美等特点,是欧洲主要海水养殖鱼类[1]。20世纪90年代初,中国从英国引入大菱鲆,养殖范围从山东传播至北方沿海各省,现已成为中国的一个重要水产养殖品种[2]。近年来,随着大菱鲆养殖业的迅猛发展,其病害问题越来越突出,特别是微生物性疾病十分常见。根据国内外相关研究报道,可以将大菱鲆微生物性疾病分为三大类:病毒性疾病、细菌性疾病和寄生虫疾病[1]。其中细菌性疾病主要有链球菌病、弧菌病、气单胞菌病、沙雷氏菌病和分枝杆菌病[3]。
杀鲑气单胞菌隶属于气单胞菌属Aeromonas,是革兰氏阴性短杆菌[4],于1984年首次分离自一条患病的溪鳟Salvelinusfontinalis[5]。该菌主要包括无色亚种achromogenes、杀鲑亚种salmonicida、杀日本鲑亚种masoucida、史氏亚种smith和溶果胶亚种pectinolytica等5个亚种[6]。杀鲑气单胞菌是鱼类溃疡病的主要致病菌,在感染初期,鱼体躯干的局部皮肤及肌肉组织发炎,生出一个或几个与人类疖疮病相似的脓疮[7];随着病灶内细菌繁殖数量增多,皮肤和肌肉发炎,化脓形成脓疮,患病部位软化,向外隆起,隆起的皮肤先充血后出血、坏死和溃烂,严重时露出骨骼[8]。鱼体发病部位不定,通常在鱼体背鳍基部附近的两侧[9]。随着杀鲑气单胞菌的变异和进化,其可感染的宿主范围也在逐渐扩大,已由最初的鲑科Salmonidae鱼类扩大到鲤科Cyprinidae、鲆科Bothidae和鳗鲡科Anguillidae鱼类,给水产养殖业带来了巨大的经济损失[10]。
2016年6月,辽宁省葫芦岛市等地区养殖大菱鲆出现死亡,病鱼早期症状是鳃盖出血、鳍腐烂、体表出现含有脓血的溃疡,养殖水温为15 ℃。为此,本研究中从病鱼中分离纯化出优势菌株,并进行了人工感染试验、生理生化特征检测、16S rDNA测序和药物敏感性试验,以期为养殖大菱鲆红斑溃疡病的病原鉴定及其防治等提供参考。
1 材料与方法
1.1 材料
1.1.1 样品来源 患病大菱鲆取自辽宁省葫芦岛市某养殖场,优势菌分离自病鱼肝脏、肾脏、脾脏和溃疡处。人工感染试验用健康大菱鲆购自大连天正养殖场,体长为10~15 cm,饲养在40 L的塑料箱中,用气石充气,注射试验前暂养3 d。在暂养和正式试验过程中,试验鱼食物充足,每两天换水1次,每次换2/3水体。
1.1.2 试剂药品 胰蛋白胨大豆琼脂(TSA)培养基和营养肉汤(NB)培养基购于青岛高科园海博生物技术有限公司;革兰染色液和细菌微量生化反应管购于杭州滨和微生物试剂有限公司;细菌基因组DNA提取试剂盒购于天根生化科技(北京)有限公司;引物由生工生物工程(上海)股份有限公司合成。
1.2 方法
1.2.1 病原菌的分离与人工感染试验
(1)病原菌的分离。将患有红斑溃疡症的大菱鲆置于解剖盘中,用75%酒精擦拭体表,以无菌操作方式取溃疡处、肝脏、脾脏和肾脏等组织,划线接种到含2.5% NaCl的TSA培养基上,置于28 ℃培养箱中倒置培养24 h。挑取单菌落进一步划线纯化,将获得的纯培养置于20%的甘油-营养肉汤培养基中,-80 ℃下保存备用。
(2)人工感染试验。注射感染试验:用0.9%无菌生理盐水将纯化培养的HLD01制成菌悬液,并进行梯度稀释,共设置5.37×106、5.37×107、5.37×108、5.37×109CFU/mL 4个浓度组,同时设立对照组,每组10尾鱼。4个浓度组以腹腔注射法人工感染大菱鲆,每尾鱼注射200 μL相应浓度的菌悬液,对照组鱼注射200 μL 0.9%无菌生理盐水,每天观察记录各组大菱鲆发病及死亡情况。
浸泡感染试验:用0.9%无菌生理盐水将纯化培养的HLD01制成菌悬液,并进行梯度稀释,共设置1.5×104、1.5×105、1.5×106CFU/mL 3个浓度海水组,并设立对照组,每组放入8尾大菱鲆。将试验大菱鲆的背部用无菌刀片割伤,切割的长度和深度尽量保持一致,对照组海水中不添加菌液,每天观察记录各组大菱鲆发病及死亡情况。
根据改良寇氏法[11]分别计算HLD01在注射感染试验和浸泡感染试验中的半致死剂量LD50。在无菌条件下,对具有与自然发病大菱鲆相似症状的人工感染大菱鲆进行细菌分离,若分离得到的细菌与人工感染试验所用的菌株各方面特征相同,则说明分离到的细菌是病原菌。
1.2.2 病原菌的鉴定
(1)形态特征观察。肉眼观察培养24 h后的菌落,对其大小、颜色等特征进行测量和记录。参照革兰染色液说明书对优势菌HLD01进行染色并镜检。
(2)生理生化特征测定。挑取适量培养于含2.5% NaCl的TSA培养基中的待测菌落(培养温度为28 ℃、培养时间为24 h)置于生理生化反应管中,并置于28 ℃培养箱中培养24 h。观察生理生化管颜色等特征变化,参照各生理生化指标说明书对优势菌HLD01进行生理生化特征测定,并与《常见细菌系统鉴定手册》[12]进行比对。
(3)16S rDNA基因序列测定。用细菌基因组DNA提取试剂盒提取优势菌HLD01的DNA,采用细菌16S rDNA通用引物(正向引物F:5′AGAGTTTGATCCTGGCTCAG 3′;反向引物R:5′TACGGYTACCTTGTTACGACTT 3′)对优势菌的核苷酸进行PCR扩增。
PCR反应体系(共25 μL):10×buffer 2.5 μL,dNTP(25 mmol/L)2 μL,Taq DNA Polymerase 0.13 μL,模板1 μL,上、下游引物(10 μmol/L)各0.5 μL,ddH2O 18.37 μL。PCR反应条件:94 ℃下预变性5 min;94 ℃下变性30 s,55 ℃下退火30 s,72 ℃下延伸1 min 30 s,共进行30个循环;72 ℃下再延伸10 min。
PCR产物由北京华大基因有限公司进行测序。根据测定结果,在NCBI网站用Blast软件进行同源性比对(https://blast.ncbi.nlm.nih.gov/Blast. cgi),从Nucleotide数据库中选取10条与HLD01相近的细菌序列,利用MEGA4.0软件[13]的Neighbor-Joining法构建系统发育树,系统进化树分支置信度用 1000 次重复自举检验,在计算过程中,系统自动省略不确定和缺失的位点。
1.2.3 药物敏感性试验 用0.9%无菌生理盐水将培养36 h的HLD01制成终浓度为1.0×107CFU/mL的菌悬液,取100 μL涂布于含2.5% NaCl的TSA培养基上,将抗生素纸片(购于杭州滨和微生物试剂有限公司)贴于培养基表面,每个平板贴4片,共计20片。将平板倒置于28 ℃培养箱中培养24 h,记录药敏纸片周围抑菌圈直径。根据CLSI评判标准[14]对药敏试验结果进行分析。
2 结果与分析
2.1 病原菌的分离与人工感染试验结果
2.1.1 病原菌的分离 从患病大菱鲆各组织器官中均分离得到一株优势菌落,将其命名为HLD01。HLD01菌在含2.5%NaCl的TSA培养基上生长缓慢,呈乳白色,圆形,直径为(0.6±0.1)mm,表面湿润、光滑。
2.1.2 人工感染试验结果 菌株HLD01通过腹腔注射和划伤浸泡两种方式感染大菱鲆,结果显示,该菌株对大菱鲆有较强致病力(表1)。HLD01通过腹腔注射法感染大菱鲆的LD50为8.4×107CFU/mL,95%可信限为(3.2×107~ 2.3×108)CFU/mL;通过划伤浸泡法感染大菱鲆的LD50为6.3×104CFU/mL,95%可信限为(5.6×104~ 7.1×104)CFU/mL。自然发病的大菱鲆如图1所示。试验中人工感染患病大菱鲆与自然发病的大菱鲆症状大致相同,均表现为体表黏液增多、体表有大小不一的溃疡灶、腹部肿胀和肝脏贫血(图2)。从濒死的人工感染患病大菱鲆体内也分离得到HLD01菌,证明该菌株为此次大菱鲆红斑溃疡症的病原菌。

表1 人工感染大菱鲆的试验结果Tab.1 Results of artificially challenged turbot with HLD01 injection
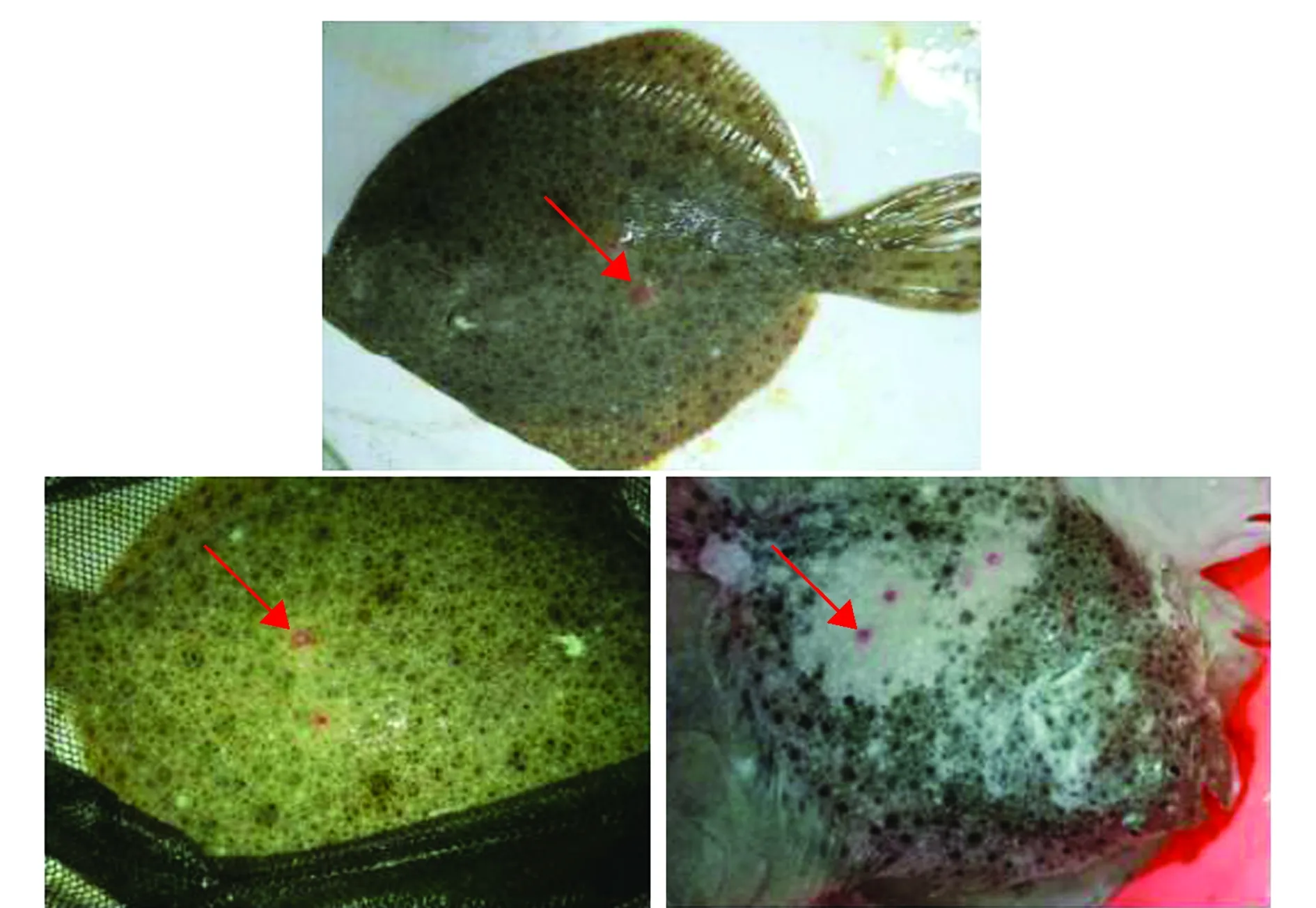
注:红色箭头示体表溃疡处Note:Red arrows show the ulcer on the body surface图1 自然发病大菱鲆的体表症状Fig.1 Surface symptoms of the diseased turbot with natural morbidity

注:红色箭头示体表溃疡处Note:Red arrows show the ulcer on the body surface图2 人工感染大菱鲆的体表症状Fig.2 Surface symptoms of turbot challenged by infection
2.2 病原菌的鉴定
2.2.1 形态鉴定 HLD01菌在含2.5%NaCl的TSA培养基上生长呈乳白色,圆形,直径为(0.6±0.1) mm,表面湿润、光滑。
经过革兰氏染色和显微镜观察(OLYMPUS CX21),该菌株为革兰氏阴性短杆菌,有荚膜,无芽孢和鞭毛,大多单个分布,少数成对分布。
2.2.2 生理生化特征鉴定 菌株HLD01主要生理生化特征为对鸟氨酸脱羧酶阴性;硝酸盐还原呈阳性;能发酵麦芽糖、葡萄糖、蔗糖和D-葡萄糖产酸;不能发酵阿拉伯糖醇、阿拉伯糖、肌醇、棉籽糖、木糖、半乳糖、阿东醇产酸;不能发酵D-葡萄糖产气;不产生硫化氢(表2)。通过对比3种杀鲑气单胞菌亚种的生理生化指标,最终将HLD01确定为杀鲑气单胞菌无色亚种。但是该分离株不能在0% NaCl的环境下生长(表2),与杀鲑气单胞菌无色亚种的生理生化指标稍有偏差。
2.2.3 16S rDNA基因序列分析 菌株HLD01经16S rDNA通用引物扩增后得到的基因片段长度为1412 bp, Blast分析结果表明,其与杀鲑气单胞菌的同源性最高,达100%。从NCBI上的Nucleotide数据库中选取10株与HLD01相近的序列,经ClustalX进行多序列比对后,利用MEGA 4.0软件制作系统发育树。
表2HLD01菌的生理生化特性分析
Tab.2PhysiologicalandbiochemicalcharacteristicsofHLD01

鉴定项目characteristic item菌株HLD01无色亚种杀日本鲑亚种杀鲑亚种肌醇 inositol----木糖 xylose----蔗糖 sucrose+++-木醇 methanol-NFNFNF硫化氢 H2S--+-阿东醇 adonitol----半乳糖 galactose----棉籽糖 raffinose----葡萄糖 glucose++++麦芽糖 maltose++++松二糖 turanose+NFNFNF松三糖 melizitose-NFNFNF阿拉伯糖 arabinose--++阿拉伯糖醇 arabinitol----硝酸盐还原 nitrate reduction++++0%NaCl生长growth at 0% NaCl -+++1%NaCl生长growth at 1% NaCl ++++鸟氨酸脱羧酶 ornithine decarboxylase----D-葡萄糖产酸 decomposi-tion of D-glucose produces acid++++D-葡萄糖产气 decomposi-tion of D-glucose produces gas--++
注:+为阳性;-为阴性;NF为未知
Note:+,positive; -,negative; NF,unknown
由系统发育树可知,菌株HLD01与杀鲑气单胞菌无色亚种聚为一支,且与杀鲑气单胞菌其他亚种具有较近的亲缘关系(图3)。综合16S rDNA序列分析结果和生理生化试验结果,证实菌株HLD01为杀鲑气单胞菌无色亚种。
2.3 药物敏感性试验
药物敏感性试验结果显示,菌株HLD01对庆大霉素、卡那霉素、菌必治、恩诺沙星等12种药物高度敏感,对氧氟沙星中度敏感,对头孢拉定、林可霉素和克林霉素等7种药物不敏感(表3)。

表3 HLD01菌对20种抗菌药物的敏感性试验结果
注:S为高度敏感;M为中度敏感;R为不敏感
Note: S,high sensitive; M,medium sensitive; R,resistant
3 讨论
3.1 杀鲑气单胞菌的来源与分类
杀鲑气单胞菌最早在1890年由Weible和Emmerich从患病鳟鱼体内分离发现[15],其宿主范围十分广泛,是多种水生动物的原发性病原菌[16]。根据吲哚产生、七叶苷利用,以及对半乳糖、蔗糖等碳水化合物的分解能力等生理生化差异[17],将杀鲑气单胞菌分为杀鲑亚种、史氏亚种、杀日本鲑亚种、溶果胶亚种和无色亚种5个亚种[6,18-19]。
本研究中从自然发病的大菱鲆溃疡灶及内脏中分离得到一株优势菌HLD01,经形态学观察、生理生化试验和16S rDNA鉴定,证明本次大菱鲆红斑溃疡症的病原菌为杀鲑气单胞菌无色亚种。
3.2 杀鲑气单胞菌的致病性
本研究中的人工感染试验表明,人工感染发病大菱鲆和自然发病大菱鲆均表现为口部和鳍部有出血点、腹部肿胀、肝脏发白、肠炎等症状,这与吕俊超等[20]报道的由杀鲑气单胞菌感染大菱鲆的症状表现一致,但两试验间也存在着一定的差异。本试验中,腹腔注射5.37×109CFU/mL剂量组的试验鱼于注射后第二天全部死亡,其余剂量组的试验鱼于注射后第三天开始陆续死亡,截至试验结束,5.37×106CFU/mL剂量组试验鱼的死亡率仅为10%;而吕俊超等[20]报道的攻毒试验,每尾大菱鲆注射1.1×106CFU时,该组大菱鲆于2 h内全部死亡。对比两次试验的数据,杀鲑气单胞菌对大菱鲆具有一定的致病力,但致死能力有所下降。

图3 基于HLD01和其他同源菌株的16S rDNA序列构建的系统发育树Fig.3 Phylogenetic tree of 16S rDNA sequences in strain HLD01 and other homologous bacterial strains
经鉴定,从攻毒试验感染大菱鲆中分离到的细菌与HLD01菌在形态特征、16S rDNA基因序列测定和生理生化指标等方面相一致,这符合科赫法则[21],同时也再次证明,HLD01菌是本次大菱鲆红斑溃疡症的病原菌。
3.3 杀鲑气单胞菌的感染途径
本研究中发现,患病鱼体表出现红斑溃疡症状,且有其他研究报道发现,杀鲑气单胞菌是虹鳟和刺参发生皮肤溃疡症状的致病菌[22-23],由此证实,该菌是引起鱼类等水生生物皮肤溃疡病的主要病原菌[24]。杀鲑气单胞菌的感染途径大致分为两种:一种是细菌通过养殖水体进行传播,在大菱鲆摄食过程中随着水和食物进入消化系统并侵入血液导致败血症,致使皮肤和肌肉坏死溃烂[25];另外一种是细菌从鱼体创伤处进入鱼体内,引起局部皮肤或肌肉组织发炎,进而化脓、坏死、溃烂,形成红斑溃疡[26]。因此,在鱼类养殖过程中,为了避免感染杀鲑气单胞菌,应随时注意水质,投喂优质饵料,降低养殖密度,减少鱼类在运输过程中造成的机械损伤[27]。同时,由于细菌会随着鱼类排泄物在水中扩散[28],故要及时清理排泄物。
3.4 杀鲑气单胞菌无色亚种的药物防治
目前,大菱鲆溃疡病的主要防治方法是遍洒抗生素。本试验中,经20种抗生素纸片对HLD01菌的药敏测定显示,该菌对庆大霉素、头孢吡肟、拉氧头孢、头孢他啶、卡那霉素、头孢哌酮、强力霉素、菌必治、头孢曲松、头孢呋辛、恩诺沙星和多粘菌素B 12种药物高度敏感,对头孢拉定、氨苄西林、林可霉素、头孢唑林、磺胺甲恶唑和克林霉素7种药物耐药。王亚冰等[29]研究表明,头孢他啶、头孢哌酮、强力霉素、头孢曲松和头孢呋辛药物对杀鲑气单胞菌无色亚种有较好的抑菌作用,与本研究结果相一致。根据本研究药敏试验结果,可参考选取庆大霉素、头孢吡肟、拉氧头孢等药物来治疗和控制养殖大菱鲆溃疡病。同时,为防止杀鲑气单胞菌无色亚种对更多抗生素产生耐药性,应科学用药、对症下药,同时积极研发相关疫苗,以减少经济损失。
