山东省荣成海区潮间带鼠尾藻生长及其化学组分的季节性变化
2018-07-24詹冬梅吕芳栾青王翔宇丁刚郭文
詹冬梅,吕芳,栾青、2,王翔宇,丁刚,郭文
(1.山东省海洋生物研究院,山东 青岛 266104;2.烟台大学 生命科学学院,山东 烟台 264005)
鼠尾藻Sargassumthunbergii为西北太平洋特有的暖温性海藻,也是中国潮间带常见的褐藻,在医药、保健、化工等方面具有重要价值。山东省荣成海域鼠尾藻自然资源比较丰富,其褐藻胶与岩藻黄素含量较高,是制备该类活性物质的重要原料。目前,学者对鼠尾藻的分布[1-2]、种苗繁育[3-5]和养殖技术[6-7],以及对鼠尾藻活性物质的制备和分析已有不少报道[8-10],严小军等[11]对鼠尾藻褐藻多酚含量的季节性变化进行了研究,但对其褐藻胶和岩藻黄素随季节和潮位变化目前尚未见报道。本研究中,对不同潮位下山东省荣成海域野生鼠尾藻生长及其化学组分的季节性变化进行研究,以期为鼠尾藻活性成分的化学分析和制备提供参考。
1 材料与方法
1.1 材料
鼠尾藻采样地点为山东省荣成市爱莲湾海域,如图1所示,共设9个调查站位,调查海域盐度为30.7~31.5,温度为2.2~24.0 ℃。
1.2 方法
1.2.1 采样方法 笔者在潮间带定期观察俚岛海区(N37°、E122°)鼠尾藻的生长,在3、6、10、12月大潮期间采集鼠尾藻,在高潮带、中潮带和低潮带分别等距设立3个取样点,取样点间隔为(250±10)m,于2016年3—12月在样方内每月大潮期间取样,用规格为30 cm×30 cm的方框随机选取小样方,方框内鼠尾藻带固着器完全铲下,样品装进塑料袋带回实验室,去除杂藻及附属物备用。
1.2.2 鼠尾藻长度及鲜质量的测定 在3个样方内每次分别取30株最大长度的鼠尾藻并取其平均值,作为每月鼠尾藻的平均长度。用吸水纸吸干鼠尾藻表面水分称鲜质量,鼠尾藻生物量计算公式为
W=(W1+W2+W3)/3。
其中W1、W2、W3为3 个样方鼠尾藻的湿质量(g)。
1.2.3 一般化学组分的测定 将采集的新鲜鼠尾藻放入烘箱,在80 ℃下烘干24 h,室温冷却后置于冰箱(-20 ℃)中冷冻保存,用于鼠尾藻化学组分的测定。分别采用凯氏定氮法、560 ℃煅烧法测定粗蛋白质和灰分含量。
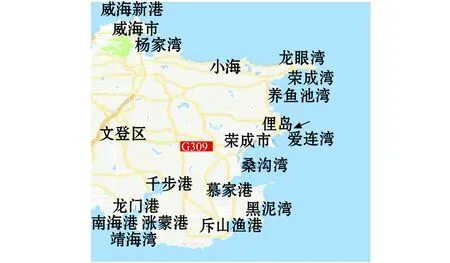

图1 山东省荣成俚岛海区鼠尾藻采样地理位置Fig.1 Geographical location of brown alga Sargassum thunbergii sampling at Lidao sea area in Rongcheng
1.2.4 褐藻胶含量的测定 参考尚德荣等[12]的方法测定褐藻胶含量。称取1.0 g鼠尾藻粉,加2.0 mol/L盐酸30 mL浸泡12 h后,用蒸馏水洗涤5次以上,用AgNO3溶液滴定洗出液至无沉淀为止;再用0.1 mol/L醋酸钙溶液30 mL浸泡2 h,用0.1 mol/L NaOH溶液滴定含有海藻的醋酸钙溶液。
1.2.5 岩藻黄素含量的测定 参照闫相勇等[13]的方法测定岩藻黄素含量。取冷冻保存的干燥样品0.5 g,在40 ℃下用20 mL甲醇(体积分数100%)避光浸提2次,每次1 h。合并浸提液,以4000r/min离心10 min,取上清液倒入分液漏斗中,加入正己烷震荡混匀,静置混合液待其分层后,保留上层溶液,放出下层甲醇水溶液,再反复用正己烷萃取,直至下层甲醇水溶液无黄色为止。合并所有上层溶液并定容。在450 nm波长下测定吸光值,岩藻黄素含量(mg/g)计算公式为
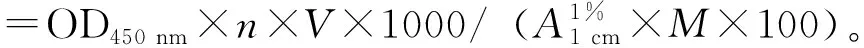
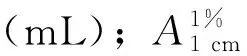
1.2.6 褐藻多酚含量的测定 参照严小军[14]的方法测定褐藻多酚含量,并采用微波辅助提取海藻褐藻多酚[15]。先用间苯三酚作褐藻多酚标准曲线,即取一定体积的标准液到比色管中,加水稀释至7 mL,混合均匀, 加入1 mL FD试剂摇匀,3 min后加入2 mL饱和碳酸钠溶液,混合充分,3 h后于710 nm波长下测定吸光值。
样品测定:鼠尾藻干粉预先用40目筛过筛,称取0.10~0.15 g样品,加入3 mL 体积分数为15%的乙醇,在25 mL比色管中浸泡24~48 h后,放入功率为700 W微波炉中,10 s后,离心去掉沉淀,将上清液定容。取0.1 mL上清液到比色管中,按标准曲线方法进行测定。
FD试剂:即磷酸钨钼复合物,将80 g钨酸钠、20 g钼酸钠、500 mL( 85%)磷酸和250 mL水混合,加热回流2 h,冷却后加水定容至1 L。
2 结果与分析
2.1 鼠尾藻生态观察
中潮带鼠尾藻在不同月份的生长状态见图2。

图2 中潮带鼠尾藻在不同月份的生长状态Fig.2 Growth of brown alga Sargassum thunbergii at the middle tidal zone in various months
荣成俚岛海区水温全年变化范围为2.2~24.0 ℃(图3)。
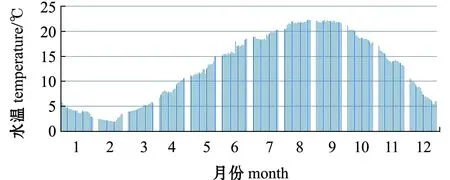
图3 2016年荣成俚岛海区水温变化图Fig.3 Variations in water temperatures in Lidao sea area in 2016
本试验中观察到鼠尾藻生活在岩礁底质的潮间带和潮下带,为优势种,成片分布,形成多年生自然分布种群。荣成海区当地鼠尾藻全年可见,在1—3月,由于海区水温较低,鼠尾藻较短,但有初生分枝,极少见次生分枝;进入4月下旬后,当水温到达10 ℃以上时进入快速生长,生物量增长迅速;5月鼠尾藻产生次生分枝;6月次生分枝数量和长度明显增加,开始出现生殖托;7月上旬由于长度和生殖托质量的快速增加,这期间鼠尾藻的生物量达到最大值,7月下旬后,随着鼠尾藻精卵成熟而进行生殖排放,生殖托和藻体开始溃烂断裂;8月鼠尾藻较长的枝条基本流失,留下从盘状固着器新发的嫩枝,这种状态一直持续到10月;当水温由夏季高温降低到18 ℃时,鼠尾藻嫩枝开始新一轮生长,直到12月底海区水温降到7 ℃时其生长基本停止。
2.2 鼠尾藻长度和生物量的变化
从表1可见:6月,鼠尾藻的长度和生物量最大,同一时期潮位越低鼠尾藻生物量越大,从野生鼠尾藻生长的季节与海水温度分析,鼠尾藻在水温10~18 ℃时进入快速生长;8—9月,高温期不适宜鼠尾藻生长,此时海水温度在23 ℃以上;11—12月,海水温度降到18 ℃以下,鼠尾藻进入下半年的生长周期,由于时间短,嫩枝起始生长长度短,故11—12月的生物量比较小。
2.3 鼠尾藻化学组分的变化
从表2可见:鼠尾藻粗蛋白质及灰分含量比较高,其含量随季节而变化;鼠尾藻中褐藻胶变化范围为20.30%~33.02%,在生长快速的6月和10月含量最高,在3月和6月,低潮位的褐藻胶含量显著高于高潮位褐藻胶(P<0.05),其他时间不同潮位对其体内褐藻胶含量无显著性影响(P>0.05);鼠尾藻体内的岩藻黄素含量在6月显著低于12月(P<0.05);鼠尾藻中褐藻多酚变化范围为0.32%~3.82%,随月份变化显著(P<0.05),在3月含量最高,同一时期低潮位鼠尾藻体内的褐藻多酚含量高于高潮位鼠尾藻。
表1不同月份俚岛野生鼠尾藻长度及生物量的变化
Tab.1ChangesinlengthandbiomassofbrownalgaSargassumthunbergiiattidalzoneofLidaoinvariousmonths
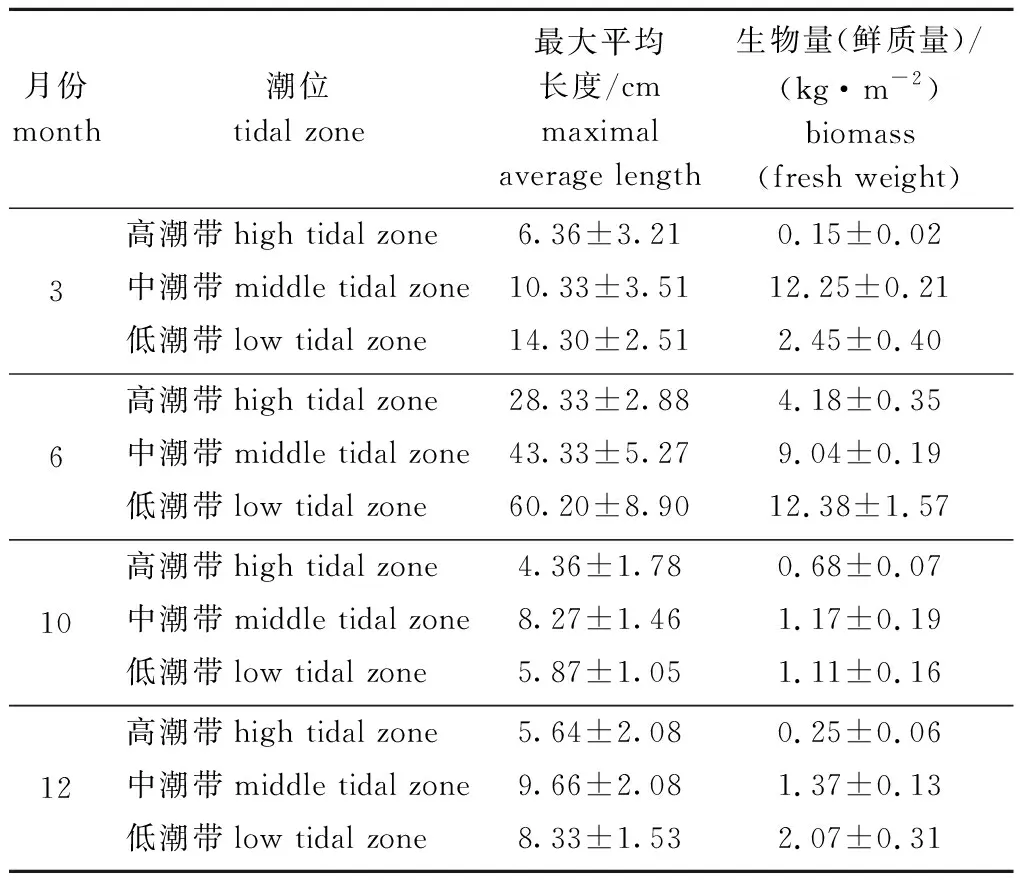
月份 month潮位 tidal zone最大平均长度/cm maximal average length生物量(鲜质量)/(kg·m-2)biomass(fresh weight)3高潮带high tidal zone6.36±3.21 0.15±0.02中潮带middle tidal zone10.33±3.51 12.25±0.21低潮带low tidal zone14.30±2.51 2.45±0.406高潮带high tidal zone28.33±2.884.18±0.35中潮带middle tidal zone43.33±5.279.04±0.19低潮带low tidal zone60.20±8.90 12.38±1.5710高潮带high tidal zone4.36±1.780.68±0.07中潮带middle tidal zone8.27±1.461.17±0.19低潮带low tidal zone5.87±1.05 1.11±0.1612高潮带high tidal zone5.64±2.080.25±0.06 中潮带middle tidal zone9.66±2.081.37±0.13低潮带low tidal zone8.33±1.532.07±0.31
3 讨论
3.1 鼠尾藻的生长特性及季节变化
同一时期,潮位越低鼠尾藻生物量越大,说明鼠尾藻虽耐一定程度的干露,且有的鼠尾藻生长在高潮带,但中低潮位的鼠尾藻生长长度和生物量均为最大值。笔者观察到,海区潮下带3 m以下难以发现鼠尾藻,由此得出,鼠尾藻可能需要高光条件才能满足其生长需要。
鼠尾藻成熟个体不适宜8—9月21 ℃以上的高温,此时期藻体停止生长甚至衰败流失,但从盘状固着器上发出的鼠尾藻嫩枝却较耐高温,能在8—9月存活,但生长速度缓慢。6月鼠尾藻的长度和生物量最大,这与崔志峰[16]的研究结果一致。
3.2 鼠尾藻的化学组分
鼠尾藻粗蛋白质含量较高,这与吴海歌等[17]、李来好等[18]报道的结果一致。蛋白质在生长旺盛期(6月)含量较低,这与吴信[19]得出的多肋藻体内蛋白质随藻体生长呈上升趋势不一致。
中国在20世纪50年代就开发出以马尾藻中海蒿子为原料提取褐藻胶的技术,自20世纪60年代末人工海带养殖成功后,开始以海带为原料生产褐藻胶[20]。从几种褐藻中褐藻胶含量的比较(表3)可见,马尾藻褐藻胶含量较高,如鼠尾藻和铜藻中褐藻胶含量较高,而本研究表明,鼠尾藻中褐藻胶含量随季节变化显著,在藻体生长快速的6月褐藻胶含量较高,即鼠尾藻中褐藻胶含量与生物量同时达到最大值。作为提取褐藻胶的补充原料,该结果为收获鼠尾藻的最佳时间提供了参考。

表2 不同月份俚岛潮间带鼠尾藻化学组分的变化Tab.2 Component contents of brown alga Sargassum thunbergii in the tidal zone of Lidao in various months
表3鼠尾藻褐藻胶含量与其他褐藻的比较
Tab.3ComparisonofalginatecontentbetweenbrownalgaSargassumthunbergiiandotherbrownseaweeds
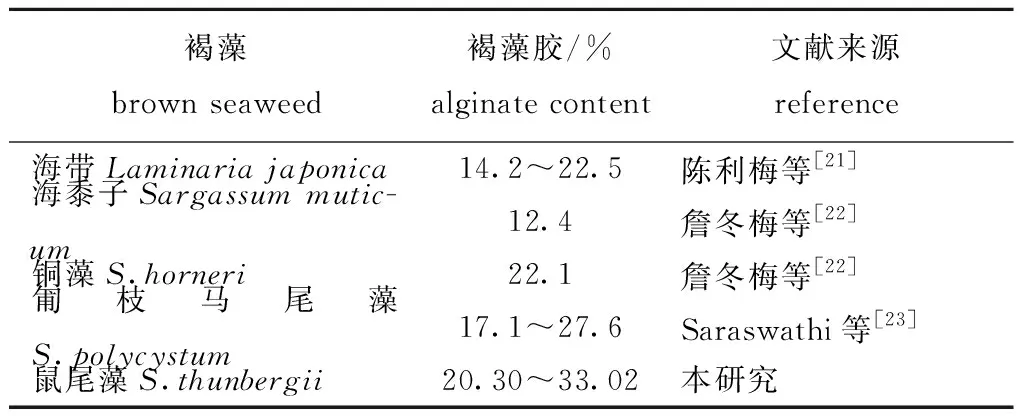
褐藻brown seaweed褐藻胶/%alginate content文献来源reference海带Laminaria japonica14.2~22.5陈利梅等[21]海黍子Sargassum mutic-um12.4詹冬梅等[22]铜藻S.horneri22.1詹冬梅等[22]匍枝马尾藻S.polycystum17.1~27.6Saraswathi等[23]鼠尾藻S.thunbergii20.30~33.02本研究
岩藻黄素是褐藻中一种主要的色素,本研究表明,其含量在12月显著高于6月,可能是因为鼠尾藻在12月生长速度缓慢,为了维持一定的光合作用,12月岩藻黄素是鼠尾藻对低温表现出的一种应激反应。因此,在适宜的生长温度范围内,随着温度升高鼠尾藻岩藻黄素含量变低。鼠尾藻中岩藻黄素含量与其他褐藻的比较见表4,其中裙带菜含量最高,海带也较高,马尾藻中岩藻黄素比裙带菜低,各马尾藻中铜藻的岩藻黄素含量最高。
褐藻多酚是从褐藻中提取出的新型海洋天然物质,具有抗氧化、抗病毒抗菌和抗肿瘤等生物活性[9,24-28]。本研究表明,野生鼠尾藻中褐藻多酚含量为0.32%~3.82%,与严小军等[11]报道的鼠尾藻多酚含量的季节变化为0.8%~1.8%相比,其变化幅度更大,但变化趋势一致,均为在其生长旺盛期即6—10月较高。褐藻多酚含量的变化可能受环境因子、pH、温度、光照和离子强度等影响,但对其生物化学代谢循环的过程尚不清楚[29]。
表4鼠尾藻岩藻黄素含量与其他褐藻的比较
Tab.4ComparisonoffucoxathincontentbetweenbrownalgaSargassumthunbergiiandotherbrownseaweeds
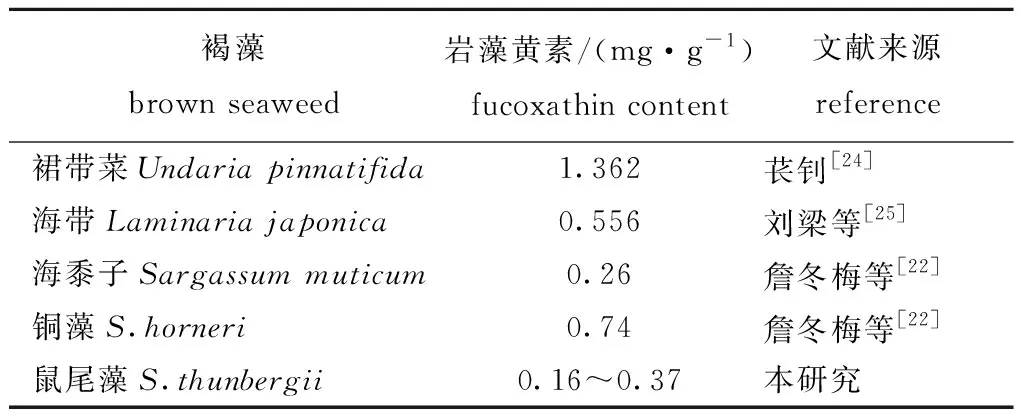
褐藻brown seaweed岩藻黄素/(mg·g-1)fucoxathin content文献来源reference裙带菜Undaria pinnatifida1.362苌钊[24]海带Laminaria japonica0.556刘梁等[25]海黍子Sargassum muticum0.26詹冬梅等[22]铜藻S.horneri0.74詹冬梅等[22]鼠尾藻S.thunbergii0.16~0.37本研究
4 结论
(1)鼠尾藻在荣成海区全年可见,其生长具有明显的季节性变化,高温期只有从盘状固着器发出的嫩枝能够存活下来,生长最快的时期在5—7月,同一时期潮位低的鼠尾藻长度较长,生物量也较大,干露可能对鼠尾藻生长作用不大,但潮下带3 m以下水深较难见到鼠尾藻分布,这可能与鼠尾藻对光线的需求较高有关。
(2)鼠尾藻中褐藻胶含量比较高,且在生长快速的6月份含量最高;但岩藻黄素变化趋势正好相反,在12月份显著高于6月份。研究表明,月份变化对鼠尾藻体的褐藻胶、岩藻黄素、褐藻多酚含量影响远大于不同潮位对这3种组分的影响。
