玉米MATE基因在植物生长发育和下胚轴伸长中的调控作用
2018-07-24薛盛祥
薛盛祥,贾 敏,郁 飞
(西北农林科技大学 生命科学学院,陕西 杨凌 712100)
多药及有毒化合物外排家族(multidrug and toxic compound extrusion,MATE)蛋白是具有高保守性的阳离子次级转运蛋白,古细菌、细菌和真核生物中都存在该蛋白家族[1]。MATE蛋白依赖H+或Na+形成的跨膜电化学动力势能,以主动运输方式转运细胞内小分子化合物[2]。植物中MATE蛋白分布广泛,在模式植物拟南芥中已发现有56个MATE家族蛋白[3]。在植物中的研究发现,MATE蛋白参与众多生理功能,包括次级代谢产物生物碱和类黄酮等的积累[4-6]、铁离子运输[7-8]、抗铝毒胁迫[9]、病原体抗性[10-11]、重金属抗毒性[12]、植物器官发生[13-14]等。随着对MATE蛋白家族研究的深入,越来越多的MATE蛋白被发现,但是对于MATE蛋白家族的功能了解却非常有限。在玉米中已报道的MATE家族蛋白有ZmMATE1和ZmMATE2,二者参与玉米抗铝毒作用[15],MATE转运蛋白BIGE1参与玉米器官发生和器官大小的调控[16]。目前对玉米中MATE家族蛋白的研究还很少,而玉米是我国最重要的粮食、饲料和工业原料作物之一,MATE家族蛋白参与了植物生长阶段的诸多生理功能调控,所以对玉米MATE家族蛋白的研究意义重大。
玉米全基因组测序在2009年已经完成[17],为玉米基因的研究提供了极大便利。Suzuki等[16]在2015年发现,玉米MATE转运蛋白BIGE1功能缺失会导致植株叶片和根的发生速率加快,并且使玉米种子胚盾片增大。而BIGE1在拟南芥中的高度同源蛋白ABS3的过表达突变体abs3-1D,也表现出叶片发生速率加快表型[18]。两个高度同源的MATE蛋白在各自所属物种中对于叶片的发生速率分别产生了相反的影响,这在以往的研究中是很少见的。由于ZmMATE884蛋白部分定位于高尔基体/内体,猜测玉米MATE蛋白还可能参与了内膜运输过程或细胞内信号传导途径[19-21]。因此,本研究以玉米BIGE1高度同源基因ZmMATE884为对象,探讨ZmMATE884(GRMZM2G423884)在植物生长发育阶段的功能,以期为玉米MATE家族蛋白的研究提供新思路和新方向。
1 材料与方法
1.1 植物材料
拟南芥野生型为Columbia(Col)生态型,abs3-1D拟南芥突变体由西北农林科技大学生命科学学院郁飞教授提供,玉米组织材料取自玉米(Zeamays)自交系B73。
1.2 玉米DNA的提取和基因克隆
采用CTAB法提取玉米B73植株叶片总基因组DNA。从MaizeGDB数据库下载得到玉米ZmMATE884基因,发现该基因不具有内含子,因此设计引物(表1)直接以玉米基因组DNA为模板进行PCR反应。PCR反应程序为:98 ℃ 10 s,53 ℃ 15 s,72 ℃ 2 min 40 s,40个循环。PCR反应体系50 μL:5×Primer STAR Buffer 10 μL,2.5 mmol/L dNTP Mix 4 μL,DMSO 5 μL,正向、反向引物各1 μL, gDNA 1 μL,Primer STAR DNA聚合酶0.5 μL,蒸馏水27.5 μL。PCR产物经0.8%琼脂糖凝胶电泳后切胶回收,用XbaⅠ酶切后连接至pUC18HE-NGFP载体[22],由生物科技公司测序校对。
1.3 系统进化分析与蛋白同源性比对
从TAIR(https://www.Arabidopsis.org/)数据库下载56个已报道的拟南芥MATE转运蛋白家族成员的蛋白序列,再从MaizeGDB(http://www.maizegdb.org/)数据库下载得到玉米MATE转运蛋白家族ZmMATE877(GRMZM2G135877)、ZmMATE884(GRMZM2G423884)和ZmMATE937(GRMZM2G148937)的基因序列。采用邻接法,通过MEGA 6.0软件构建系统进化树。
运用EMBL数据库中的Clustal Omega程序(http://www.ebi.ac.uk/Tools/msa/clustalo/),将ZmMATE884、ZmMATE937与PfMATE[23]的蛋白序列进行多序列比对,之后使用ExPasy上的Box Shade(http://www.ch.embnet.org/software/BOX_form.html)工具进行修饰,将相同区域用黑色标出,相似区域用灰色标出。

表1 本研究所用引物及其序列Table 1 Primers and their sequences used in this article
1.4 玉米不同组织RNA的提取和基因表达分析
采用CTAB-PVP法提取玉米根、气根、茎、上枝叶、下枝叶、包叶、花穗、雌蕊、雄蕊、授粉后40 d胚、授粉后40 d胚乳3个生物学重复样本的总RNA。取5 μL RNA稀释100倍后测波长260 nm处吸光值A260,再将A260乘以4 000得到RNA质量浓度(ng/μL)。根据Transcriptor First Strand cDNA Synthesis Kit (Roche)操作说明书,吸取1 μg的RNA 进行反转录,由之前测得的RNA质量浓度计算所需要的RNA样品体积,以GAPDH基因为内参进行定量RT-PCR,从基因转录水平分析该基因的组织特异性表达模式,从而了解该基因的可能作用机制。
1.5 ZmMATE884和ZmMATE937蛋白的亚细胞定位
植物MATE转运蛋白大多定位于细胞液泡膜上[3,6],但近年来有较多研究认为MATE转运蛋白定位在细胞膜、内质网和叶绿体上[9,12,24]。为研究玉米MATE蛋白ZmMATE884和ZmMATE937在植物中的亚细胞定位,设计引物(表1)进行ZmMATE884和ZmMATE937基因全长ORF序列的克隆,再分别构建相应荧光蛋白融合表达载体,转化拟南芥叶肉细胞原生质体,利用原生质体瞬时表达系统对ZmMATE884和ZmMATE937蛋白进行亚细胞定位研究。为此,构建ZmMATE884和ZmMATE937蛋白C端融合绿色荧光蛋白瞬时表达载体P35S∷ZmMATE884-GFP和P35S∷ZmMATE937-GFP。将这2个融合表达载体分别与本实验室构建的亚细胞结构特异标志蛋白融合标签蛋白的瞬时表达载体,共转化野生型拟南芥的叶肉细胞原生质体[25],22 ℃孵育8~16 h后利用激光共聚焦显微镜观察荧光信号。本研究进行如下共转化试验:P35S∷ZmMATE884-GFP与P35S∷mCherry-ARA7,P35S∷ZmMATE937-GFP与P35S∷m-Cherry-ARA7,P35S∷ZmMATE884-GFP与P35S∷mCherry-RabA5d,P35S∷ZmMATE937-GFP与P35S∷mCherry-RabA5d,P35S∷ZmMATE884-GFP与P35S∷mCherry-RabD2a。
1.6 拟南芥ZmMATE884基因过表达转基因系的建立
在与ZmMATE884属于同一进化分支的9个拟南芥MATE蛋白中,已报道ABS3(At4g29140)、ABS4(At1g58340)、ABS3L1(At5g19700)和ABS3L2(At5g52050)基因过表达株系均表现为叶片发生速率加快、植株矮化丛生[18]。由于该分支4个基因的过表达都对植物产生了相似影响,且ZmMATE884基因同属于这一分支,为研究该基因是否也具有相似功能,克隆ZmMATE884基因的全长ORF序列,利用二元表达载体pBI111L[22]构建含3个强CaMV 35S启动子且融合玉米ZmMATE884基因的二元表达载体。然后将构建得到的重组二元表达载体电转化农杆菌GV3101,利用农杆菌蘸花侵染法侵染野生型拟南芥植株。将转基因T1代种子经体积分数75%乙醇和50%的84消毒液加0.1% Triton-X100消毒处理后,蒸馏水漂洗干净,4 ℃黑暗冷处理3 d后于Kan+抗性的MS培养基上筛选转基因植物,7 d后将具有Kan抗性的植株移栽于营养土中生长,收获T2代种子。T2代转基因植株矮化丛生,因此以矮化丛生为表型鉴定标准,再经多代自交表型鉴定后收取T5代表型不分离转基因株系种子,从而得到ZmMATE884基因的过表达转基因株系。
分别取生长2周的野生型和ZmMATE884过表达系1~3号整株植株样品,参照Invitrogen公司的Trizol试剂盒RNA提取说明书进行拟南芥植株RNA提取。采用1.4节方法检测RNA样品质量浓度,根据Transcriptor First Strand cDNA Synthesis Kit (Roche)操作说明书,吸取1 μg RNA 进行反转录。采用ACTⅡ基因作内参进行半定量RT-PCR,鉴定转基因株系是否有ZmMATE884基因表达。
1.7 各基因型拟南芥幼苗下胚轴表型观测
玉米MATE蛋白ZmMATE884的高度同源蛋白ABS3参与调控植物下胚轴伸长[18],为进一步研究分析玉米MATE转运蛋白在生长发育过程中的功能,选取ABS3蛋白的对应过表达株系abs3-1D作为共同试验对象,观察ZmMATE884基因过表达对植物下胚轴伸长的影响。将WT、abs3-1D和ZmMATE884基因过表达系植物种子装于1.5 mL 离心管内,经消毒处理后用蒸馏水反复漂洗,再将种子悬于蒸馏水中4 ℃黑暗处理3 d。3 d后将种子分别种植在含质量分数1%蔗糖或无蔗糖的1/2 MS固体培养基上,22 ℃、100 μmol/(m2·s)持续光照1 h后,将培养皿用铝箔纸包裹,放入封闭纸盒22 ℃竖直培养,在黑暗培养6 d后取出拍照,记录表型并观察下胚轴生长情况。光下植物下胚轴表型的观察,则是在种子种于固体培养基后用封口膜密封培养皿,然后于22 ℃、100 μmol/(m2·s)持续光照培养7 d,拍照记录表型。使用Image J 软件测量照片中植物下胚轴长度,采用t检验法对不同基因型植物的下胚轴长进行统计学分析。
2 结果与分析
2.1 ZmMATE884蛋白系统进化分析与同源性比对
由图1可以看出,ZmMATE877、ZmMATE884和ZmMATE937与拟南芥MATE转运蛋白家族具有很高的同源性,与其中9个拟南芥MATE蛋白属于同一个进化分支,具有较近的亲缘关系。
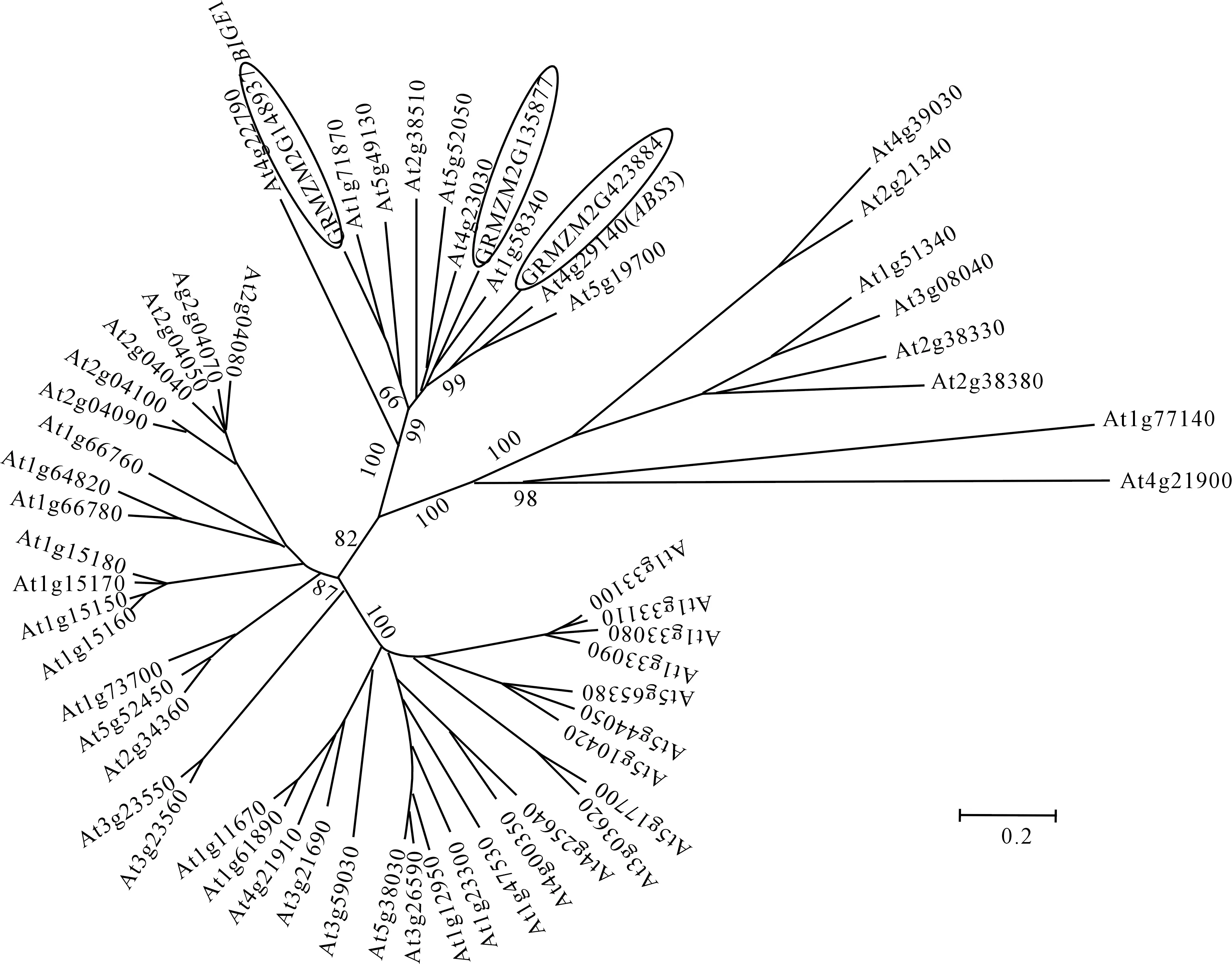
椭圆形中分别为ZmMATE877(GRMZM2G135877)、ZmMATE884(GRMZM2G423884)和ZmMATE937(GRMZM2G148937)在56个拟南芥MATE蛋白家族中的位置,比例尺表示氨基酸替换率Oval circle shows the positions of ZmMATE877 (GRMZM2G135877),ZmMATE884 (GRMZM2G423884) and ZmMATE937 (GRMZM2G148937) in the 56 Arabidopsis MATE proteins family,and the scale shows amino acid replacement rate图1 ZmMATE877,ZmMATE884和ZmMATE937与拟南芥MATE转运蛋白家族的进化树Fig.1 Phylogenetic tree of ZmMATE877,ZmMATE884 and ZmMATE937 with Arabidopsis MATE transporter family
蛋白同源比对结果(图2)表明,ZmMATE884与ZmMATE937有很高的同源性,且二者与PfMATE[23]相似度均较高,故可由PfMATE蛋白的跨膜结构域推测ZmMATE884和ZmMATE937的可能跨膜结构域。
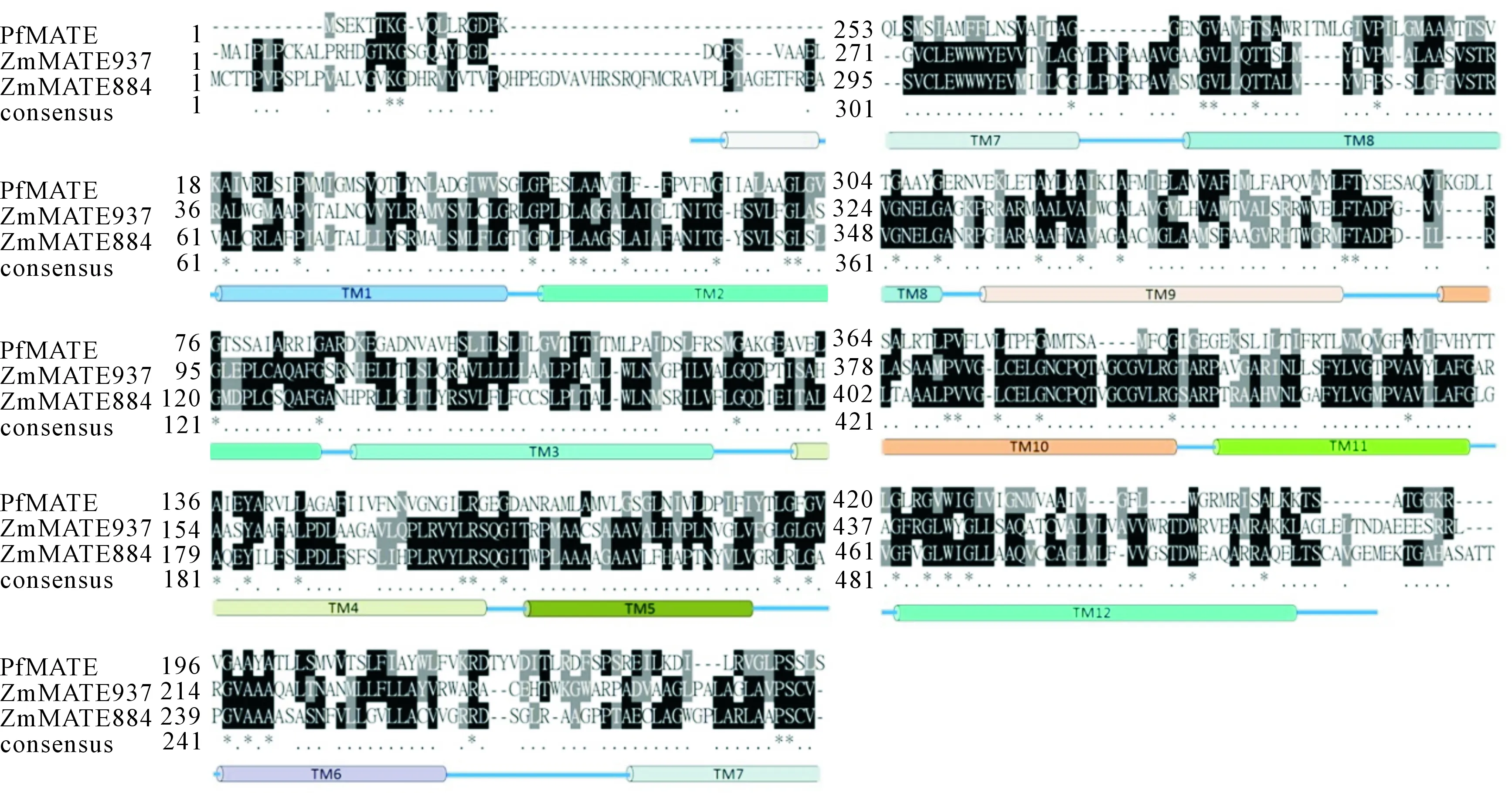
“consensus”一行表示蛋白之间氨基酸的相似度,部分相似用“.”表示,全部相同用“*”表示The “consensus” line represents the amino acid similarity between proteins,“.” stands for partially similar,“*” stands for completely same图2 ZmMATE884、ZmMATE937与PfMATE的蛋白同源比对及跨膜结构域预测Fig.2 Homologous alignment of ZmMATE884 and ZmMATE937 with PfMATE protein and transmembrane domains prediction
2.2 ZmMATE884基因在玉米不同组织中的表达
以GAPDH基因作为内参进行定量PCR分析,由图3可见,ZmMATE884基因在玉米根、下枝叶、上枝叶和胚的相对表达量较高,表明该基因可能参与了玉米生长发育过程中根、枝叶及授粉后胚的生长发育调控。
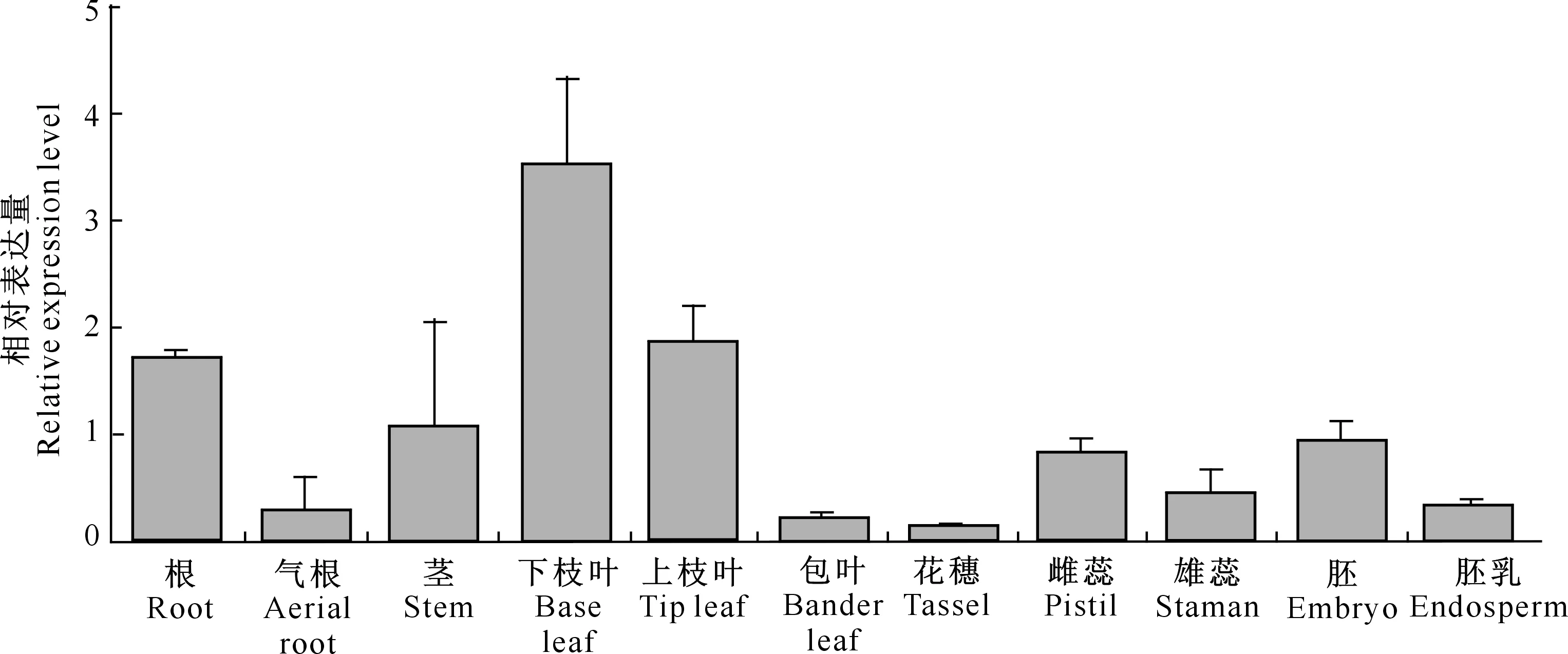
图3 ZmMATE884基因在玉米B73植株不同组织中的表达Fig.3 Expression of ZmMATE884 gene in different tissues of maize B73
2.3 ZmMATE884蛋白的亚细胞定位
亚细胞定位结果(图4)显示,ZmMATE884-GFP和ZmMATE937-GFP在细胞中的荧光信号为小点状离散分布于细胞的大部分区域;ZmMATE937-GFP不能与原液泡/次级内体标志蛋白mCherry-ARA7[26]共定位(图4-A),但可以和内体/再循环内体特异标志蛋白mCherry-RabA5d[26]部分共定位(图4-B);ZmMATE884-GFP既不能与原液泡/次级内体标志蛋白mCherry-ARA7[26]共定位(图4-C),也不能与内体/再循环内体特异标志蛋白mCherry-RabA5d[26]共定位(图4-D);ZmMATE-884-GFP可与高尔基/内体上的标志蛋白mCherry-RabD2a[26]部分共定位(图4-E)。上述结果表明,ZmMATE884和ZmMATE937分别定位于内体形成运输过程中不同阶段的内体结构上。由此推测ZmMATE884和ZmMATE937蛋白可能参与细胞内膜系统运输过程,同时也参与着依赖胞吞机制的物质代谢过程[19-21]。
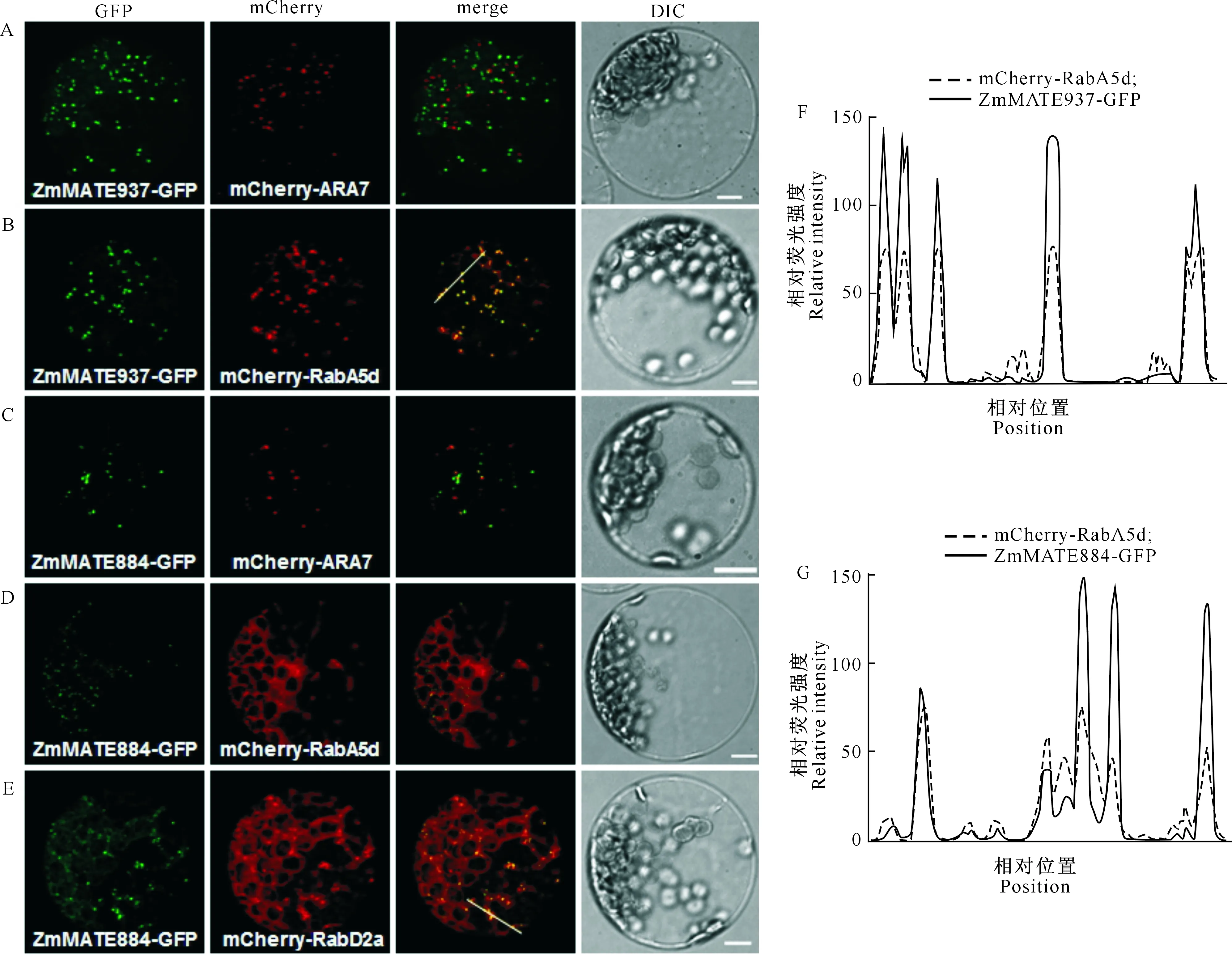
A.ZmMATE937-GFP和mCherry-ARA7瞬时转化野生型拟南芥叶肉细胞原生质体;B.ZmMATE937-GFP和mCherry-RabA5d瞬时转化野生型拟南芥叶肉细胞原生质体;C.ZmMATE884-GFP和mCherry-ARA7瞬时转化野生型拟南芥叶肉细胞原生质体;D.ZmMATE884-GFP和mCherry-RabA5d瞬时转化野生型拟南芥叶肉细胞原生质体;E.ZmMATE884-GFP和mCherry-RabD2a瞬时转化野生型拟南芥叶肉细胞原生质体;F和G.分别为在merge 图B、E 中,白线经过的像素点上绿色和红色荧光信号强度的量化图。图中‘GFP’一列是绿色荧光信号;‘mCherry’一列是红色荧光信号;‘merge’一列是绿色与红色荧光信号叠加效果;‘DIC’一列是明场视野下的原生质体。图中展示均为单个原生质体细胞A.Transient co-expression of ZmMATE937-GFP and mCherry-ARA7;B.Transient co-expression of ZmMATE937-GFP and mCherry-RabA5d;C.Transient co-expression of ZmMATE884-GFP and mCherry-ARA7;D.Transient co-expression of ZmMATE884-GFP and mCherry-RabA5d;E.Transient co-expression of ZmMATE884-GFP and mCherry-RabD2a;F,G.Co-localization analysis plots for merged images in B and E,respectively.Plots were generated by tracking the relative intensities of GFP and mCherry fluorescent signals marked by white lines in merged images using the ‘plot profile’ function of ImageJ.In the figure,the ‘GFP’ column is a green fluorescent signal,the ‘mCherry’ column is a red fluorescent signal,the ‘merge’ column is a green and red fluorescent signal superimposed effect,and the ‘DIC’ is bright field view of the protoplasts.All are for a single protoplast cell图4 ZmMATE884和ZmMATE937在拟南芥叶肉细胞中的亚细胞定位Fig.4 Subcellular localization of ZmMATE884 and ZmMATE937 in Arabidopsis mesophyll cell
2.4 ZmMATE884过表达转基因拟南芥植株的表型及半定量RT-PCR
由表型观察可知,ZmMATE884过表达转基因拟南芥植株莲座叶发生速率较野生型快,在野生型只有6片真叶时,过表达系已经长出7片真叶。同时,ZmMATE884过表达植株开花时间较野生型明显提前(图5-A,B)。半定量RT-PCR结果显示,野生型植株中ZmMATE884基因无表达,而过表达转基因植株中ZmMATE884基因有明显表达(图5-C)。另外,ZmMATE884过表达系1号、2号、3号的开花时间存在一定差异(图5-A),推测这可能与农杆菌介导的T-DNA插入转基因植物中目的基因表达不稳定及T-DNA插入位点有差异有关。上述结果表明,玉米MATE蛋白家族基因ZmMATE884在拟南芥中的过表达,可使植物生长发育速率加快,开花提前,与已经报道的ABS3基因过表达突变体有相似特征[18],说明玉米ZmMATE884基因参与了植物生长发育的调控。
2.5 ZmMATE884基因过表达植株的下胚轴表型
2.5.1 参与黑暗中下胚轴伸长的负调控 在固体培养基上黑暗培养6 d,不同基因型植物萌发后下胚轴的伸长情况见图6。
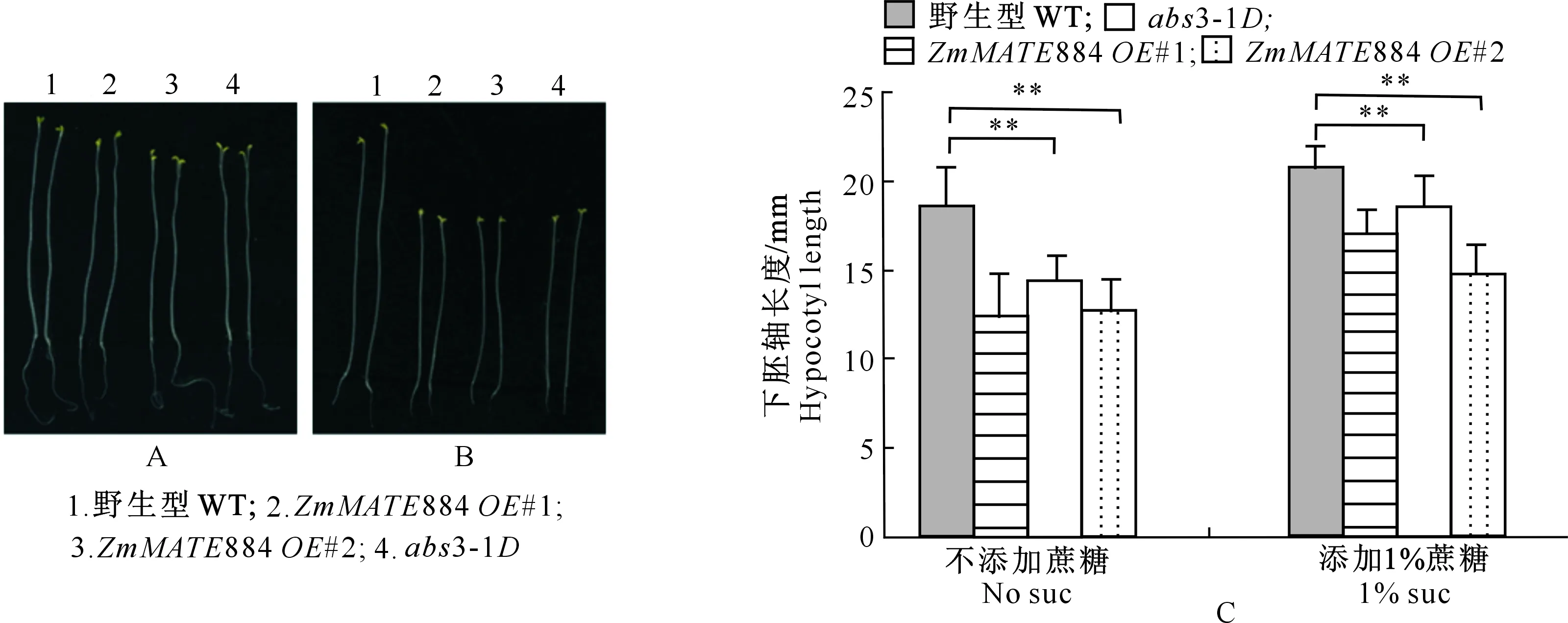
A.添加质量分数1%蔗糖1/2 MS培养基上黑暗生长6 d的野生型(WT)、abs3-1D和ZmMATE884基因的2个独立过表达系表型;B.不添加蔗糖1/2 MS培养基上黑暗生长6 d的野生型(WT)、abs3-1D和ZmMATE884基因的2个独立过表达系表型;C.分别在不添加蔗糖和添加添加质量分数1%蔗糖1/2 MS固体培养基中黑暗生长6 d的野生型(WT)、abs3-1D和ZmMATE884基因2个独立过表达系下胚轴的平均长度。利用t检验进行显著性分析(n≥30),“**”表示P≤0.001A.Phenotypes of WT,abs3-1D and ZmMATE884 overexpressing lines grown on the 1/2 MS solid medium supplemented with 1% sucrose for 6 days in the dark;B.Phenotypes of WT,abs3-1D and ZmMATE884 overexpressing lines grown on the 1/2 MS solid medium without sucrose for 6 days in the dark;C.The average hypocotyls lengths of WT,abs3-1D and ZmMATE884 gene two independent overexpressing lines grown in 1/2 MS solid medium in the dark for 6 days.Using t test for significant analysis (n≥30),“**”stands for P≤0.001图6 野生型、ZmMATE884基因过表达转基因拟南芥植株与abs3-1D在黑暗条件下生长6 d后的下胚轴表型Fig.6 Hypocotyl type of wild type,ZmMATE884 gene overexpression transgenic Arabidopsis plants and abs3-1D in the dark for 6 days
由图6可以看出,在不添加蔗糖的1/2 MS培养基上,黑暗环境下生长的转基因植物的下胚轴长度明显短于野生型,表明其下胚轴的伸长受到抑制(图 6-B,C)。在添加1%蔗糖的1/2 MS培养基上,黑暗环境中生长的转基因植物的下胚轴长度较不添加蔗糖时的显著增长,但低于野生型(图 6-A,C)。上述结果表明,在黑暗环境下,ZmMATE884基因过表达会抑制植物下胚轴的伸长,添加外源蔗糖可以促进下胚轴伸长,但与野生型相比,过表达系植株下胚轴伸长仍然受到明显抑制。
2.5.2 参与光下下胚轴伸长的负调控 野生型、abs3-1D和ZmMATE884过表达系1号、2号植物光下生长7 d后下胚轴的伸长情况见图7。由图7可以看出,在不添加蔗糖的1/2 MS培养基上,光下生长的转基因植物的下胚轴伸长较野生型明显受到抑制(图 7-A,C)。与无糖培养基相比,在添加1%蔗糖的1/2 MS培养基上生长的转基因植物及野生型的下胚轴长度有所增长,但转基因植物下胚轴伸长与野生型相比仍然受到抑制(图 7-B,C)。上述结果表明,在光下生长时,ZmMATE884过表达植物下胚轴伸长受到抑制,添加外源蔗糖可以促进下胚轴伸长,但与野生型相比,过表达系植株下胚轴伸长仍受到明显抑制。
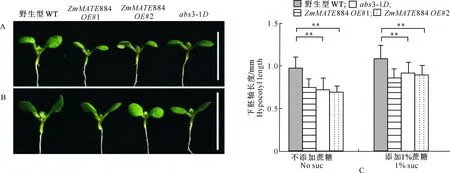
A.添加质量分数1%蔗糖1/2 MS培养基上光下生长7 d的野生型(WT)、abs3-1D和ZmMATE884基因的2个独立过表达系表型;B.不添加蔗糖1/2 MS培养基上光下生长7 d的野生型(WT)、abs3-1D和ZmMATE884基因的2个独立过表达系表型;C.分别在不添加蔗糖和添加质量分数1%蔗糖1/2 MS固体培养基中光下生长7 d的野生型(WT)、abs3-1D和ZmMATE884基因2个独立过表达系下胚轴的平均长度。利用t检验进行显著性分析(n≥30),“**”表示P≤0.001。A,B中标尺为5 000 μmA.Phenotypes of WT,abs3-1D and ZmMATE884 overexpressing lines grown on the 1/2 MS solid medium supplemented with 1% sucrose for 7 days under constant light;B.Phenotypes of WT,abs3-1D and ZmMATE884 gene two independent overexpressing lines grown on the 1/2 MS solid medium without sucrose for 7 days under constant light;C.The average hypocotyls lengths of WT,abs3-1D and ZmMATE884 overexpressing lines grown in 1/2 MS solid medium for 7 days under constant light.The histogram shows the average “length±standard” deviation.Using t test for significant analysis (n≥30),“**”stands for P≤0.001.A,B.Bars:5 000 μm图7 野生型、ZmMATE884基因过表达转基因拟南芥植株与abs3-1D在光下生长7 d后的下胚轴表型Fig.7 Hypocotyl type of wild type,ZmMATE884 overexpression Arabidopsis transgenic plants and abs3-1D under constant light for 7 days
3 讨论与结论
阳离子次级转运MATE家族蛋白最早是在副溶血弧菌和大肠杆菌多药外排蛋白鉴定中得到的,主要参与小分子化合物的跨膜转运[27-28]。MATE普遍存在于细菌和真核生物中,随着越来越多的MATE家族蛋白成员被鉴定,对于该家族蛋白的了解也逐步加深,但绝大多数MATE蛋白的功能仍不明确。在植物中,以拟南芥MATE蛋白的研究最为突出,如TT12基因参与花青素积累[29]、ALF5基因参与植物侧根发育[30]、FRD3基因参与铁离子运输[31]等。而对于玉米MATE家族蛋白的研究较少,目前只有关于ZmMATE1和ZmMATE2基因参与玉米抗铝毒作用[15]、BIGE1基因参与玉米器官发生和器官大小的调控[16]等少数研究报道。
本研究从MaizeGDB数据库中得到玉米MATE家族蛋白基因ZmMATE884(GRMZM2G423884)的序列,将该基因克隆后建立了拟南芥ZmMATE884基因过表达转基因株系,对转基因植物的表型分析发现,ZmMATE884基因过表达可导致植物莲座叶发生速率加快、开花提前,说明该基因参与植物多个生长发育阶段的调控,可以缩短植物的整个生长周期。半定量PCR结果表明,该基因在根、下枝叶和上枝叶中均有较高表达,推测该基因可能参与了玉米生长发育过程中根、枝叶的生长发育。通过与拟南芥56个MATE蛋白的系统进化分析,由MATE高保守性的特点,应用蛋白同源比对初步预测了ZmMATE884蛋白的可能跨膜结构域。
亚细胞定位分析发现,ZmMATE884蛋白部分定位于高尔基体/内体上,推测该蛋白可能参与细胞内膜系统的运输过程,或参与依赖胞吞机制的物质代谢过程,为玉米MATE蛋白的研究提供了新思路、新方向。对ZmMATE884蛋白转基因植物在固体培养基中下胚轴长度表型的观察结果表明,ZmMATE884基因参与了植物下胚轴的负调控。植物激素如生长素可以调控下胚轴伸长[32],而以高尔基体、内质网和内体等组成的植物内膜系统在物质运输,如生长素运输中起重要作用,进而影响细胞伸长等生长发育过程[33-36]。本研究表明,ZmMATE884蛋白部分定位于高尔基体/内体上,且ZmMATE884基因参与植物下胚轴伸长的负调控,推测该基因可能影响了植物激素的合成、运输、应答过程中的某一环节,从而调控植物下胚轴发育。今后应进一步研究ZmMATE884转基因植物下胚轴伸长的抑制机理,分析转基因植物中各植物激素的变化,以深入探讨玉米MATE基因对植物生长发育调控的可能分子机制。
