青蒿琥酯对肝癌细胞生长的抑制作用及其机制
2018-07-24刘亮刘江惠陈乐彤巨英超王静周荣秒黄茜霍向然田芸婕
刘亮,刘江惠,陈乐彤,巨英超,王静,周荣秒,黄茜,霍向然,田芸婕
肝癌是较常见的消化道恶性肿瘤,发病率和病死率高,预后较差,尽管肝癌的治疗方法包括手术、介入治疗及放化疗等综合治疗,但5年生存率仍然很低[1-2]。寻找高效低毒的抗肝癌药物具有重要意义,尤其对于晚期肝癌不能手术的患者意义重大。青蒿琥酯(artesunate,ART)是我国经典的抗疟药物[3-4],尤其对于重型及耐药型疟疾患者具有较好的疗效[5-7]。研究显示,青蒿琥酯还具有抗肿瘤的特性[8-10]。本课题小组前期研究提示青蒿琥酯对食管癌及胃癌细胞具有生长抑制作用[11-14],但其对肝癌的生长抑制作用尚未见报道,本研究探讨青蒿琥酯对肝癌细胞生长的抑制作用及其相关机制。
1 材料与方法
1.1 主要试剂及仪器 注射用青蒿琥酯(60mg,批号:LA150444)购自桂林南药股份有限公司。Annexin V-FITC/PI双染检测凋亡试剂盒(LOT:I1711-W481Z)购自美国Beckman Coulter公司。碘化丙啶(LOT:5338528)购自美国BD公司。FC500型流式细胞仪,美国Beckman Coulter公司。
1.2 MTT法检测青蒿琥酯对SMMC-7721细胞的生长抑制作用 收集处于对数生长期的SMMC-7721细胞,调整细胞浓度至1×104个/ml,将SMMC-7721细胞接种于96孔细胞培养板中,贴壁后弃培养液,分别加入不同浓度的青蒿琥酯(0.1、0.5、1、5、10、50、100、200、400、800μg/ml),阴性对照组加入等体积生理盐水,反应总体积200μl/孔,另设空白对照孔,只加培养液,每个药物剂量均设3个复孔,作用24h后,弃去培养液,每孔加入MTT溶液(5mg/ml)20μl、培养液180μl,继续孵育4h后终止培养,弃去培养液,每孔加入180μl DMSO,振荡10min。选择490nm波长,以空白孔调零,在酶标仪上测定各孔光密度(A)值A490,按下列公式计算生长抑制率。生长抑制率(IR,%)=(1-用药组A490/对照组A490)×100%。
1.3 细胞实验分组及药物干预 人肝癌细胞株SMMC-7721本实验室传代培养。接种细胞于含10%胎牛血清的PRMI 1640培养基(补充青霉素、链霉素各100U/L)中常规培养。取对数生长期的SMMC-7721细胞按5×106密度接种至细胞培养瓶中,待细胞贴壁后,将其分为对照组及30、60、120μg/ml ART组,对照组使用生理盐水,ART组则加入不同浓度的青蒿琥酯,使其终浓度分别达到30、60、120μg/ml,作用24h后,收集细胞,PBS液洗涤2次,300目尼龙网过滤制备成合格的单细胞悬液,调整细胞浓度为1×106/ml。每组实验重复3次。
1.4 倒置显微镜观察青蒿琥酯作用后的SMMC-7721细胞形态 30、60、120μg/ml ART及生理盐水作用SMMC-7721细胞24h后,利用倒置显微镜观察细胞形态并拍照。
1.5 流式细胞术检测细胞凋亡 取上述制备的单细胞悬液1ml(含1×106细胞),冷PBS洗涤1次;加入100μl冷1×结合缓冲液悬浮细胞,10μl Annexin V-FITC,4℃避光放置15min;再加入380μl 1×结合缓冲液,10μl PI染液,4℃避光放置15min;冷PBS洗涤细胞1次,流式细胞仪检测。
1.6 流式细胞术检测线粒体膜电位 取上述制备的单细胞悬液1ml(含1×106细胞),冷PBS洗涤细胞1次;100μl PBS液悬浮细胞,加入罗丹明123(Rhodamine123,Rho 123)染料,使最终浓度达到10μg/ml,于37℃下避光平衡30min;PBS洗涤细胞1次,流式细胞仪检测。以平均荧光强度表示细胞线粒体膜电位水平。
1.7 流式细胞术检测细胞周期分布 取上述制备的单细胞悬液1ml(含1×106细胞),冷PBS洗涤1次;加入碘化丙啶染液1ml,4℃避光染色30min;以500目铜网过滤,使样品成为合格的单细胞悬液,流式细胞仪检测。细胞增殖状态以增殖指数表示,增殖指数=(S+G2/M)/(G0/G1+S+G2/M)×100%。
1.8 流式细胞术检测细胞蛋白表达 取上述制备的单细胞悬液1ml(含1×106细胞),冷PBS洗涤1次;100μl PBS液悬浮细胞,分别向其中加入Bcl-2及Bax抗体100μl,室温放置30min;PBS洗涤,100μl PBS液悬浮细胞,分别向其中加入FITC标记的二抗100μl,室温避光放置30min;PBS洗涤,1ml PBS液悬浮细胞,流式细胞仪检测细胞中Bcl-2/Bax蛋白表达,以平均荧光强度(MFI)表示。
1.9 统计学处理 采用SPSS 11.5软件进行统计分析。结果以表示,多组样本均数间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 MTT法检测青蒿琥酯抑制肝癌SMMC-7721细胞生长 不同浓度青蒿琥酯作用SMMC-7721细胞24h后,SMMC-7721细胞呈现出不同程度的生长抑制,且随着青蒿琥酯浓度的增加,SMMC-7721细胞生长抑制作用越来越明显,具有剂量依赖性(图1)。青蒿琥酯作用SMMC-7721细胞24h的IC50=(60.27±1.51)μg/ml。
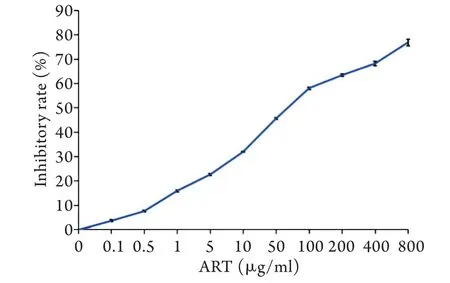
图1 青蒿琥酯作用24h后肝癌SMMC-7721细胞的生长抑制率 (MTT,n=3)Fig.1 Inhibition rate of SMMC-7721 cells after treatment with artesunate (MTT, n=3)
2.2 倒置显微镜观察青蒿琥酯干预后的SMMC-7721细胞形态变化 青蒿琥酯作用SMMC-7721细胞24h后,倒置显微镜下观察细胞形态,结果显示,对照组SMMC-7721细胞贴壁生长良好,细胞形态正常,细胞呈菱形或梭形,排列紧密,未见明显的死亡细胞及漂浮的细胞。ART组呈现出不同程度的死亡SMMC-7721细胞及漂浮细胞,可见贴壁细胞中出现不同程度死亡细胞,细胞形态更不规则,出现大量碎裂及变圆的细胞,随着青蒿琥酯浓度的增加可见死亡细胞及漂浮细胞增多(图2)。
2.3 青蒿琥酯作用下SMMC-7721细胞凋亡水平 流式细胞术检测结果显示,30、60、120μg/ml ART作用SMMC-7721细胞24h,细胞凋亡率(分别为4.44%±0.32%、6.54%±0.84%、12.92%±1.22%)与对照组(2.15%±0.10%)比较明显增加,差异有统计学意义(P<0.01);120μg/ml ART组细胞凋亡率明显高于30μg/ml及60μg/ml ART组(P<0.01,图3)。

图2 青蒿琥酯作用下肝癌SMMC-7721细胞形态(倒置显微镜 ×200)Fig.2 Morphology of SMMC-7721 cells after treatment with artesunate (Inverted microscope ×200)
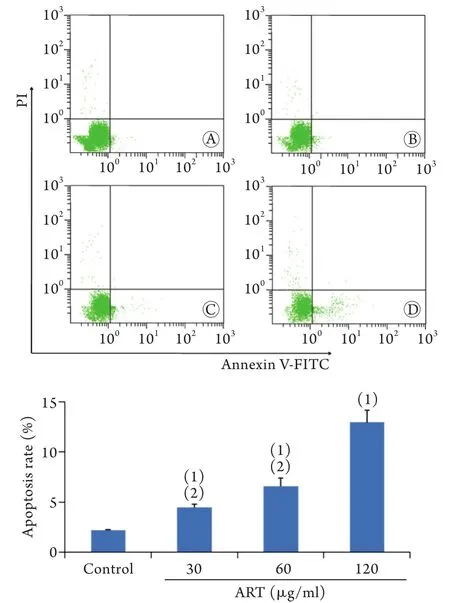
图3 青蒿琥酯作用下肝癌SMMC-7721细胞凋亡率(流式细胞术,n=3)Fig.3 Apoptotic rate of SMMC-7721 cells after treatment with artesunate (Flow cytometry, n=3)
2.4 青蒿琥酯作用下SMMC-7721细胞线粒体膜电位水平 流式细胞术检测结果显示,30、60、120μg/ml ART作用SMMC-7721细胞24h,细胞线粒体膜电位水平(分别为244.36±3.27、229.51±4.74、173.17±6.93)与对照组(277.82±5.68)比较明显降低,差异有统计学意义(P<0.01);且120μg/ml组细胞线粒体膜电位水平明显低于30μg/ml及60μg/ml ART组(P<0.01,图4)。
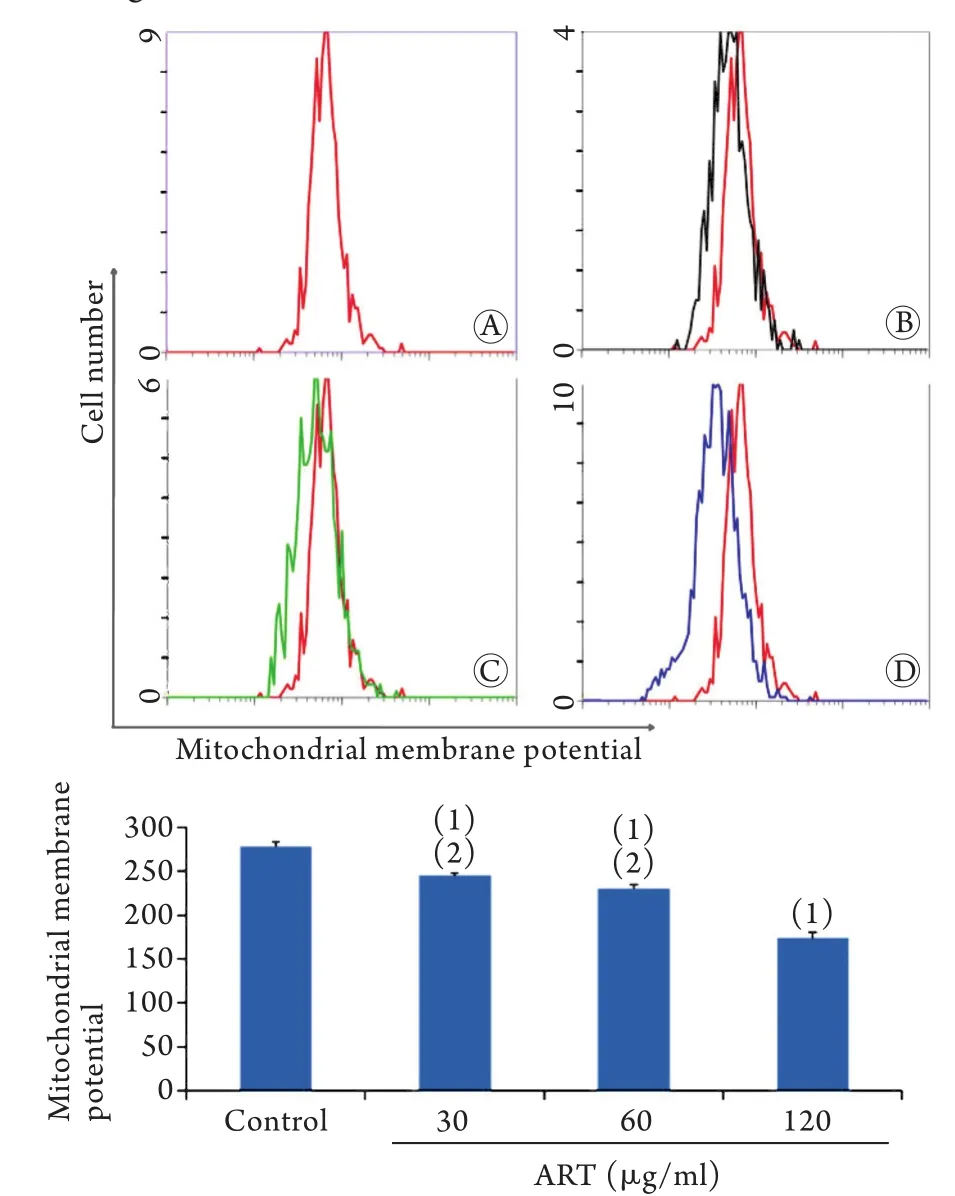
图4 青蒿琥酯作用下肝癌SMMC-7721细胞线粒体膜电位水平(流式细胞术,n=3)Fig.4 Mitochondrial membrane potential of SMMC-7721 cells after treatment with artesunate (Flow cytometry, n=3)
2.5 青蒿琥酯作用下SMMC-7721细胞周期及增殖指数的变化 流式细胞术检测结果显示,30、60、120μg/ml ART作用SMMC-7721细胞24h,细胞周期中处于G0/G1期细胞比例(分别为74.91%±0.69%、77.14%±1.39%、78.62%±0.55%)与对照组(70.60%±0.60%)比较明显增加,差异有统计学意义(P<0.01,图5)。120μg/ml组G0/G1期细胞比例明显高于30μg/ml ART组(P<0.01)。30、60、120μg/ml ART作用SMMC-7721细胞24h,细胞增殖指数(分别为25.09%±0.69%、22.86%±1.39%、21.38%±0.55%)与对照组(29.40%±0.60%)比较明显降低,差异有统计学意义(P<0.01,图5)。120μg/ml ART组细胞增殖指数明显低于30μg/ml ART组(P<0.01)。
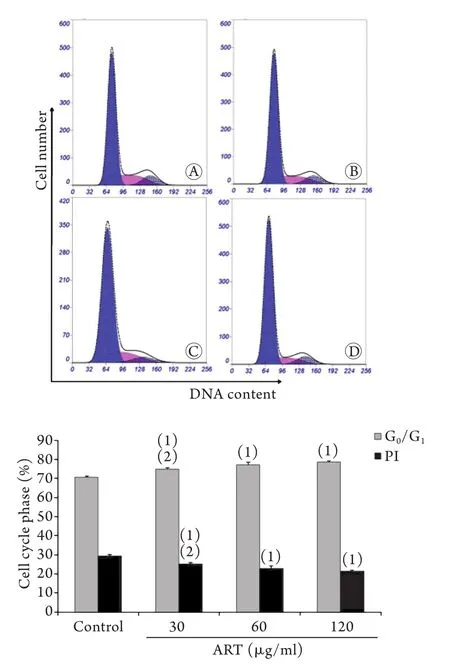
图5 青蒿琥酯作用下肝癌SMMC-7721细胞周期及增殖指数 (流式细胞术,n=3)Fig.5 Cell cycle and proliferation index of SMMC-7721 cells after treatment with artesunate (Flow cytometry, n=3)
2.6 青蒿琥酯作用下SMMC-7721细胞Bcl-2及Bax蛋白表达水平 流式细胞术检测结果显示,30、60、120μg/ml ART作用SMMC-7721细胞24h,Bcl-2蛋白表达量(分别为220.86±7.76、195.64±9.23、148.32±8.19)与对照组中Bcl-2蛋白表达量(256.86±7.78)比较明显降低,差异有统计学意义(P<0.01),且具有青蒿琥酯剂量依赖性。Bax蛋白表达量(分别为214.22±2.01、231.54±6.16、260.96±11.38)与对照组(186.21±8.82)比较明显增加,差异有统计学意义(P<0.01),亦具有青蒿琥酯剂量依赖性(图6)。
3 讨 论
肝癌是我国较常见的恶性肿瘤,发病及病死率较高,预后较差,严重威胁了人们的生命健康。肝癌死亡率居全国恶性肿瘤死亡率的第2位,发病率居恶性肿瘤的第3位[1]。目前,肝癌的综合治疗包括手术、介入治疗、放化疗等,但治疗效果不佳,5年生存率仍然很低[2]。寻找高效低毒的抗肝癌药物显得格外重要。中药治疗肿瘤具有悠久的历史,具有低毒副作用、价格低廉等优点。目前已有较多的肿瘤研究学者从中草药中寻找高效低毒的抗肿瘤药物,已有大量的研究显示多种中草药对肿瘤生长有抑制作用[15]。青蒿琥酯是我国经典的抗疟药物,尤其对于重型及耐药型疟疾具有较好的疗效[16-17]。进一步研究显示,青蒿琥酯除了抗疟作用外,还具有抗肿瘤活性,对多种肿瘤具有生长抑制作用[18-19]。本课题组在以往的研究中发现,青蒿琥酯对食管癌及胃癌具有生长抑制作用,其作用机制与调控细胞周期及诱导细胞凋亡有关[11-13]。但青蒿琥酯在肝癌中的研究鲜见报道,本研究利用细胞实验,研究青蒿琥酯对肝癌细胞的生长抑制作用及其相关机制,为青蒿琥酯作为广谱的抗肿瘤药物应用于临床提供了实验基础。

图6 青蒿琥酯作用下肝癌SMMC-7721细胞Bcl-2及Bax蛋白表达(流式细胞术,n=3)Fig.6 Expressions of Bcl-2 and Bax protein in SMMC-7721 cells after treatment with artesunate (Flow cytometry, n=3)
本研究应用不同浓度青蒿琥酯作用肝癌SMMC-7721细胞,采用MTT法检测青蒿琥酯对SMMC-7721细胞生长是否具有抑制作用,结果显示,青蒿琥酯对SMMC-7721细胞生长具有抑制作用且具有浓度依赖性。检测到青蒿琥酯作用SMMC-7721细胞24h的IC50为60.27±1.51μg/ml,依据此IC50浓度选择后续实验的3个青蒿琥酯浓度,分别为30、60、120μg/ml。
恶性肿瘤具有旺盛的增殖能力,细胞周期及细胞凋亡紊乱在恶性肿瘤的发生、发展中起重要作用,因此调控细胞周期及凋亡可以起到抑制肿瘤细胞生长的作用。不同浓度青蒿琥酯作用肝癌SMMC-7721细胞24h后,光镜下观察发现细胞出现不同程度死亡,形态变得更不规则,显示青蒿琥酯对SMMC-7721细胞具有杀伤作用,与MTT实验结果一致。此外,本研究采用流式细胞术检测发现,青蒿琥酯作用后,SMMC-7721细胞出现了不同程度的凋亡,且具有青蒿琥酯剂量依赖性,推测青蒿琥酯对SMMC-7721细胞的杀伤作用是通过诱导细胞凋亡而实现的。线粒体膜电位是内源性凋亡途径的关键因素,线粒体膜电位的降低可引起不可逆性凋亡发生。线粒体膜电位降低可引起细胞色素C等释放,释放的细胞色素C可以活化caspase蛋白酶家族,引起细胞凋亡级联反应,使细胞进入不可逆的凋亡过程。本研究检测到青蒿琥酯作用后引起SMMC-7721细胞线粒体膜电位的降低,且具有剂量依赖性。
B淋巴细胞瘤-2基因简称Bcl-2(B-cell lymphoma-2),是细胞凋亡研究中最受关注的调控因子。Bcl-2具有抑制细胞凋亡的作用,其作用机制与调控细胞线粒体膜电位水平有关。细胞色素C作为呼吸链中重要的电子传递体,它从线粒体内膜上的释放会阻断电子向下游传递,危及呼吸链的功能并导致超氧阴离子的加速产生,从而导致一系列的级联反应,引起不可逆性的细胞凋亡。Bcl-2可以抑制细胞色素C的释放,从而阻止细胞凋亡的发生。Bcl-2以线粒体作为靶细胞器,Bcl-2蛋白C端的疏水肽段能插入线粒体外膜,有大量的Bcl-2位于线粒体内外膜的接触位点,高表达Bcl-2能防止线粒体膜电位的耗散,稳定线粒体膜电位,抑制细胞色素C的释放,从而抑制细胞凋亡。Bax是Bcl-2家族中促凋亡因子,Bcl-2可与促凋亡因子Bax形成二聚体,如果Bax相对量高于Bcl-2,则Bax同二聚体的数量增多,从而促进细胞凋亡;如果Bcl-2相对量高于Bax,则促进形成Bcl-2/Bax异二聚体,并使Bcl-2同二聚体数量增多,则抑制细胞凋亡。本文中检测到青蒿琥酯作用后SMMC-7721细胞中Bcl-2蛋白表达水平下降,而Bax蛋白表达水平升高,促进了细胞凋亡,与细胞凋亡检测结果一致。
综上,青蒿琥酯对肝癌SMMC-7721细胞具有生长抑制作用,且呈剂量依赖性,其作用机制与调控细胞周期及诱导细胞凋亡有关。青蒿琥酯可以通过调控细胞中Bcl-2及Bax蛋白表达水平从而引起线粒体膜电位的降低,引起细胞凋亡。青蒿琥酯是青蒿素的衍生物,来源于植物黄花蒿,黄花蒿产于我国,来源广泛,价格低廉,如果能将青蒿琥酯开发为广谱的抗肿瘤药物,将会具有广泛的应用前景。
