桥本甲状腺炎对甲状腺微小乳头状癌的影响及相关因素分析
2018-07-24凌煜玮赵菁韩婧李开富康骅
凌煜玮 赵菁 韩婧 李开富 康骅
近年来桥本甲状腺炎(HT)发病率呈增高的趋势,Oh等[1]发现1999~2008年韩国HT的发病率男性增加4.1倍,女性增加2.0倍。甲状腺癌患者中有22.3%~58.3%合并HT[2-7]。但目前HT和甲状腺癌之间的相互影响仍存在争议,有研究者认为HT与甲状腺癌之间存在相互促进作用[8-9]。而另有研究者发现HT可以抑制甲状腺癌的转移和外侵,从而起保护作用[10-11]。近年来甲状腺微小乳头状癌(PTMC)逐渐成为临床研究热点,笔者见有关HT合并PTMC时有何特点的研究相对较少,故在本研究中探讨了HT对PTMC的影响及其与颈淋巴结转移的相关性。
对象与方法
一、研究对象
分析2014年1月至2016年12月我院收治的220例因PTMC(肿瘤最大径均不超过10 mm)接受手术治疗患者的临床资料,患者入院前均行高分辨率甲状腺超声检查,提示甲状腺内低回声结节,并评价颈部淋巴结情况,行细针穿刺活组织检查(活检),术前检测甲状腺功能及甲状腺球蛋白抗体(Tg-Ab)和甲状腺过氧化物酶抗体(TPO-Ab)水平,根据上述检查结果及术后病理报告将220例按下述标准分为HT组和非合并HT组。HT组入组标准为:①病理检查结果显示有HT特征性改变,包括甲状腺弥漫性造血单核细胞浸润,主要为淋巴细胞,可见淋巴滤泡形成,滤泡上皮细胞嗜酸性变;②术前TPO-Ab升高和(或)Tg-Ab升高;③术前超声提示甲状腺弥漫性回声减弱;④临床资料完整的病例。非合并HT组入组标准为:①术后病理证检查结果显示无HT特征性改变;②术前Tg-Ab和TPO-Ab均为阴性;③术前超声检查不支持HT诊断。2组患者既往均无其他甲状腺手术史,无颈部放射治疗史,无其他颌面部肿瘤病史。所有患者对手术均知情同意,本研究经我院医学伦理委员会批准。
二、手术方式
所有患者均行手术治疗,对于单侧肿瘤患者,术中于甲状腺被膜下注射纳米炭,取染色的喉前、气管前、患侧气管旁淋巴结行术中冰冻活检,若活检阴性,则行患侧甲状腺腺叶切除+峡部切除术,并行患侧Ⅵ区淋巴结清扫术;若淋巴结冰冻活检阳性,则行甲状腺全部切除术+双侧VI区淋巴结清扫术。对于甲状腺双侧叶肿瘤患者,行甲状腺全部切除术+双侧VI区淋巴结清扫术。对于纳米炭染色淋巴结冰冻活检阳性,且淋巴结转移数≥4个淋巴结者或术前影像学检查提示颈侧区淋巴结可疑阳性的患者,术中行患侧Ⅲ、Ⅳ区淋巴结活检,若阳性,则行同侧功能性颈侧区淋巴结清扫术。
三、统计学处理
结 果
一、符合入组标准患者的一般情况
排除29例不符合入组标准的患者,220例最终入组191例,其中男39例、女152例,年龄44.71(18,78)岁,发病时间3.94(0.5,24)个月。其中以声音嘶哑为首发症状就诊1例,因甲状腺机能减退就诊1例,因颈部疼痛就诊2例,因颈部异物感就诊12例,其余患者均无症状而因体检发现甲状腺结节就诊。术前行甲状腺细针穿刺诊断为甲状腺癌172例。将191例分为HT组(73例)和非合并HT组(118例)。
二、HT组和非合并HT组临床特征比较
HT组女性比例高于非合并HT组(P<0.05),HT组术前TSH水平高于非合并HT组(P<0.05),见表1。
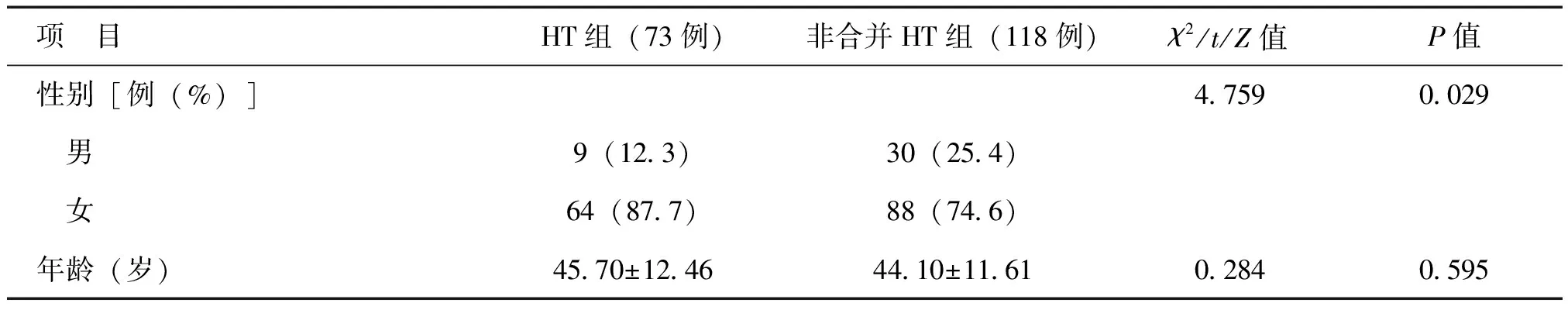
表1 HT组和非合并HT组临床特征比较

续表
三、PTMC淋巴结转移的相关因素分析
PTMC患者中央区淋巴结转移的单因素二分类Logistic回归分析中,筛选出有意义的因素包括年龄、是否多灶肿瘤、腺外侵犯及肿瘤最大径,后纳入多因素二分类Logistic回归分析、采用逐步向前法进行多因素分析。结果显示,合并HT并非为PTMC中央区及侧区淋巴结转移的影响因素,年龄、多灶肿瘤和肿瘤最大径是影响PTMC患者中央区淋巴结转移的因素。与≥45岁患者相比,<45岁者转移更多,是其危险因素(OR=4.066,95%CI:2.106~7.851,P<0.001);有多灶肿瘤者更易转移(OR=2.537,95%CI:1.050~6.128,P=0.039);随着肿瘤最大径的增大,发生中央区转移的可能性越大(OR=17.748,95%CI:3.294~95.626,P=0.001)。颈侧区淋巴结转移的单因素分析,仅年龄进入方程,故未再进行多因素分析,年龄<45岁是PTMC患者颈侧区淋巴结转移的危险因素(OR=3.902,95%CI:1.039~14.659,P=0.044),见表2~4。
讨 论
HT是甲状腺最常见的慢性免疫性炎症病变,其诊断主要根据病理检查,显微镜下见弥漫性的造血单核细胞浸润,以淋巴细胞为主,亦可见嗜酸性粒细胞,有淋巴滤泡形成,另外血清中抗甲状腺抗体水平升高[12]。甲状腺超声呈现弥漫性低回声改变等可作为HT诊断的参考。HT会导致甲状腺内分泌功能紊乱,引起甲状腺功能减退,可以单独发生或合并其他自身免疫性疾病及甲状腺疾病[13]。随着诊断技术的提高,甲状腺微小癌的诊治逐渐成为了讨论的热点问题,本研究主要着眼于PTMC患者,观察其合并HT的特点。结果显示,合并HT的患者女性更多,术前TSH水平更高,考虑HT会导致甲状腺内分泌功能紊乱所致。而腺外侵犯与多灶肿瘤2组间无差异。有研究显示合并HT的甲状腺癌患者,肿瘤直径更小、多灶性病变更多,而腺外侵犯及淋巴结转移的发生更少,与本研究结果相异,考虑可能与本研究纳入病例数较少,同时不能排除术中冰冻淋巴结假阴性有关[3,10,14]。另外,多因素回归结果表明HT并非为PTMC颈中央区及侧区淋巴结转移的影响因素,但年龄<45岁、多灶肿瘤及较大的肿瘤直径为PTMC患者中央区淋巴结转移的危险因素,年龄<45岁为颈侧区淋巴结转移的危险因素。Qu等[14]和石臣磊等[15]的研究结论与本研究相似,他们均认为合并HT的PTMC患者,其转移和复发率与单纯PTMC患者无异。
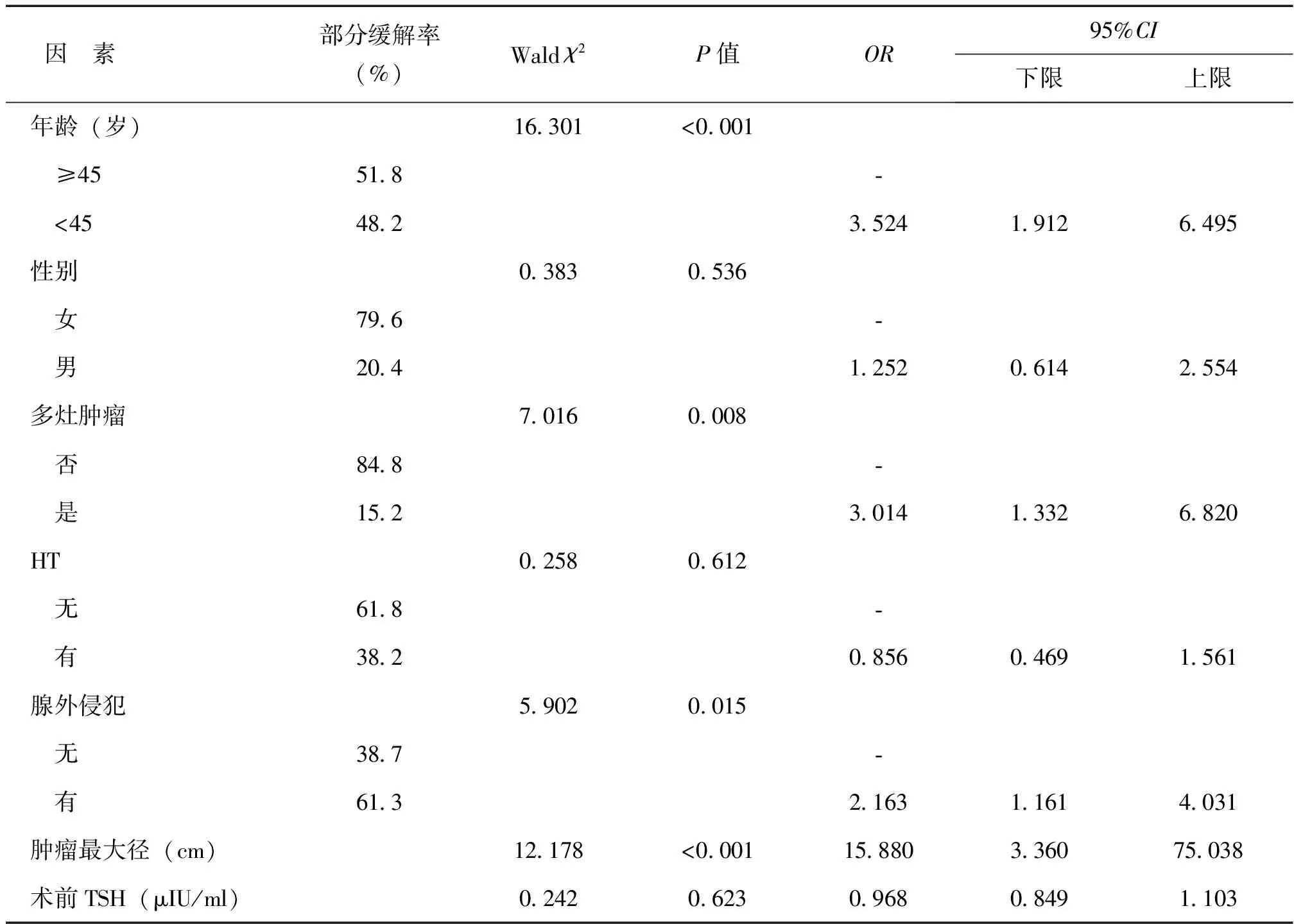
表2 PTMC患者中央区淋巴结转移的单因素Logistic回归结果

表3 PTMC患者中央区淋巴结转移的多因素Logistic回归结果
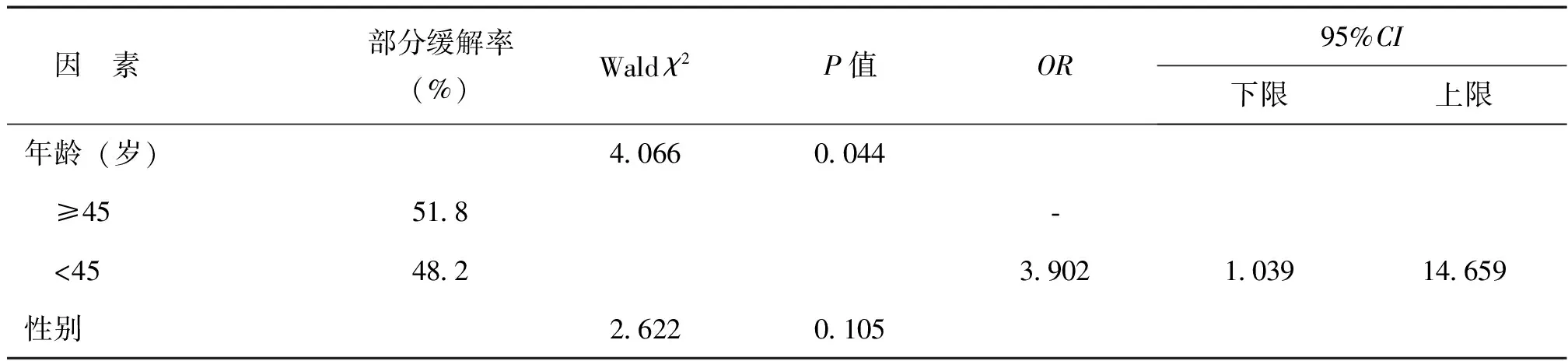
表4 PTMC患者颈侧区淋巴结转移的单因素Logistic回归结果

续表
目前研究者们对HT与甲状腺癌发生发展的关系仍有多种看法,Lee等[10]的一项纳入了38项研究包括了10 648例甲状腺癌患者的荟萃分析结果显示,合并HT的PTMC患者能获得更长的无复发生存期。有研究者认为正是由于HT造成的淋巴细胞浸润、自体的免疫应答限制了肿瘤的生长和转移,并造成了肿瘤细胞的破坏,成为甲状腺癌患者的保护因素[1,4]。然而亦有研究者发现HT与RET/PTC1融合基因、BRAFV600E基因突变密切相关,认为HT为甲状腺癌前病变,在甲状腺癌的发生发展过程中起重要作用,合并HT的甲状腺癌患者更易发生颈部淋巴结转移[2,9]。
对于合并HT的PTMC患者的诊治策略,孙辉等[16]认为,手术方案的选择应在目前国内外各指南的基础上,根据其高危因素(包括HT病程长、甲状腺功能明显异常)及肿瘤单灶或多灶、单侧或双侧、术前超声检查及术中冰冻病理检查结果是否存在淋巴结转移,选择患侧腺叶及峡部切除术或全甲状腺切除术。本研究显示,HT并非PTMC患者淋巴结转移的影响因素,故笔者不主张行无临床或病理学依据的预防性淋巴结清扫术。但对于年龄<45岁、有多灶肿瘤、肿瘤直径较大的患者,建议于术前通过颈部超声检查或颈部强化CT仔细评估颈部淋巴结情况,对可疑淋巴结可行细针穿刺或术中冰冻病理活检。笔者单位常规以纳米炭作为淋巴结示踪剂行淋巴结活检,可根据术中淋巴结冰冻病理活检结果,决定是否进行颈中央区或侧区淋巴结清扫术。赵菁等[17]发现,PTMC行前哨淋巴结活检,对有无额外阳性淋巴结的灵敏度、特异度、假阳性率、假阴性率、阳性预测值和阴性预测值分别为83.33%、67.50%、32.50%、16.67%、72.92%及79.41%,另外前哨淋巴结阳性比具有较好的诊断价值,最佳诊断界点为0.291 7,其认为前哨淋巴结阳性率在0.291 7以下的患者术后病理出现额外阳性淋巴结的可能性低,可仅行患侧颈中央区淋巴结清扫术而免于行双侧中央区清扫术。笔者在临床实践过程中发现,合并HT患者手术过程中解剖层次相较无HT患者更不清晰,个别患者特别是甲状腺抗体水平高、HT病程长、甲状腺体积增大的患者,术中更易出血及损伤甲状旁腺,但仍需行进一步研究以证实。合理使用能量外科器械,如超声刀、双极电凝等,有利于减少出血并便于行精细解剖。在术后应根据危险度分级予以规范的TSH抑制治疗或放射性碘治疗,应定期复查颈部超声及甲状腺功能,同时复查Tg-Ab和TPO-Ab[18]。
综上所述,本研究结果表明,合并HT的PTMC患者女性比例较男性高,HT并非PTMC颈中央区淋巴结及侧区淋巴结转移的影响因素。但本研究纳入病例数偏少,仍存在一定的局限性,今后需要继续纳入更多病例来进一步探索其关系。对于年龄<45岁、存在多灶肿瘤、肿瘤体积较大的患者,应充分注意评估其颈部淋巴结转移的可能性,确定淋巴结清扫的范围。
