紫花曼陀罗幼苗中紫色异细胞分布特征及其形态建成影响条件的初步研究
2018-07-24慕小倩
李 娜 慕小倩 雷 琼
(西北农林科技大学生命科学学院,杨凌 712100)
紫花曼陀罗(Daturastramoniumvar.tatulaTorrey)是茄科有毒植物曼陀罗(DaturastranmoniumL.)的变种[1],其叶、花、种子均可入药,能祛风湿,止咳定痛,叶和种子常作为麻醉性镇咳、镇痛剂[2]。该变种除了挥发油、生物碱、叶绿素、类黄酮及总酚等含量均高于原种曼陀罗外,其杀虫活性和毒性也较大[3~4]。研究发现,紫花曼陀罗除了植株外观和花色偏紫色,其对光照和温度变化具有较强的生理代谢适应性[5],且我们项目组的调查发现该变种在我国的分布数量已远远多于原种曼陀罗。我们对紫花曼陀罗的初步解剖学观察发现其茎部皮层中分布着一层原种曼陀罗茎中并不存在的呈紫色的异细胞[6],但关于这类紫色异细胞的形态特征以及生物学功能等均未知。为了明确该异细胞在紫花曼陀罗中的分布及其存在与紫花曼陀罗较好的适应环境特性的相关性,本研究对紫花曼陀罗幼苗中紫色异细胞的形态分布特征及不同光照和温度下培养的紫花曼陀罗幼苗茎中该细胞的形态特征进行了比较研究,旨在明确光照和温度对紫色异细胞形态建成的影响,并为进一步探讨紫花曼陀罗中紫色异细胞存在的生物学意义提供依据。
1 材料与方法
1.1 供试幼苗的培养
供试紫花曼陀罗种子于2016年11月收集于西北农林科技大学北校区周围农田野生紫花曼陀罗植株。种子在10%(g/v)NaOH溶液室温下浸泡90 min后,用镊子剥去种皮,再用200 mg·L-1的GA3溶液浸泡24 h,蒸馏水冲洗后置于培养皿中于25℃培养箱中催芽,待出芽率约达50%时挑选出芽长度2 cm左右的种子苗移栽至口径10 cm的花盆(营养土)中,在恒温24℃,光照3 000 lx(L∶D=12 h∶12 h)培养间培养至其长出子叶,再移至口径15 cm花盆中(普通土)培养3 d后进行不同光照和不同温度处理。
1.2 不同光照下幼苗的处理
将待处理幼苗将分批在BSG-300光照培养箱(其他条件设置与培养间相同)进行强光(30 000 lx)和弱光(0 lx)处理,不同光照强度下每天处理3 h,重复10次,时长各累计30 h。
1.3 不同温度下幼苗的处理
处理方式及时长同1.2,处理条件:高温(42℃)、低温(10℃),光照条件同培养间。
1.4 制片观察与统计
1.4.1 紫色异细胞分布的观察
用徒手切片方法[7]分别对培养间对照及所有处理组的紫花曼陀罗幼苗根、茎、叶(子叶和真叶的叶片、叶柄、叶脉)进行横切面解剖观察,用OLYMPUS-BX53数码显微镜观察并拍照。
1.4.2 紫色异细胞面积、长度、数量的数据统计
取幼苗期紫花曼陀罗茎部颜色较深部分1~2 cm长度,徒手切片法制作其横切切片,观察紫色异细胞横切特征,由于紫色异细胞在茎中仅分布在表皮下层,故采用茎局部弦切观察该细胞纵切特征;OLYMPUS-BX53数码显微镜观察并拍照。每个处理选取5个植株,每个植株制作若干切片,从中随机选取3个切片,每切片随机选取10个轮廓清晰的紫色异细胞,在10倍物镜下利用OLYMPUS cellSens Entry软件中测量工具分别对紫色异细胞横切面积和纵切长度进行测量。数量统计则是对横切面所有紫色异细胞进行计数,每个处理下选取10个植株,每个植株统计10个切片。
1.5 数据处理
采用SPSS 18.0统计分析软件进行数据处理,处理结果为平均值±标准差(mean±SE),并用Duncan法进行差异显著性比较(α=0.05),Excel2007软件作图。
2 结果与分析
2.1 紫色异细胞形态与分布特征
根部横切面(图1:A)中未观察到紫色异细胞存在。
茎横切面(图1:B)可看到紧靠表皮的皮层组织中分布有呈半透明紫色的异细胞(图1:B,箭头所指),其横切面椭圆状近乎连续分布,但偶尔有白色透明的皮层细胞相间分布。从含紫色异细胞的外皮层纵切面(图1:C)中观察到,该细胞呈长条状,其与邻近的皮层细胞除颜色外,其它形态相似。
叶片中紫色异细胞的分布为:在子叶和真叶叶片中分布在下表皮(图1:D,E);而在子叶和真叶的叶柄、叶脉中,该异细胞分布在紧靠表皮的皮层组织中(图1:F~I),类似茎中。
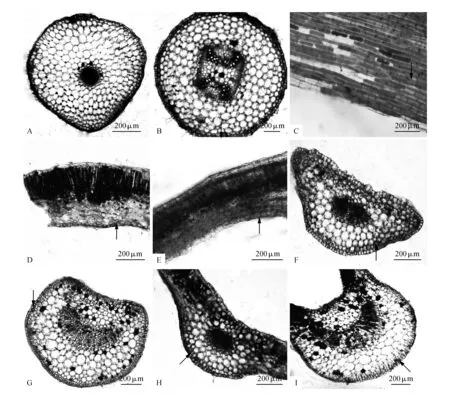
图1 紫色异细胞的形态特征和分布特征 A.紫花曼陀罗根部横切,示根部没有紫色异细胞;B.紫花曼陀罗茎部横切;C.紫花曼陀罗茎部紫色异细胞纵切;D.紫花曼陀罗子叶叶片横切;E.紫花曼陀罗真叶叶片横切;F.紫花曼陀罗子叶叶柄横切;G.紫花曼陀罗真叶叶柄横切;H.紫花曼陀罗子叶叶脉横切;I.紫花曼陀罗真叶叶脉横切Fig.1 Morphological characteristics and distribution characteristics of purple idioblasts A.Cross section of root, show no purple idioblast appears; B.Cross section of stem; C.Longitudinal section of purple idiolast; D.Cross section of cothledons blade; E.Cross section of true leaf blade; F.Cross section of cothledons petiole; G.Cross section of true leaf petiole; H.Cross section of cothledons cotyledon vein; I.Cross section of true leaf vein
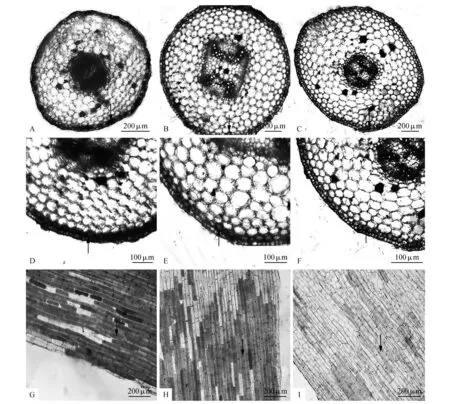
图2 光照对紫色异细胞形态结构的影响 A.强光处理下紫花曼陀罗茎部横切;B.对照组紫花曼陀罗茎部横切;C.弱光处理下紫花曼陀罗茎部横切;D.强光处理下紫花曼陀罗茎部横切;E.对照组紫花曼陀罗茎部横切;F.弱光处理下紫花曼陀罗茎部横切;G.强光处理下紫色异细胞纵切;H.对照组紫色异细胞纵切;I.弱光处理下紫色异细胞纵切Fig.2 Effect of different light intensity on Morphological structure of purple idioblast A.Cross section of stem under high light intensity; B.Cross section of stem under control group; C.Cross section of stem under low light intensity; D.Cross section of stem under high light intensity; E.Cross section of stem under control group; F.Cross section of stem under low light intensity; G.Longitudinal section of purple idioblast under high light intensity; H.Longitudinal section of purple idioblast under control group; I.Longitudinal section of purple idioblast under low light intensity
总结以上结果可知:紫色异细胞仅在地上部分的营养器官中分布,且分布部位除叶中为表皮外,其他部位均分布在靠近表皮下的第一层皮层组织中。
2.2 不同光照强度对紫色异细胞形态结构的影响
不同光照强度处理下紫花曼陀罗茎部紫色异细胞解剖特征如图2所示。从图2紫色异细胞横切结构(A-F)中可以观察到该异细胞连续或与皮层细胞相间排列在紧靠表皮下层,总体与上述茎中分布特征类似。不同光照下紫色异细胞颜色差异明显:与对照组(图2:B,E,H)相比,强光下紫色异细胞(图2:A,D,G)颜色较深,细胞间隙较小,透明度减小,而弱光下(图2:C,F,I)紫色异细胞颜色较浅,细胞间隙较大,细胞透明度增加。
2.3 不同光照强度对紫色异细胞面积、长度和数量的影响
不同光照强度对紫花曼陀罗中紫色异细胞横切面积、纵切长度以及数量的影响如图3所示,可见与对照组(正常条件)相比,强光和弱光对紫色异细胞横切面积和纵切长度影响结果相反,即强光使得二者增加,弱光则使得二者减小。相比于弱光(0 lx)和对照组(3 000 lx),强光(30 000 lx)处理下,紫色异细胞横切面积和纵切长度均显著增加(P<0.05),而光照强度从0 lx增强到3 000 lx,紫色异细胞的面积和长度同样显著增加(P<0.05)。与对照组相比,强光和弱光下紫色异细胞数量变化趋势相同,即二者均使得紫色异细胞数量增加。而相比于弱光和对照组,强光处理下,紫色异细胞数量显著增加(P<0.05),且光照强度从0 lx变为3 000 lx,紫色异细胞的数量显著增加(P<0.05)。
2.4 不同温度对紫色异细胞形态结构的影响
不同温度处理下紫花曼陀罗茎部紫色异细胞解剖结构特征如图4所示,从图4可看出其具体表现为:与对照组(图4:B,E,H)相比,高温下紫色异细胞(图4:A,D,G)颜色变深,细胞间隙变小,透明度减小,而低温下紫色异细胞(图4:C,F,I)颜色较浅,细胞间隙较大,细胞透明度增加。

图3 不同光照对紫色异细胞面积(A)、长度(B)以及数量(C)的影响(平均值±标准误差) 图中小写字母代表不同处理间差异显著性(P<0.05),下向。Fig.3 Effect of different light intensity on area(A),length(B) and quantity(C) of purple idioblast(mean±SE) Different small letters indicate significant difference among treatments at P<0.05 level,the same as below.

图4 不同温度对紫色异细胞形态结构的影响 A.高温处理下紫花曼陀罗茎部横切;B.对照组紫花曼陀罗茎部横切;C.低温处理下紫花曼陀罗茎部横切;D.高温处理下紫花曼陀罗茎部横切;E.对照组紫花曼陀罗茎部横切;F.低温处理下紫花曼陀罗茎部横切;G.高温处理下紫色异细胞纵切;H.对照组紫色异细胞纵切;I.低温处理下紫色异细胞纵切Fig.4 Effect of different light intensity on Morphological structure of purple idioblast A.Cross section of stem under high temperature; B.Cross section of stem under control group; C.Cross section of stem under low temperature; D.Cross section of stem under high temperature; E.Cross section of stem under control group; F.Cross section of stem under low temperature; G.Longitudinal section of stem under high temperature; H.Longitudinal section of stem under control group; I.Longitudinal section of stem under low temperature
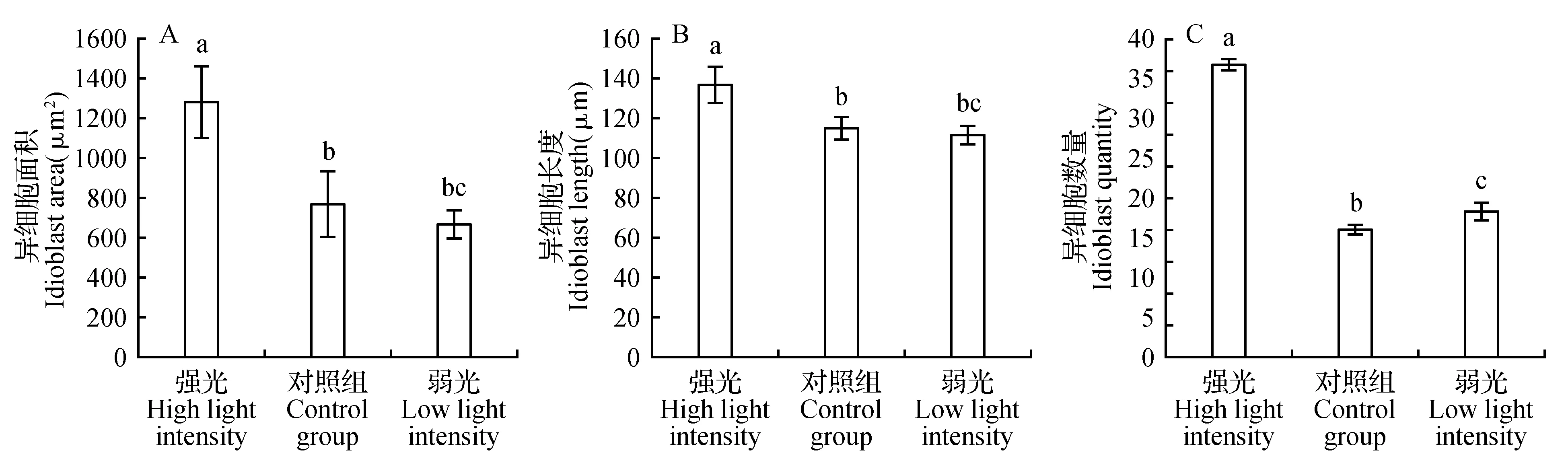
图5 不同温度对紫色异细胞面积(A)、长度(B)以及数量(C)的影响(平均值±标准差)Fig.5 Effect of different light intensity on area(A),length(B) and quantity(C) of purple idioblast(mean±SE)
2.5 不同温度对紫色异细胞面积、长度和数量的影响
不同温度对紫花曼陀罗中紫色异细胞面积、长度以及数量的影响如图5,可见与对照组(正常条件)相比,高温和低温下紫色异细胞横切面积和纵切长度变化趋势相反,即高温使得二者增加,低温则使得二者减小。而相比于低温(10℃)和对照组(24℃),高温(42℃)处理下,紫色异细胞面积显著增加(P<0.05)。而温度从10℃增至24℃,紫色异细胞的横切面积和纵切长度虽有所增加,但二者变化差异性均不显著(P<0.05)。而与对照组相比,高温和低温下紫色异细胞数量变化趋势相同,即二者均使得紫色异细胞数量增加。而相比于低温和对照组,高温处理下,紫色异细胞数量显著增加(P<0.05),且温度从10℃增至24℃,紫色异细胞的数量增加,该变化差异性显著(P<0.05)。
3 讨论与结论
3.1 紫花曼陀罗地上器官分布有紫色异细胞
本研究发现在有阳光照射的营养器官中,紫色异细胞分布部位均为靠近表皮下的皮层中(真叶和子叶的叶片除外)。祁如虎等[8]在青藏高原地区16种植物叶片表皮细胞中观察到了异细胞,作者指出分布在表皮的异细胞可能有抵御强光辐射的作用。Esau等[9]认为异细胞可以在所有的植物组织中出现,但是我们并未在紫花曼陀罗根部观察到紫色异细胞,这表明不同种类异细胞的分布位置可能因其生物学功能不同而异,紫色异细胞仅仅分布在地上器官说明其存在与光照和温度变化有关。
Metcalfe等[10]提出异细胞可避免植物在高强度环境条件(光照和温度)下脱水,因此紫色异细胞可能在避免强光对植物地上部分造成伤害而导致其失水方面具有重要作用,这可能也是该异细胞抵御强光辐射和适应高温环境的原理之一。毛立彦[6]研究表明紫花曼陀罗对光照利用效率高于曼陀罗,而弱光和低温下紫花曼陀罗中紫色异细胞的增加使其更好的适应了低强度环境条件,故推测,紫色异细胞的存在也是造成二者光照利用效率差异的主要原因之一。
3.2 紫色异细胞形态建成受光照影响
光是高等植物唯一的能量来源,植物通过改变自身形态结构的方式来适应不同光照条件,以完成其正常养分代谢[11]。有文献报道:光强越弱,油桃[12]源叶各级叶脉的筛管和伴胞的平均直径均变小、美国黑莓植株叶片表皮细胞和叶肉细胞厚度变薄,细胞间隙增大[13]、东京野茉莉幼苗叶片栅栏组织细胞相互融合而变粗,长度缩短,细胞排列稀疏,细胞内细胞器数量大量减少[14];而相反地,光强越强,植物外在的形态、内在结构的生长指标以及生物量增加更为明显[15],且光资源变化对植物发育早期影响最为显著[16]。我们的研究结果表明:与对照组相比,强光下紫色异细胞横切面积、纵切长度、数量均显著增加,弱光下横切面积和纵切长度则显著减小,这与前人[12~14]的研究结果一致,但是,弱光下紫花曼陀罗中紫色异细胞数量也显著增加,与董如磊[14]的研究结果相反,我们推测:这可能是紫花曼陀罗自我调节的表现,由于弱光下紫色异细胞体积减小,数量增加可保证紫色细胞内含物总体量保持稳定,有利于紫花曼陀罗适应弱光环境,但关于紫色异细胞内含成分的分析有待进一步深入研究。
3.3 紫色异细胞的形态建成受温度影响
仙客来(Cyclamenpersicum)耐热性研究结果表明:高温下法国大红叶片表皮细胞较厚且排列紧密,并将叶片表皮厚度作为仙客来耐热性鉴定指标之一[17]。此外,其他植物研究结果表明:在高温条件下,耐热品种显微结构显示叶片细胞和叶肉细胞排列紧密,细胞间隙小或无,栅栏组织排列紧密[18]。本研究中,供试曼陀罗幼苗在高温处理下,紫色异细胞的颜色变深,细胞间隙变小,细胞横切面积、纵切长度和数量均显著增加,与贾志国等[17~18]研究结果一致,表明:高温对紫色异细胞体积和数量均具有促进作用,且其对紫色异细胞形态指标(体积、直径或厚度)变化以及数量变化的影响趋势与普通植物细胞反应是一致的。故推测高温不但可刺激紫色异细胞的产生,也促进了该异细胞的发育。
于龙凤等[19]研究表明:低温条件处理下,西葫芦叶片上下表皮细胞直径显著减小,细胞密度显著减小,细胞间隙变大。本研究中,低温下紫色异细胞面积和长度有所减小,但与对照组相比变化差异性不显著,推测低温对该异细胞形态结构影响较小。低温下耐寒植物虎耳草叶片海绵组织和栅栏组织的细胞体积均显著减小,但细胞排列紧密,表明其数量增加[20],本研究中低温下紫色异细胞体积和数量研究结果上述相同,表明低温刺激了紫色异细胞的产生,从而提高了紫花曼陀罗对寒冷环境的适应能力。
祁如虎等[8]提出异细胞还可能具有吸收和储存太阳辐射热进而保暖的作用,使植物免受寒冷伤害,并间接提高植物抗寒性。我们的实验结果表明,在低温下紫色异细胞数量显著增加,这表明低温刺激了紫花曼陀罗中紫色异细胞的产生,从而使得该植物对寒冷环境具有较好的适应能力,这也是紫花曼陀罗对不良温度环境的适应能力比原种曼陀罗更强的细胞学原因之一。
3.4 紫花曼陀罗中紫色异细胞的生物学功能及存在意义
紫色异细胞的形态建成与光照和温度相关性的实验结果表明,在全球气候变化的趋势下,紫花曼陀罗中的紫色异细胞是其适应环境变化的产物。我们课题组近年来对曼陀罗属植物分布情况的调查发现,目前国内大部分地区紫花曼陀罗数量已远远高于曼陀罗,除了代谢原因外[6],这种异细胞的存在是紫花曼陀罗有更强的环境的适应性的细胞学原因。
我们观察发现紫花曼陀罗营养器官的紫色皆与紫色异细胞的存在有关,前人研究也表明曼陀罗原种与变种茎部差异仅在紫色异细胞的有和无[5],因此,紫色异细胞存在是紫花曼陀罗“紫化”的原因,也是造成曼陀罗原种与变种之间出现差异的原因,故紫色异细胞可以作为紫花曼陀罗系统分类的解剖学辅助依据。但这种异细胞形态建成与其它环境因素的变化(如水分、重金属胁迫等)是否有关还需进一步研究得知,特别是这种异细胞的内含成分及发育调控分子机制有待深入研究。
