白桦APETALA2基因启动子的克隆及其表达分析
2018-07-24胡晓晴朱德财辛琪琪刘雪梅
赵 桐 胡晓晴 朱德财 田 晶 辛琪琪 刘雪梅
(东北林业大学生命科学学院,哈尔滨 150040)
APETALA2/ethylene-responsive element binding protein(AP2/EREBP)转录因子家族普遍存在于所有植物中,参与植株的生长发育、胁迫应答和多种生理生化反应的信号转导。近年来,在动物中也已经发现其家族成员[1]。该家族中的AP2转录因子亚家族参与调控花、胚珠和种子的发育。APETALA2(AP2)基因是AP2亚家族的成员,作为花发育模型中的A类基因,参与植物花器官的发育过程,控制萼片和花瓣的生长[2]。AP2基因与其他花发育基因不同,具有独特的AP2结构域[3],该结构域能识别DNA并结合。近年来的研究发现,矮牵牛花(Petuniahybrida)的AP2类基因对花的发育产生影响[4],在拟南芥(Arabidopsisthaliana)中过表达挪威云杉(Piceaabies)的PaAP2L2基因会阻碍植株生长[5],在杂交落叶松(Larix×marschlinsii)中发现的AP2同源类似物LmAP2L1和LmAP2L2,直接影响其体细胞的胚胎发生和萌发[6],苹果(Maluspumila)的MAP2A基因,被发现在其多种组织中表达[7],而玉米(ZeamaysL.)的AP2-like基因在18种组织中均表达[8],水稻(Oryzasativa)的OsAP2-1基因在花和根中有较高表达[9],不同植物中AP2基因的功能不尽相同,为研究AP2基因对白桦(BetulaplatyphyllaSuk.)生长发育过程的影响,本试验通过克隆其特异性启动子展开对其表达模式的研究。
白桦是我国东北地区重要的阔叶树种,是国家科技支撑计划研究的重点树种之一,具有极高的研究和利用价值。因其具有纤维素含量高而木质素含量低的优良纤维性状,白桦成为优良的造纸原材料,其光滑细致的削面和富有韧性抗冲击的特点,又使其成为极受欢迎的板材。白桦生长周期和有性生殖周期较长,雌雄花均为不完全花,且花器官退化为两轮,花发育的关键阶段历时短,胚胎学上已对白桦生殖发育的研究有部分报道[10~13],但对其内在的分子机制还是研究甚少。本实验室先期已进行了部分白桦花发育过程涉及的其他相关基因的克隆与研究,本试验在此基础上,构建BpAP2特异启动子驱动的GUS表达载体,通过农杆菌介导转化法,研究其组织表达模式,为后续更深入探究BpAP2基因在白桦生长发育过程中的功能、分析白桦生殖发育机制、改良白桦遗传育种奠定了基础。
1 材料与方法
1.1 材料
转化材料为白桦四周龄组培苗第二和第三片叶、成年白桦的雌雄花及哥伦比亚拟南芥实生苗。DNA提取材料为白桦四周龄组培苗叶片,取材后液氮处理,随即置于-80℃冰箱保存。
1.2 试剂
植物基因组DNA提取试剂盒、琼脂糖凝胶DNA回收试剂盒以及普通质粒小提试剂盒购自北京天根公司。KOD FX Neo酶购自TOYOBO公司、核酸分子量标准(DNAmarker ladder)、T4-DNA连接酶、限制性内切酶ClaⅠ和XbaⅠ等购自NEB公司。GUS(β-葡萄糖苷酶,β-glucuronidase)组织化学染色底物5-溴-4-氯-3-吲哚-β-D葡萄糖苷酸酯(X-Gluc)购自Sigma公司。
1.3 方法
1.3.1 白桦BpAP2基因启动子的克隆和元件分析
根据已知的BpAP2基因序列(图4),与白桦基因组数据库进行比对,得到启动子序列,命名为proBpAP2,设计含酶切位点的全长引物F(CCATCGATTAGACGGAATAGACGCACTT,下划线处为酶切位点ClaⅠ)和R(CGTCTAGAACGAGAACCCGAACAACT,下划线处为酶切位点XbaⅠ)。以白桦组培苗叶片基因组为模板扩增全长启动子序列,PCR反应程序参照TOYOBO KOD FX Neo说明书:94℃,2 min;98℃,10 s;65℃,30 s,每循环降低0.5℃;68℃,35 s,共15次循环;98℃,10 s;50℃,30 s;68℃,35 s;共15次循环;68℃,7 min。克隆至表达载体pBI121-35S::GUS后测序鉴定,命名为pBI121-proBpAP2::GUS质粒,利用PLACE(http://www.dna.affrc.go.jp/PLACE/signalscan.html)和PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)在线分析软件进行启动子元件分析。
1.3.2 农杆菌渗透法转化白桦及拟南芥
将构建好的pBI121-proBpAP2::GUS质粒用液氮法转入农杆菌EHA105菌株。参照李萌等[14]的方法侵染白桦,程序如下:培养菌液至OD600=0.5,用1/2MS液体培养基重悬菌体至OD600=0.8,将白桦组培苗叶片放入,25℃ 120 r·min-1培养2 d,每16 h更换1次新鲜1/2MS液体培养基。
拟南芥的转化参照郭勇等[15]的方法,当菌液OD600为0.6~0.7时,5 000 r·min-1离心7 min收集菌体。将拟南芥置于25%蔗糖质量分数的1/4MS高渗溶液中25℃下浸泡15 min,转入OD600=1.0的侵染液中,25℃摇床内120 r·min-1培养2.5 h,500 mmol·L-1甘露醇洗3 min,取出后置于共培养培养基上,放在(23±2)℃培养条件下培养72 h。
1.3.3 GUS染色
X-GLUC染色液配制和染色参照郭勇等[15]的方法,染液配方:200 mmol·L-1的磷酸缓冲液50 mL(pH=7.0);100 mmol·L-1的Na2EDTA溶液10 mL,5 mmol·L-1的K3[Fe(CN)6]10 mL,5 mmol·L-1的K4[Fe(CN)6]10 mL,100% Triton-100 10 μL,X-GLUC 60 mg。将侵染后的拟南芥和白桦苗放入含有染液的50 mL离心管中,37℃黑暗染色过夜,卡诺固定液脱色1~3 h,观察拍照,每个实验重复3次。
2 结果与分析
2.1 白桦AP2启动子的获得及表达载体构建
以白桦组培苗DNA为模板PCR扩增获得长度为2 308 bp的单一条带(图1),测序后确认为白桦AP2基因的启动子序列proBpAP2,将其与植物表达载体pBI121-35S::GUS重组后获得proBpAP2特异启动子驱动的植物表达载体,命名为pBI121-proBpAP2::GUS(图2)。

图1 proBpAP2启动子片段的扩增Fig.1 Amplification of proBpAP2 fragment M.DL5000 marker
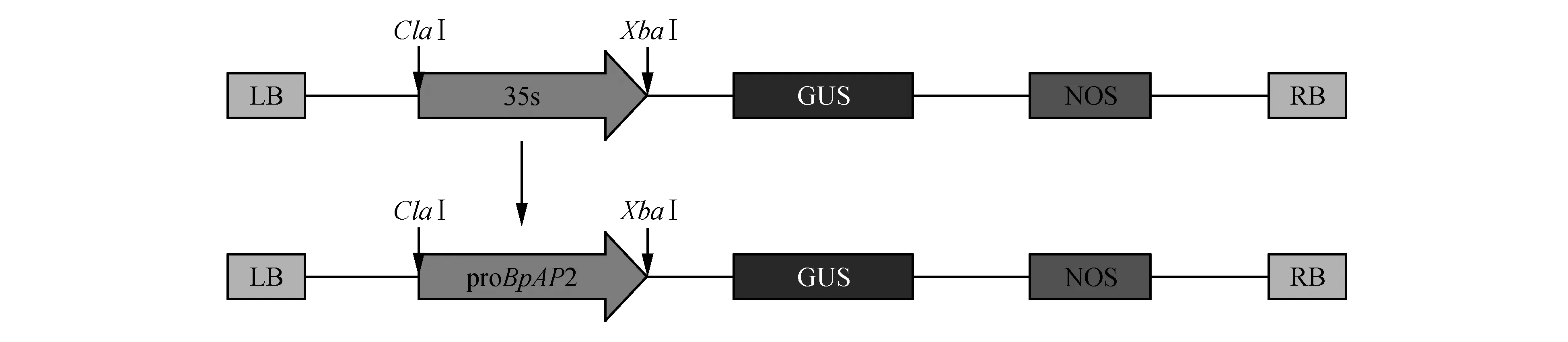
图2 proBpAP2-pBI121-GUS表达载体构建示意图Fig.2 pBI121-BpAP2::GUS expression vector construction diagram
2.2 白桦proBpAP2启动子序列分析及顺式元件预测
利用PLACE和Plantcare在线软件分析,发现proBpAP2启动子序列除含有大多数高等植物启动子共有的TATA Box和CAAT Box保守元件外,还包含大量光调控元件如3-AF1 binding site、Box4、BoxⅠ、CATT-motif、GA-motif、GAG-motif、GT1-motif、SP1、TCCC-motif、BoxⅡ、as-2-box、chs-CMA2b,另外还有涉及ABA响应的CE3和ABRE,MeJA响应的TGACG-motif和CGTCA-motif,GA3响应的GARE-motif,低温响应的LTR元件,SA响应的TCA-element,生长素响应的TGA-element(表1)及高转录水平作用元件。除上述响应元件外,proBpAP2还具有节律调节元件,分生组织和胚乳表达元件以及厌氧诱导必需元件,因此,BpAP2可能具有多种生物学功能,参与复杂的植物发育过程。
2.3 白桦proBpAP2启动子活性分析
2.3.1 proBpAP2在拟南芥中的转录活性
将构建好的pBI121-BpAP2::GUS融合表达载体及pBI121-35S::GUS在拟南芥中进行农杆菌侵染后,经GUS组织化学染色结果显示,野生型拟南芥未着色,而被proBpAP2和35S启动子驱动的GUS基因在转基因拟南芥整株苗中均有转录活性(图3A),35S启动子驱动的GUS片段转化后着色程度比proBpAP2更深,说明proBpAP2启动子可在拟南芥多种组织中驱动转录。另外,proBpAP2在花器官如花瓣、雄蕊和心皮中均有转录活性(图3C),在柱头、心皮底端与花柄连接处着色更深,花药和花丝的着色程度基本一致(图3D),在角果维管组织中也有较深着色(图3E)。可见,白桦BpAP2基因可能参与营养器官和生殖器官的发育。
2.3.2 proBpAP2在白桦中的转录活性
为进一步验证proBpAP2在同源表达系统中的活性,将其进行白桦转化,野生型未着色,而被35S和proBpAP2启动子驱动的GUS基因在转基因白桦叶片中均有表达,但在proBpAP2驱动下在叶脉处着色更明显,说明proBpAP2启动子在同源表达系统中同样具有一定程度的启动活性。另外,对白桦组培苗的腋芽、根、茎进行了转化和活性分析,发现在整个根部的颜色都较深(图3G),在腋芽顶部着色较深,(图3F),在茎中着色较浅(图3H)。除了营养器官,在花器官和果实中也有一定转录活性。在种翅、退化的柱头顶端(图I)和雌花花柄(图J)中的着色较深,而在成熟花药中则很低(图K)。以上结果进一步证明,白桦AP2基因启动子proBpAP2在营养器官和生殖器官中都具有一定活性。

表1 proBpAP2启动子序列元件分析Table 1 Analysis of proBpAP2 promoter sequence elements

图3 proBpAP2在拟南芥和白桦中的活性分析 A.拟南芥;B.白桦叶片;C~E.拟南芥组织。C.花;D.雌蕊;E.角果;F~K.白桦组织。F.腋芽;G.根;H.茎段;I.雌花翅果;J.雌花花柄;K(i/ii).花药Fig.3 Activity analysis of proBpAP2 in A.thaliana and B.platyphylla A. A.thaliana; B. B.platyphylla leaves; C-E. A.thaliana tissues(C. Flower; D. Pistil; E. Silique); F-K. B.platyphylla tissues(F. Axillary bud; G. Root; H. Stem segment; I. Samara of female flower; J. Floral shoot of female flower; K(i/ii). Anther)

图4 BpAP2基因序列 起始密码子和终止密码子Fig.4 The sequence of the BpAP2 indicates the start codon and the stop codon
3 讨论
高等植物的开花过程受到光周期途径、春化途径、自主调节途径、GA途径和年龄途径这五种开花途径调控。转录因子AP2和SQUAMOSA PROMOTER-BINDING PROTEIN-LIKE(SPL)与miR172共同作用,参与年龄调控途径[16~18]。在本研究的白桦AP2启动子GUS活性检测过程中发现,衰老叶片不易染色(未附图),这与相关文献中描述的AP2基因会随植物年龄的增长而表达量下降相似[19]。proBpAP2驱动的GUS基因在萼片、花瓣以及雌、雄蕊中均表达,说明BpAP2基因可能不仅参与前两轮花器官的发育[20~23],也影响第三、四轮花器官的发育及开花时间[5,22]。而在拟南芥角果中的表达说明该基因可能与种子的发育也息息相关[24]。张妍等研究表明[25],AP2基因在白桦的茎、叶、花序中都有表达,这与本实验中proBpAP2在白桦雌花、叶、茎等组织中表达的结果一致。另外,proBpAP2在白桦的成熟花药中的启动活性较低,不同于在拟南芥中的异源转化,因此,还需进一步深入验证。
基因特异启动子对于基因功能的分析非常重要,白桦AP2基因启动子具有高等植物启动子的典型特征,能驱动GUS基因在转基因白桦和拟南芥中特异表达。该序列除了具有TATA-box、CAAT-box等真核生物的基本转录起始元件,还包括多种光响应元件、参与各种激素调节的元件以及与植物生长发育有关的元件如参与分生组织表达的CAT-box,胚乳表达的GCN4、Skn-1等,可见该启动子元件具有丰富的多样性,可能涉及多种生长发育和激素响应过程,为后续构建外源基因的高效表达载体提供了重要的表达元件参考,也为进一步研究BpAP2在白桦中的表达特点和功能机理奠定了基础。此外,该启动子下游所包含的5′UTR区,对基因的表达调控也起着重要作用[26~29]。
4 结论
本研究克隆了白桦AP2基因启动子,命名为proBpAP2,其序列中存在大量的光响应元件、激素响应元件和低温响应元件等。该启动子在同源表达系统和异源表达系统中都具有表达活性,在拟南芥和白桦的营养器官和生殖器官中均有不同程度的转录活性,为后续进一步研究AP2基因在白桦花发育和营养生长中的作用、白桦退化花器官的形成机制以及缩短白桦生殖发育时间和改良白桦的遗传育种奠定了基础,并为提高或改进外源基因在不同表达系统中的表达效率提供可能。
