溴氰菊酯对中华绒螯蟹血细胞DNA的损伤
2018-07-24洪宇航
洪宇航,黄 毅
( 西昌学院 动物科学学院,攀西动物疫病监测与防控重点实验室,四川 西昌 615000 )
作为农业生产中提升农作物产量的有效手段,农药的使用至今已有上百年的历史。传统的有机磷类和有机氯类农药由于其较强的生态危害和对人畜的副作用而逐渐被减少使用[1]。相比之下,拟除虫菊酯类农药由于其高光稳定性、高降解、低残留以及对哺乳动物低毒等特点而在世界范围内被广泛使用[2]。溴氰菊酯化学名称为 (1R)-顺式-2,2-二甲基-3-(2,2-二溴乙烯基)环丙烷羧酸-(S)-a-氰基-3-苯氧基苄酯,分子式:C22H19Br2NO3,分子量:505.21,纯品为白色斜方形针状晶体,常温下几乎不溶于水,溶于丙酮及二甲苯等大多数芳香族,是农药敌杀死的主要成分,为常用拟除虫菊酯类农药之一[3]。其主要通过产生DNA双链、单链断裂以及姐妹染色单体交换等现象对各种动物血细胞、骨髓细胞、肝、肠等组织和细胞产生遗传毒性[4-5]。由于它具有高效、广谱、残留少等特点,被广泛应用于各种农作物虫害防治[6]。近年来,随着工业发展及水产养殖产业的扩大,溴氰菊酯也被大量用于渔业生产活动,如虾池、滩涂养殖池塘的清塘或毒杀敌害生物等[7]。因此,溴氰菊酯对水生动物的毒性作用成为水产养殖和环境生态领域的热点之一。但是,关于溴氰菊酯对水生生物的毒性研究目前主要集中在鱼类、贝类以及小型甲壳动物,而对于虾蟹类则鲜有报道[8]。
中华绒螯蟹(Eriochiersinensis)是我国本土重要的经济水产品种,年产量超过8×105t,产值超过300亿元。其中,稻蟹混合养殖模式是河蟹养殖中重要的生产模式之一。随着养殖规模的扩大,其质量安全问题越来越受到消费者的关注。而生产中溴氰菊酯的使用,特别是稻蟹养殖区域内溴氰菊酯的直接或间接使用,会对中华绒螯蟹的健康养殖产生潜在威胁。目前关于溴氰菊酯对中华绒螯蟹毒性作用的研究已有一例报道,在质量浓度为5.00 μg/L药液中,约3 h中华绒螯蟹很快活力减弱,表现出四肢无力或颤抖的症状,个别个体附肢脱落,最后全部死亡。在较低含量如0.5 μg/L药液中,中华绒螯蟹死亡时间明显延长,部分中华绒螯蟹还能逐步恢复活力。但其结果仅探讨了溴氰菊酯对不同生长阶段中华绒螯蟹的急性毒性,并未进一步研究对中华绒螯蟹的遗传毒性作用[9]。
彗星检测又称单细胞凝胶电泳,通过电泳后DNA的拖尾长度定量检测细胞中的DNA损伤程度,是评价外源因子对目标生物基因毒性的重要指标[10]。彗星检测作为评价毒物遗传毒性的重要工具,自1978年开发以来被广泛使用于各领域,包括遗传毒理、环境监测等。其在个体暴露于空气污染物、金属、农药、辐射等有害异物的损伤评价中有良好的指示作用[11]。近年来,在水生环境监测中有较多的应用。有报道指出,彗星检测较其他常用的遗传生态毒理学生物指标有更好的敏感性[12]。目前,彗星检测在外源毒物对水生动物的基因毒性检测中已有多例报道,但主要集中在海洋鱼类、贝类及小型甲壳类,而针对淡水甲壳类的研究较少[13-15],仅有小型甲壳类如大型溞(Daphniamagna)[16]和钩虾(Gammarusfossarum)[17]的报道。因此,本试验参考溴氰菊酯对中华绒螯蟹的毒性结果及在生产中的水体残留状况,通过对中华绒螯蟹进行不同剂量溴氰菊酯暴露,并利用彗星检测技术探究其对免疫功能主要执行者——血细胞的DNA损伤情况,为进一步研究菊酯类农药对中华绒螯蟹的毒理机制奠定基础,为菊酯类农药在淡水经济甲壳类动物中的毒性评价体系的建立提供参考。
1 材料与方法
1.1 试验动物及药品
试验用中华绒螯蟹采自江苏省金坛市水产技术推广站中华绒螯蟹标准化养殖场,试验前循环系统中暂养7 d以上。挑选健康无病、规格均等的中华绒螯蟹雌雄各半用于试验,平均体质量(14.5±3.2) g。溴氰菊酯乳剂购自德国拜耳作物科学有限公司,有效含量25 g/L。溶剂丙酮购自成都科龙化工试剂厂,分析纯。
1.2 试验设计
溴氰菊酯乳剂加入丙酮配制成25 μg/L储备液待用。参考溴氰菊酯在中华绒螯蟹毒性试验中的安全质量浓度和96 h半致死质量浓度[9],以及生产中溴氰菊酯在养殖水体中的残留量[18],设置0.10、0.20、0.40 μg/L 3个质量浓度组,0 g/L的空白对照组以及只添加丙酮的溶剂对照组。每组中华绒螯蟹30只,设置3个平行,每个125 cm×60 cm×60 cm水族箱中随机放入10只中华绒螯蟹,加入经充分曝气的自来水50 L,并在箱底放置经消毒处理的聚氯乙烯瓦片作为遮蔽物。试验采用半静水法,日换水一次,提前配置相同含量溴氰菊酯溶液以保证试验含量不变。光暗周期12 h∶12 h,试验期间每日8:00和19:00投喂人工配合饲料,并于投喂后3 h清除残饵和排泄物。试验期间每日测量水温和水质指标,保证水温(20±2) ℃,pH 7.2~7.8, 溶解氧>5 mg/L,氨氮<0.5 mg/L, 亚硝酸盐<0.15 mg/L。分别于1、2、4、8、12 d观察中华绒螯蟹存活情况,每组任意选取3只收集血细胞用于彗星检测。
1.3 细胞悬液的制备
每个采样时间点获得中华绒螯蟹后立即进行抗凝血采集。1 mL无菌注射器从第五步足基部基膜处采血,血淋巴与4 ℃预冷的抗凝剂(柠檬酸三钠 4.41 g,NaCl 9.88 g,葡萄糖11.39 g,EDTA 1.46 g,蒸馏水 500 mL)1∶1混合均匀。采集的抗凝血立即于4 ℃、1000 r/min条件下离心5 min,去上清液得到血细胞沉淀。蟹生理盐水(NaCl 14.5 g,KCl 0.355 g, CaCl20.899 g,MgSO4·7H2O 1.58 g,NaHCO30.25 g,MgCl2·6H2O 0.85 g,HEPES 2.38 g,蒸馏水500 mL)清洗一次,再加入1 mL蟹生理盐水均匀吹打形成血细胞悬液。台盼蓝拒染法测定血细胞活性,确保血细胞存活率大于90%用于后续试验。调整细胞密度至1×106个/mL 待用。
1.4 彗星试验方法
彗星试验方法根据文献[17]的方法进行改良,分别配制0.8%正常熔点琼脂糖及1%低熔点琼脂糖放置于恒温混匀器(Thermo,美国)中保温待用。
1.4.1 制片
取100 μL 0.8%正常熔点琼脂糖滴至单面磨砂载玻片磨砂面,盖上盖玻片并迅速放入4 ℃冰箱冷却10 min。将铺有第一层凝胶的载玻片取出后,移去盖玻片,在第一层胶上平铺混匀的含25 μL细胞悬液和50 μL 1%低熔点琼脂糖的混合液,盖上盖玻片后立即4 ℃放置10 min进行冷却凝固。将载玻片取出后移去盖玻片,在第二层凝胶上平铺1%低熔点琼脂糖100 μL,盖上盖玻片4 ℃放置30 min。
1.4.2 裂解
移去盖玻片,将载玻片浸入新鲜配制的细胞裂解液(2.5 mol/L NaCl,0.1 mol/L Na2EDTA,10 mmol/L Tris-HCl, pH 10,用前加入10%Triton X-100,10%DMSO)中4 ℃裂解40 min。
1.4.3 电泳
将载玻片取出后用PBS漂洗2次,在电泳槽中倒入碱性电泳液(300 mmol/L NaOH, 1 mmol/L EDTA, pH 13),约超过载玻片0.25 cm,25 V, 200 mA条件下电泳30 min。
1.4.4 中和及染色
电泳完毕后,PBS漂洗2次。用预冷的中和液(0.4 mol/L Tris-HCl, pH 7.5)中和3次,每次5 min。之后每张载玻片滴加20 μL碘化丙啶染液,避光染色10 min。
1.4.5 观察并计数
染色结束后在倒置荧光显微镜(Leica DMi8,德国)下进行观察并拍照。每张载玻片随机观察10个视野,CASP 软件对彗星图像进行分析。
拖尾率/%=拖尾细胞数/视野细胞总数
Olive尾矩=彗星细胞尾长×尾部DNA含量
1.5 数据分析
采用SPSS 20.0软件对试验数据进行统计分析,用Levene法进行方差齐性检验,不满足齐性方差时对数据进行反正弦或者平方根处理,采用ANOVA对试验结果进行方差分析,LSD和Duncan 法进行多重比较,取P<0.05为差异显著,P<0.01为极显著,在GraphPad Prism 5软件上绘制相关图表。不同质量浓度溴氰菊酯暴露下Olive尾距与暴露时间的回归曲线通过Excel 软件计算并绘制。
2 结 果
空白对照组和溶剂对照组血细胞染色后呈圆形荧光团,DNA结构较为紧密(图1a,b)。而其余各组均出现不同程度的细胞拖尾现象,如形成较短彗尾的轻度拖尾,形成较长彗尾的中度拖尾以及形成扫帚状,拖尾最长的重度拖尾。且随着试验质量浓度增加,拖尾现象越加明显,表明DNA受损程度越深(图1c~e)。
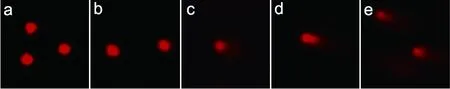
图1 不同含量溴氰菊酯暴露下中华绒螯蟹血细胞损伤的彗星图像a:空白对照组;b:溶剂对照组;c:0.10 μg/L组;d:0.20 μg/L组;e:0.40 μg/L组.
试验结果显示,对照组各时间点拖尾率约为5%,受损细胞极少。溶剂组各时间点拖尾率及Olive尾距同对照组均差异不显著(P>0.05),表明溶剂丙酮并非导致中华绒螯蟹血细胞DNA损伤的原因。由图2可知,在0.20 μg/L和0.40 μg/L质量浓度下,早在1 d即出现一定程度的拖尾现象,其血细胞拖尾率显著高于对照组(P<0.05),其中0.20 μg/L组极显著高于对照组(P<0.01)。随着溴氰菊酯含量的增加,在此后各时间点各组拖尾率均呈逐渐增高的趋势,表现出明显的剂量效应;此外,随着暴露时间的增加,各试验组血细胞拖尾率较先前也呈上升趋势,均极显著高于对照组(P<0.01),具有明显的时间效应。至12 d时,0.10 μg/L组拖尾率已高达(61.68±6.21)%,多数细胞出现严重拖尾现象。
不同质量浓度溴氰菊酯暴露下各时间点中华绒螯蟹血细胞彗星Olive尾距见图3,其中对照组和溶剂组Olive 尾距极低,特别是对照组几乎接近于0,表明对照组和溶剂组中血细胞DNA并未发生断裂或断裂极少,而其余各组均极显著高于对照组,证明血细胞DNA有明显断裂。Olive尾距变化趋势同拖尾率相同,也具有剂量—时间效应。不同剂量溴氰菊酯下Olive 尾距与暴露时间的回归分析表明,0.20 μg/L组Olive 尾距与暴露时间有较好的线性关系,相关系数为0.8148;而0.10 μg/L组与0.40 μg/L组Olive尾距与暴露时间相关性较差,相关系数分别为0.6902和0.7029(图4)。
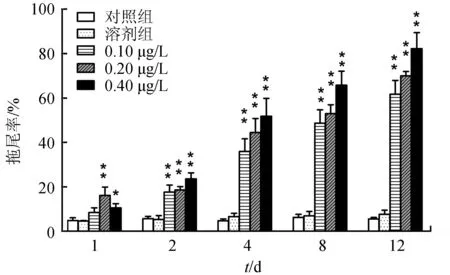
图2 不同含量溴氰菊酯暴露下彗星检测拖尾率变化*为差异显著(P<0.05),**为差异极显著(P<0.01),下同.
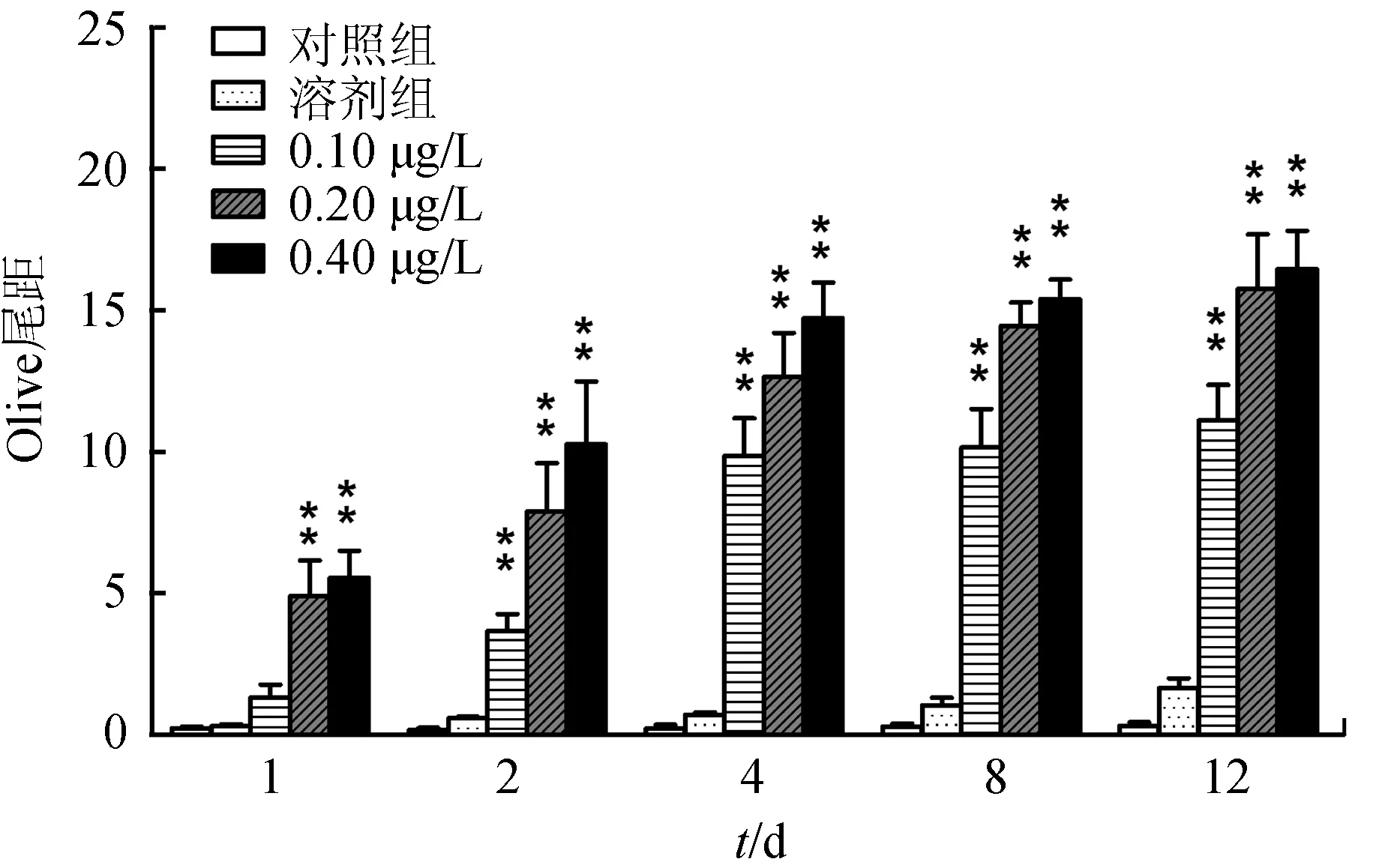
图3 不同含量溴氰菊酯暴露下彗星检测Olive尾距变化
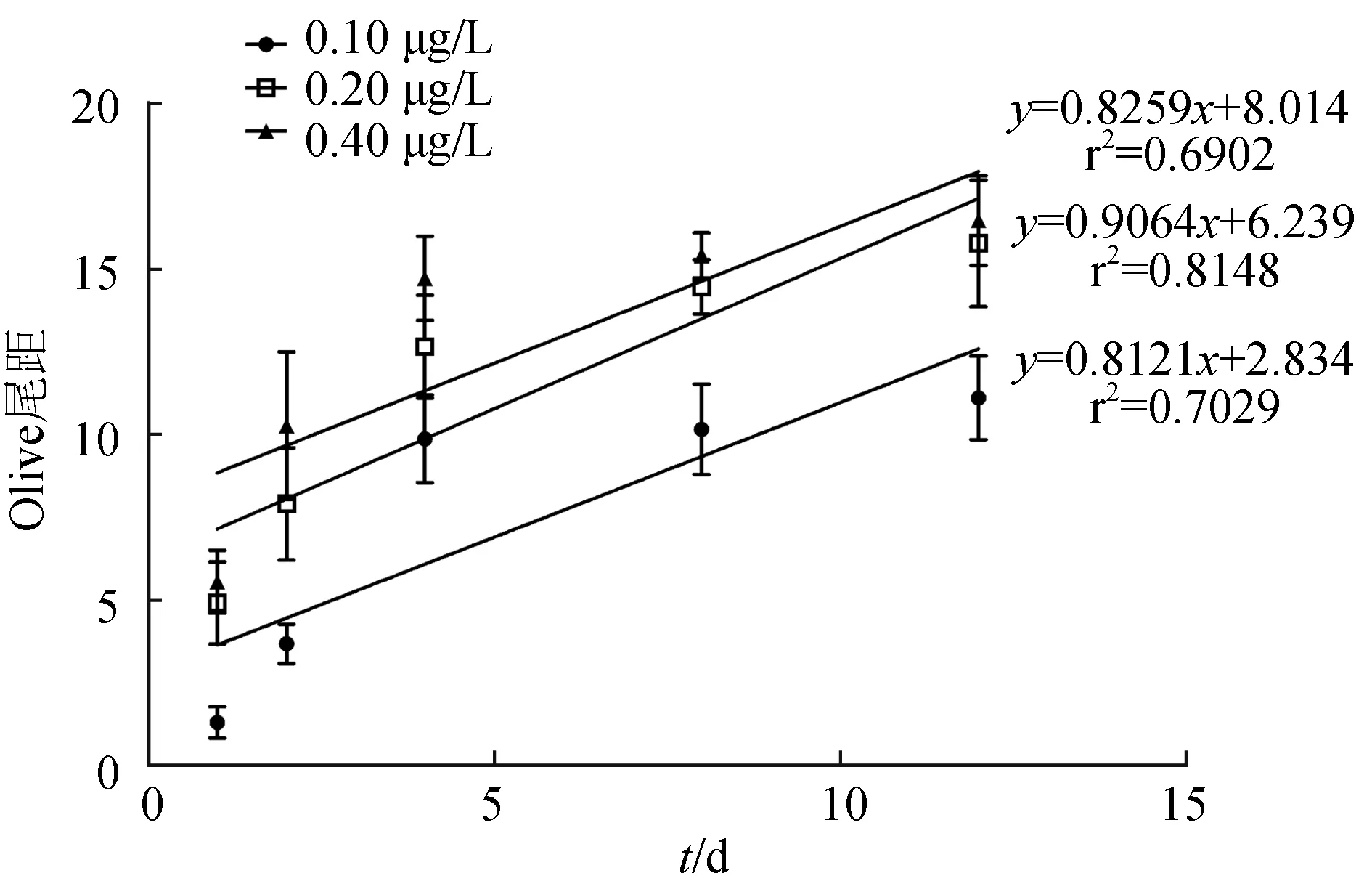
图4 不同含量溴氰菊酯暴露下Olive尾距与暴露时间的回归曲线
3 讨 论
关于溴氰菊酯对水生生物的研究,目前国内外有很多报道,但主要集中在鱼类,而鲜见关于甲壳动物的报道。姜辉等[19]总结菊酯类农药对水田生物的影响认为,大多数菊酯类农药对鱼类的96 h 半致死质量浓度要比虾类高1~2个数量级。因此,生产中存在利用低含量溴氰菊酯作为治疗鱼类寄生虫病,并用于杀灭鱼塘中甲壳类的情况[20]。大量使用的溴氰菊酯随着农田排水或雨水冲淋,对中华绒螯蟹以及其他经济甲壳类养殖水体产生较大安全影响。耿雪冰[9]通过对不同规格中华绒螯蟹进行溴氰菊酯急性毒性试验,得出溴氰菊酯对中华绒螯蟹成蟹和幼蟹的48 h 半致死质量浓度分别为0.65、0.42 μg/L,安全质量浓度分别为0.46、0.19 μg/L,属于高毒农药。但其并未进一步研究溴氰菊酯对于中华绒螯蟹生理及免疫,特别是遗传毒理方面的影响。由于本试验所用中华绒螯蟹规格为(14.5±3.2) g,与上述研究中所用中华绒螯蟹幼蟹规格(17.9±1.9) g相近,且在预试验中0.65 μg/L溴氰菊酯质量浓度下中华绒螯蟹96 h 死亡率超过80%,因此选取接近其96 h半致死质量浓度的0.40 μg/L溴氰菊酯作为最高质量浓度,低于其安全质量浓度的0.10 μg/L作为最低质量浓度,旨在探讨亚致死质量浓度条件及安全质量浓度下溴氰菊酯对中华绒螯蟹的遗传毒性作用。
彗星试验分析指标众多,包括拖尾率、尾长、彗尾DNA含量、尾距及Olive尾距等。拖尾率作为最早使用的指标,可以方便、直观地体现毒物对标靶生物的遗传毒性大小。但由于其具有一定主观性,因此在后来的研究中又加入了尾距及Olive尾距复合指标,可以更加全面地对毒物的遗传毒性进行评价[10-11]。本试验采用拖尾率和Olive尾距两项指标检测溴氰菊酯对中华绒螯蟹血细胞的DNA损伤程度。结果表明,溴氰菊酯可以造成中华绒螯蟹血细胞明显的DNA损伤,即使是0.10 μg/L最低质量浓度组,在1 d后拖尾率和Olive尾距也显著高于对照组,表明溴氰菊酯对中华绒螯蟹遗传毒性较强,且产生毒害作用十分迅速,在1 d内即可造成损伤。蔡道基等[18]通过稻田施用生产用量的溴氰菊酯,并模拟下雨将农田水排入鱼塘,测定了池塘水体及底泥中溴氰菊酯的残留。结果显示,溴氰菊酯排入池塘中其质量浓度4 h后可达最高峰,平均为0.41 μg/L,随后迅速降解,14 h后不再检出。因此,虽然溴氰菊酯在养殖水体中降解较快,但仍可能在短时间内造成中华绒螯蟹血细胞DNA损伤,从而引发其他的免疫功能缺陷,影响其生长存活。这一结果同多氯联苯对栉孔扇贝(Chlamysfarreri)[21]的毒性作用的研究结论相似。在0.5 μg/L多氯联苯暴露下,栉孔扇贝血细胞在1 d后即出现显著的拖尾现象。房燕等[22]的研究也表明,在镉和汞复合胁迫下,即使最低质量浓度也可在1 d后引起四角蛤蜊(Mactraveneriformis)血细胞出现明显DNA损伤,其Olive尾距显著高于对照组。本研究还发现,血细胞拖尾率和Olive尾距在试验过程中出现明显的时间效应和剂量效应,至12 d达到峰值,表明溴氰菊酯引起的DNA损伤随着暴露时间的增加而愈加严重,且在短时间内难以恢复。良好的时间和剂量同DNA损伤的相关性也表明拖尾率和Olive尾距这两个指标可以作为敏感的生物标志物在溴氰菊酯遗传毒性检测中应用。这同Nwani等[23]在农药草甘膦对翠鳢(Channapunctatus)的毒性研究中得到的结果相似,草甘膦暴露引起的血细胞DNA损伤存在明显的时间剂量效应,随着药物含量升高和暴露时间延长,DNA损伤加重。
此外,Olive尾距与暴露时间回归分析表明,0.20 μg/L组线性关系较好,而0.10 μg/L组线性关系最差。有研究指出,低含量毒物条件下机体DNA损伤后修复能力强于高含量条件[24]。本研究结果也证实了该结论。在低质量浓度条件下,中华绒螯蟹血细胞DNA修复能力更强,从而随着试验时间的推移其损伤程度和暴露时间之间的线性相关性降低。高含量多氯联苯下栉孔扇贝血细胞损伤较低含量有更强的恢复,推断高含量污染物可以愈发地激发机体DNA的自我修复[21]。这可能是本试验中0.40 μg/L组Olive尾距与时间的线性关系低于0.20 μg/L组的原因。
溴氰菊酯在农业、渔业生产中被大量使用后,直接或间接进入养殖水体。由于生产过程中施药剂量较低,降解迅速,且经试验观察发现,低于安全质量浓度溴氰菊酯暴露下,中华绒螯蟹不会出现明显的应激行为和死亡现象,因此在生产过程中其对中华绒螯蟹的毒性影响易被忽视。但经本试验证实,溴氰菊酯对中华绒螯蟹血细胞有较强的遗传毒性,即使在较低的安全质量浓度下也可以在1 d内造成其血细胞DNA出现损伤,因此笔者建议在生产中养殖水体及附近应避免使用。彗星检测可以有效地对溴氰菊酯在中华绒螯蟹遗传毒性作用中进行评估,拖尾率和Olive尾距是可以在检测中使用的较为敏感的生物标记。本研究将为后续菊酯类农药在淡水水生动物毒性作用的评估及环境毒理检测提供理论依据。
