高血压颈动脉粥样硬化患者血清25(OH)D及vWF水平变化及其关系
2018-07-24胡承志丁斌孟令毅
徐 俊 胡承志 丁斌 孟令毅
高血压是导致心脑血管疾病的主要危险因素之一,长期血压升高使人体主动脉及小动脉血管内膜损伤,导致炎性反应并发生增生性修复增厚,最终出现血管粥样硬化[1]。维生素D (vitamin D, Vit D) 是一种脂溶性维生素,与人体健康密切相关,包括影响钙磷代谢、免疫、炎症、细胞增殖分化及凋亡和调节血压等功能作用[2-4]。血管性血友病因子(von willebrand factor,vWF)是一种具有黏附作用的糖蛋白,vWF可由受损的内皮细胞释放,介导血小板在血管损伤处黏附,并参与血小板聚集,是血管内皮损伤标志物。vWF与一系列心血管疾病如动脉粥样硬化、急性冠状动脉综合征等关系密切[5-6]。本研究旨在分析高血压颈动脉粥样硬化患者血清25羟维生素D[25(OH)D] 和 vWF变化的规律,及两者之间的关系,为临床病情判断提供科学的依据。
1 资料与方法
1.1 一般资料 选取2016年1月至2017年10月安徽医科大学第三附属医院(合肥市滨湖医院)住院的高血压患者80例,排除继发性高血压、合并感染、肿瘤及血液系统疾病患者。高血压的诊断参考中国高血压防治指南[7]。其中根据颈动脉斑块分级标准分为0级组、1级组、2级组和3级组,每组各20例。同时选取同期同一家医院体检中心正常对照者20例作为对照组,排除高血压病、颈动脉粥样硬化、感染、肝肾功能异常、继发性高血压、血液系统疾病、肿瘤、影响钙磷代谢疾病及服用影响VitD代谢药物的患者。
1.2 研究方法 所有患者入院后记录性别、年龄及既往病史;在静息状态下测量收缩压、舒张压,测量2次,取平均值;同时测量身高、体质量,计算体质指数。入院次日空腹采集静脉血3 mL,自然凝固后,3 000 r/min离心10 min,分离血清,酶法测定总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG),苦味酸法测定尿素(Urea),TBHBA法测定尿酸(urid acid, UA),葡萄糖己糖激酶法测定空腹血糖,电化学发光免疫法测定25(OH)D,ELISA法检测血清vWF,同时行血常规检测。
颈动脉斑块的检测,使用彩色多普勒超声诊断仪(美国HP128型),探头频率7.5 MHz,取样容积2.0 mm,受检者仰卧位,从颈根部锁骨上开始探查,分别检测两侧颈总动脉及其分叉处和颈内动脉后壁。上述检测均由同一专业人员进行操作。颈动脉斑块分级标准[8]:0级,无斑块;1级,多个小斑块,单个斑块面积<10 mm2;2级,中等斑块,单个斑块面积>10 mm2;3级,大斑块,并存在血流动力学改变,颈动脉收缩期峰值流速>1.2 mm/s。

2 结果
2.1 一般资料比较 高血压颈动脉斑块各组收缩压及舒张压均高于正常对照组,且差异有统计学意义(P<0.05),高血压颈动脉斑块各组间收缩压及舒张压比较差异无统计学(P>0.05)。5组患者间年龄、体质指数、血液生化指标(空腹血糖、TCHO、TG、UA、Urea)和血小板比较,差异均无统计学意义(P>0.05)。详见表1。
2.2 25(OH)D和vWF关系分析 颈动脉粥样斑块各组25(OH)D水平低于对照组,且随着粥样斑块的严重程度的降低,25(OH)D水平降低(P<0.05);而vWF因子水平高于对照组(P<0.05),且随着粥样斑块的严重程度提高而增高(P<0.05)。经相关分析显示,vWF因子水平与25(OH)D水平存在负向直线关系(r=-0.365,P<0.001)。详见表2、图1。
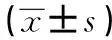
表1 高血压颈动脉粥样硬化各组与对照组临床资料比较
表2高血压颈动脉斑块各组25(OH)D、vWF检测结果
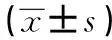
与对照组比较

图1 血清vWF因子水平与25(OH)D水平相关性分析
3 讨论
动脉粥样硬化与心脑血管疾病的发生密切相关,其病变特点是受累动脉内膜常有脂类和糖类积聚,以及出血和血栓形成,疾病发生发展结局为纤维组织增生、血管壁中层蜕变钙化、增厚变硬和血管腔狭窄[9]。血压升高使血管产生慢性免疫性炎症,进而发展成动脉粥样硬化[10]。25(OH)D是人体内Vit D的主要表现形式,血清25(OH)D直接反应Vit D的水平。本次研究,我们采用统一标准检测方法检测患者颈动脉内膜中层厚度,以颈动脉粥样硬化分级作为分组依据,并选取对照组,比较了临床相关资料,检测了血清25(OH)D及vWF水平,并分析了25(OH)D和vWF之间的相关关系,对该疾病的预防及治疗提供参考依据。
Vit D与细胞核内相关受体结合,调控肾素-血管紧张素-醛固酮系统相关基因的时序性表达和沉默,从而调节机体血压水平[11]。本研究结果表明:高血压合并颈动脉粥样硬化患者25(OH)D水平显著低于正常对照者,且随着颈动脉粥样硬化程度加重,血清25(OH)D水平进行性降低,提示患者血清25(OH)D水平下降程度与颈动脉粥样硬化的严重程度相关,25(OH)D的缺乏在动脉粥样硬化的发生中具有重要的作用。Vit D对动脉粥样硬化的作用机制主要包括以下几种:①在动脉粥样硬化过程中,Vit D可抑制炎症反应、抑制血管平滑肌细胞增殖;②在炎症反应过程中,Vit D可抑制血管壁泡沫细胞形成、聚集及纤维化,延缓动脉粥样硬化进展;③Vit D可减轻机体胰岛素抵抗,缓解高糖诱导的血管内皮细胞凋亡引发的动脉粥样硬化[12-13]。
vWF是血管内皮受损的特异性标志物[14],当内皮细胞受损出现功能障碍,vWF释放入血,参与血小板凝聚及血栓形成。本研究中,高血压颈动脉粥样硬化患者血清vWF水平显著高于对照组,且随着颈动脉粥样硬化程度加重,vWF水平进行性升高。说明vWF升高程度与颈动脉粥样硬化严重程度有关。研究[5, 15-16]表明,vWF通过调节血管性炎症影响动脉粥样硬化,具体作用:①vWF参与了免疫血栓形成中的白细胞滚动、黏附和溢出等;②vWF与血管的通透性相关;③vWF在机体缺血/再灌注中不可或缺;④vWF参与了补体激活和NETosis。
有研究[17-18]报道,在急性肺损伤大鼠肺组织局部及肺微血管内皮细胞中,给予Vit D可以使已升高的vWF表达下降,该作用不依赖vWF特异性水解酶(ADAMTS13蛋白)的变化,说明急性肺损伤大鼠局部Vit D与vWF呈负相关。本研究发现,在高血压颈动脉粥样硬化患者血清vWF水平与25(OH)D水平存在显著的负向直线关系,说明25(OH)D降低和vWF升高与高血压颈动脉粥样硬化有关,且25(OH)D与vWF呈负相关。然而本研究仅对高血压颈动脉粥样硬化患者血清25(OH)D及vWF水平变化的描述,Vit D对vWF表达的影响及相关分子机制有待进一步阐明。
