菜籽饼粕多糖对小鼠免疫功能的影响
2018-07-23赵荣敏
赵 荣 敏
(石家庄职业技术学院 食品与药品工程系,河北 石家庄 050081)
油菜是我国重要经济作物之一.菜籽油是人们生活主要植物食用油.菜籽饼粕是油菜籽榨油加工后的副产品,可以替代部分饲用蛋白或作为肥料使用.目前,国内生产的菜籽饼粕中蛋白质含量35%~40%,菜籽多糖含量2%左右,植酸2%~3%.由于品种不同,菜籽饼粕中糖的组成成分也不尽相同,但大体上有以下几种:果糖、葡萄糖、蔗糖、肌醇半乳糖苷、双半乳糖甘油、棉子糖、水苏糖,这些基本组成使得菜籽饼粕中的糖类具有重要的营养价值[1].因此对菜籽饼粕多糖(PRMs)免疫活性的研究有重要的意义.本文从菜籽饼粕中提取多糖,并研究其对小鼠免疫功能的影响.
1 材料与方法
1.1 材料与试剂
菜籽饼粕(采用中国农业科学研究院设计的菜籽冷榨设备压榨出)、小白鼠(昆明种,雌雄各半,体重在18~22 g左右,安徽中医学院动物饲养中心提供)、饲料(安徽中医学院动物饲养中心提供)、二硝基亚砜(DMSO,碧云天生物技术公司)、磷酸盐缓冲溶液(PBS)、小牛血清(上海化学试剂有限公司)、RPMI-1640培养基(杭州四季青生物有限公司)、刀豆球蛋白(ConA,杭州四季青生物有限公司)、噻唑蓝(MTT,Sigma公司)、环磷酰胺(CTX,Sigma公司)、绵阳红细胞(SRBC,安徽医科大学动物饲养中心、鸡血(市售健康公鸡)、氢氧化钠、Hanks液、三氯乙酸、无水乙醇、无水乙醚、丙酮.
1.2 仪器与设备
721分光光度计、TDL-50B高速离心机、BIROD Model 680 CO2培养箱、恒温水浴锅、R-201旋转蒸发仪、无菌超净工作台、MCO-17AIC酶标仪、干燥机、96孔细胞培养板、不锈钢镊子、不锈钢剪刀、移液枪及枪头、大孔吸附树脂、透析袋、三角瓶、注射器、电子天平、200目纱布及玻璃器皿等.
1.3 实验方法
1.3.1 PRMs提取及纯化
在本实验中用氢氧化钠做提取剂.精确称取一定量脱脂后的菜籽放入三角烧瓶中,按1∶10的液料比,放入水浴锅热水(温度70 ℃)浸提2 h,残渣再次浸提2 h后抽滤,并合并滤液.用旋转蒸发仪在60 ℃下将滤液浓缩至一定体积,加入10%的三氯乙酸溶液静置过夜以除去蛋白质,离心取上清液.然后通过特1号大孔吸附树脂进行初步纯化,除去游离的黄酮、脂类、蛋白质以及色素等物质,再将处理过的多糖溶液装入3500截留分子量的透析袋中,经自来水流水透析24 h,再经蒸馏水透析24 h.然后用无水乙醇、无水乙醚和丙酮脱色两次,最后将纯化的溶液在冷冻干燥机中干燥或粉末状,得到菜籽饼粕多糖,经检测,纯度大于等于95%.
1.3.2 动物分组和给药方法
将50只昆明小鼠随机平均分为5组,依次为空白对照组、CTX对照组、多糖高剂量组(300 mg/L)、多糖中剂量组(200 mg/L)、多糖低剂量组(100 mg/L).实验前将小鼠预饲养一周,温度23 ℃,相对湿度60%,饮水为自来水,自由饮水,喂养实验鼠专用饲料.对小鼠进行多糖灌胃为期30 d.每日一次,分别按体重计算,高剂量组给药量为0.016 mL/g,中剂量组给药量为0.012 mL/g,低剂量组给药量为0.008 mL/g,对照组灌生理盐水.CTX对照组第5 d起开始注射CTX,采用腹腔注射,注射量为0.024 mg/g小鼠体重,CTX浓度为3 mg/mL.
1.3.3 对免疫器官质量影响
末次给药后的次日,小鼠经眼眶放血处死,用电子天平精确称取小鼠的体质量、胸腺质量、脾脏质量.按以下公式计算小鼠的脾指数及胸腺指数[2].
脾指数=脾重(mg)/体重(g),
胸腺指数=胸腺重(mg)/体重(g).
1.3.4 对小鼠腹腔巨噬细胞的影响
无菌条件下向小鼠腹腔注入Hanks液,针尖朝上,避开肠和脂肪,回抽取腹腔液,不同方向冲洗数次,吸出腹腔液.细胞悬液离心速度2000 r/min,离心时间5 min,收集细胞,用Hanks液冲洗一次,用含5%的小牛血清的RPMI-1640培养液悬起腹腔巨噬细胞,浓度控制在2×107个/mL,细胞悬液置入培养瓶,37 ℃培养2 h,吸取上清液,用预热培养基清洗2次,留下贴壁细胞[3],加入96孔细胞培养板内.设对照组:100 μL细胞悬液+100 μL RPMI-1640培养液+100 mL PBS溶液;阳性对照组:100 μL细胞悬液+100 μL RPMI-1640培养液+50 mL PBS液+50 μL ConA;给药组:100 μL细胞悬液+100 μL RPMI-1640培养液+100 mL多糖溶液(浓度分别为100 mg/L,200 mg/L,300 mg/L).置37 ℃,5%CO2培养箱中培养48 h后,每孔加入15 μL MTT溶液(浓度为5 mg/mL),再继续培养4 h,离心,弃上清,然后加入30%的DMSO 100 μL,充分振荡后静置20 min,用酶标仪于570 nm处测光密度,分析比较各试验组与对照组的差异,加ConA孔的光密度值减去不加ConA孔的光密度值代表腹腔巨噬细胞的增殖能力[4].
1.3.5 对小鼠溶血素抗体生成的影响
实验分组为空白对照组,多糖低剂量组,多糖中剂量组,多糖高剂量组,末次给药前4 d,每鼠腹腔注射2%SRBC、生理盐水0.01 mL/g小鼠体重进行免疫,并继续给药.于免疫4 d后每鼠眼眶取血,分离血清.取血清用生理盐水稀释100倍,取稀释血清1 mL,加5%SRBC 0.5 mL,10%补体(新鲜小鼠混合血清经SRBC于4 ℃吸收30 min)0.5 mL混合,在37 ℃恒温箱中保温30 min后,0 ℃冰箱中终止反应.离心,取上清液于540 nm处测定光密度值.另设不加血清的空白管,取其上清液作空白[5].
2 结论与分析
2.1 PRMs对免疫器官的影响
PRMs对脾指数、胸腺指数的影响见表1.
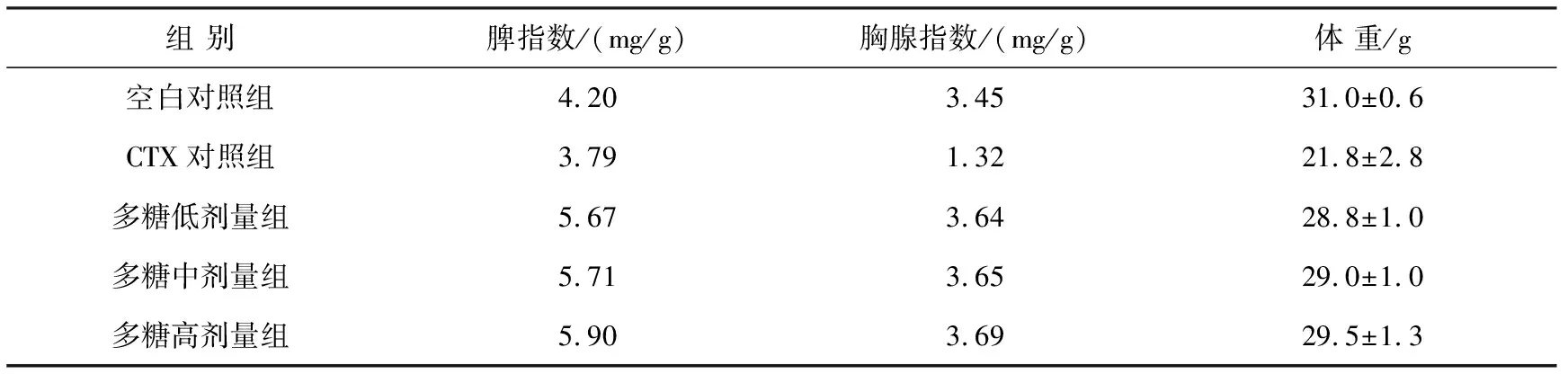
表1 PRMs 对脾指数、胸腺指数的影响
脾腺和胸腺是体内重要的免疫器官,在淋巴细胞的成熟过程中起着重要的作用,脾指数、胸腺指数是评价机体免疫机能状况的重要指标之一.从表1可以看出,与空白对照组相比,PRMs使小鼠的脾指数、胸腺指数都有所增加,但是不同浓度的 PRMs对其影响程度不同,说明PRMs浓度在一定程度上影响小鼠的脾指数和胸腺指数.与CTX对照组相比效果较明显,注射CTX后的小鼠的脾脏、胸腺有所萎缩,其原因可能是注射CTX会造成免疫器官的永久性萎缩,并且肝脏的颜色与未注射CTX的小鼠的肝脏颜色相比很浅.实验结果表明,该剂量范围内,PRMs可以使小鼠的脾脏和胸腺质量增加,促进其产生免疫细胞,提高免疫功能.
2.2 PRMs对腹腔巨噬细胞增殖反应的影响
PRMs对腹腔巨噬细胞增殖反应的影响见表2.
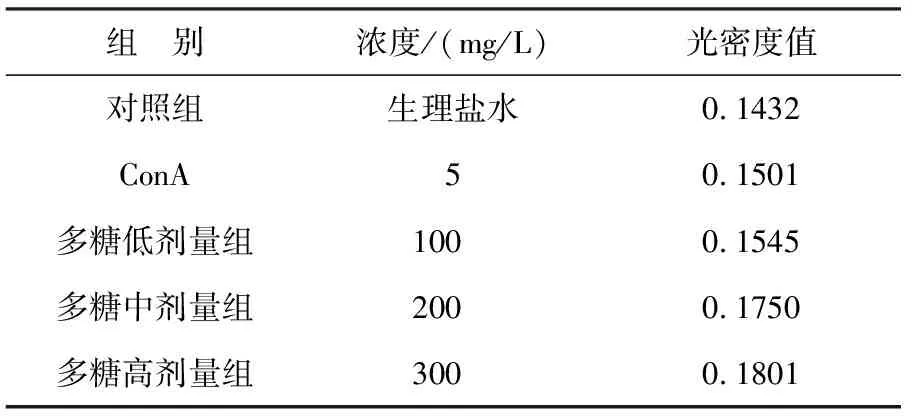
表2 PRMs 对小鼠腹腔巨噬细胞的影响
从表2数据可知,PRMs能明显促进ConA诱导的小鼠腹腔巨噬细胞的增殖,与对照组相比效果明显.不同浓度PRMs对小鼠腹腔巨噬细胞的增殖情况的影响不同.100 mg/L浓度的PRMs增殖作用最差,但与ConA诱导的小鼠腹腔巨噬细胞的增殖情况比较有所增加.其中300 mg/L浓度的PRMs增殖作用最好,200 mg/L 浓度的PRMs增殖活力比300 mg/L浓度的差,但比100 mg/L的浓度的高.所有给药组与对照组相比,增殖作用都明显提高.因此,在该剂量范围内PRMs有促进小鼠腹腔巨噬细胞的增值作用,且效果比ConA明显.
2.3 PRMs对溶血素抗体生成的影响
PRMs对溶血素抗体生成的影响见表3.

表3 PRMs对溶血素抗体生成的影响
从表3数据可知,与对照组相比,各实验组都不同程度地提高了小鼠溶血素抗体的生成量,可以看出PRMs有促进小鼠溶血素抗体生成的作用.
3 结语
研究表明,菜籽饼粕多糖可以提高小鼠的胸腺指数、脾脏指数,能明显促进ConA诱导的小鼠腹腔巨噬细胞的增殖和溶血素的生成,具有一定的免疫调节功能.
