重组人骨形态发生蛋白7对原发性开角型青光眼小梁网细胞增殖的影响
2018-07-23吴瑜瑜
周 芳, 吴瑜瑜
原发性开角型青光眼(primary open angle glaucoma,POAG)是青光眼的主要类型之一,以眼压升高时房角却始终开放为特点,至今发病机制未完全阐明。小梁网细胞为研究POAG发病机制的主要靶细胞,相关细胞因子对小梁网细胞的作用亦为研究的热点。骨形态发生蛋白7(bone morphogenetic protein,BMP7)是骨形态发生蛋白家族的一员,最初作为骨诱导因子被发现,具有诱导新骨形成、骨重塑及造血等功能[1];此家族为TGF-β(transforming growth factor-β,TGF-β)家族中最大的亚群。BMP7由431个氨基酸残基通过二硫键连接,构成同源二聚体,其中心区域胱氨酸手形结构的折叠与二聚体的构型均呈高度保守性,且二聚体的单体结构以对称轴为中心可旋转180°,为BMP7生物学功能的发挥提供重要的构型基础。BMP7的生物活性受到BMPs相关蛋白(如:Noggin,follistatin,chordin等)的抑制[2]。有研究发现,POAG患者房水中TGF-β2的表达水平显著升高,TGF-β2在房水中的高表达可能与POAG的发生密切相关[3]。研究表明,TGF-β2可诱导纤维连接蛋白(fibronectin,FN)、纤溶酶原激活物抑制剂-1(plasminogen activator inhibitor,PAI-1)在人小梁网细胞细胞外基质(extracellular matrixc,ECM)沉积,致使眼压升高,且升高程度与FN和PAI-1在人小梁网细胞的表达量呈正相关[4]。Fuchshofer等研究表明,BMP7可抑制由TGF-β2诱导的结缔组织生长因子(connective tissue growth factor,CTGF),血小板生成蛋白-1(thrombospondin-1,TSP-1),Ⅳ、Ⅵ型胶原蛋白,FN和PAI-1在人小梁网细胞ECM的表达;且BMP7可增加基质金属蛋白酶2(matrix metalloproteinase,MMP2)在小梁网细胞ECM的表达水平以促使细胞因子的降解,并提出POAG的发生可能是因TGF-β2在小梁网组织表达水平的增加导致BMP7表达量相对性降低,致使两者的动态平衡被打破[5]。Wordinger等检测到BMP7表达于人小梁网细胞、视乳头轴突和筛泡细胞,且表明BMP7通过表达水平的改变影响人小梁网细胞和视乳头功能的发挥[6]。本研究拟探讨BMP7在POAG小梁网细胞的生物学作用。
1 对象与方法
1.1对象 选取2011年4月—2012年12月在福建医科大学附属第二医院接受小梁切除术且术中未使用丝裂霉素的23名POAG患者为研究对象,男性8例,女性15例,年龄(42.1±10.7)岁(20~60)岁。患者纳入标准:(1)经眼压、超声生物显微镜、房角镜、视野等检查确诊为POAG;(2)术前未接受相关手术治疗或虹膜激光治疗;(3)眼部无其他伴发疾病。患者行小梁切除术过程中,收集23例含小梁网组织大小约2 mm×2 mm的深层巩膜组织块。本研究获得医学伦理委员会批准,患者术前均签署了知情同意书。
1.2方法
1.2.1细胞培养 无菌条件下,将从小梁切除术中取得带小梁网的巩膜内板层组织块接种于一次性无菌塑料培养瓶壁,确认组织块内皮面并将小梁网面贴壁,置入无菌培养箱,待细胞长至80%融合后进行消化传代。取第3代POAG小梁网细胞制备细胞铺片,并行人眼小梁网细胞神经原特异性烯醇化酶、FN及层黏连蛋白免疫组织化学染色鉴定。
1.2.2方法 取传3代POAG小梁网细胞,调整细胞浓度至1×105mL-1,平均接种于96孔板,待细胞60%融合,无血清培养24 h,使细胞生长同步化。分别加入rhBMP7终浓度为0(对照组),20,50,80,100,200 ng/mL的无血清培养基干预24 h,采用CCK8法检测不同rhBMP7终浓度下细胞增殖率的变化;经CFDA SE标记的传3代小梁网细胞,平均接种于预置无菌盖玻片的6孔板、25 mL一次性细胞培养瓶内,待细胞60%融合,无血清培养24 h,使细胞生长同步化。
1.2.3检测不同终浓度rhBMP7对POAG小梁网细胞增殖的影响 取传3代POAG小梁网细胞,调整细胞浓度至1×10-5mL左右,平均接种于96孔板,待细胞60%融合,无血清培养24 h,使细胞生长同步化。分别加入rhBMP7终浓度为0(对照组),20,50,80,100,200 ng/mL的无血清培养基干预24 h,加入CCK8避光孵育1.5 h,于全自动酶标仪检测各处理组吸光度(即OD值)。
1.2.3.1荧光显微镜观察各处理组细胞数量和荧光强度
1.2.3.1.1CFDA SE标记细胞 取传3代POAG小梁网细胞,同步化、消化、离心同上。用1 mL上述配置的CFDA SE细胞标记液悬浮离心后的细胞,调整细胞浓度至1×105mL-1;稀释CFDA SE储存液,轻轻混匀;避光孵育20 min;加入10 mL含20%胎牛血清的完全细胞培养液,室温下颠倒混匀;离心、充分洗涤细胞,弃上清;按照细胞浓度为1×105mL-1,平均接种于预置无菌盖玻片的6孔板、25 mL一次性无菌细胞培养瓶,置于培养箱继续培养;24 h后,在荧光显微镜下观察标记效果及细胞接种密度,经标记的细胞发绿色荧光。
1.2.3.1.2荧光显微镜下观察各处理组对POAG小梁网细胞增殖的影响及流式细胞术检测POAG小梁网细胞增殖的变化 分别吸弃上述接种于预置无菌盖玻片的6孔板以及25 mL一次性细胞培养瓶的培养液,漂洗2次,加入无血清培养基继续培养24 h,使细胞同步化;加入不同浓度rhBMP7[0(对照组),20,50,80,100,200 ng/mL]的无血清培养液继续培养48 h;荧光显微镜下观察6孔板经标记的对照组及实验组POAG小梁网细胞的数量及荧光强度的变化,并拍照;将培养于25 mL一次性细胞培养瓶的标记细胞进行离心,重悬细胞,流式细胞仪分析各处理组单细胞的分裂、增殖情况;做直方图及叠加图。

2 结 果
2.1细胞培养及鉴定结果 组织块经确切贴壁7 d后,于倒置显微镜下观察,可见小梁网细胞自组织块周边爬出。爬出细胞以组织块为中心,呈内密外疏样散在分布,形态不一,呈纺锤形、梭形、不规则形等,并有多个突起。随着培养时间的延长,细胞分裂、增殖,形成以组织块为中心的放射状单层细胞融合。传3~5代的POAG小梁网细胞形态较均一,呈单层稳定生长,细胞生长增殖能力强,融合期细胞会出现明显的接触抑制现象,此时的小梁网细胞适于实验研究。免疫细胞化学S-P法结果显示:小梁网细胞FN染色阳性,胞质呈棕色,彼此相连呈单层网状;层黏连蛋白染色阳性示:胞质呈红色,颗粒状,散在分布;波形蛋白(vimentin,VN)染色阳性,表现为细胞内广泛分布棕黄色颗粒;神经原特异性烯醇化酶染色阳性,表现为弥漫性红色颗粒遍及整个细胞。第Ⅷ因子相关抗原染色示:细胞胞质不着色,仅细胞核被苏木素染成蓝色(图1)。
2.2CCK8法检测rhBMP7对POAG小梁网细胞增殖的影响 经终浓度为0(对照组),20,50,80,100,200 ng/mL rhBMP7蛋白的无血清培养基处理POAG小梁网细胞24 h后,经全自动酶标仪检测,各处理组的OD值分别为:(0.561 2±0.026 9),(0.724 2±0.039 3),(1.416 0±0.016 2),(1.740 4±0.039 2),(1.853 8±0.014 5),(1.936 4±0.054 6);实验组细胞增殖率分别为:1.37%,2.96%,3.70%,3.96%,4.15%,levene方差齐性检验F=2.249,P>0.05,说明各处理组OD值符合正态分布;单因素方差分析示:各处理组OD值与对照组OD值比较,差别均具有统计学意义(P<0.05);各处理组LSD组间比较,差别均具有统计学意义(P<0.05)。
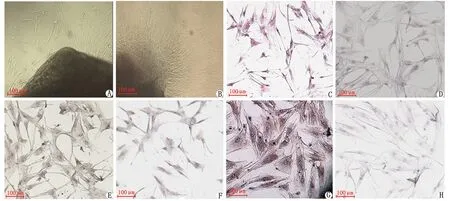
POAG:原发性开角型青光眼. A:组织块周边细胞爬出; B:组织块周边呈单层细胞生长; C:POAG小梁网细胞 H-E染色; D:POAG小梁网细胞FN染色; E:POAG小梁网细胞 LN染色; F:POAG小梁网细胞VN染色; G:POAG小梁网细胞NSE染色; H:POAG小梁网细胞FN染色.图1 细胞培养及鉴定结果( ×100)Fig 1 Cell culture and identification results( ×100)
2.3荧光显微镜观察细胞生长情况 CFDA SE标记的POAG小梁网细胞,经终浓度为0 (对照组),20,50,80,100,200 ng/mL rhBMP7蛋白的无血清培养基处理48 h后,荧光显微镜下可见在一定范围内,随着rhBMP7浓度的增加,标记的细胞量增加,与光学显微镜下观察情况相对应(图2)。
2.4流式细胞仪检测结果 CFDA SE标记的POAG小梁网细胞,经终浓度为20,50,80,100,200 ng/mL rhBMP7蛋白的无血清培养基处理48 h后,将各实验组与对照组(0 ng/mL)叠加后所得直方图可见:分裂细胞所占的比例分别为17.85%,18.63%,20.10%,27.45%及72.41%;随着rhBMP7终浓度的增加,荧光强度逐渐变弱,曲线及峰左移(图3)。
3 讨 论
POAG为不可逆性的高致盲眼病之一,以眼内压升高、房角开放为特点,至今病因尚未完全明了。正常眼压的维持依赖于房水生成与排出速率。房水由睫状体生成,主要经小梁网通路排出。Zhao等研究表明:内源性BMP4及BMP7在小鼠胚胎后期和产后阶段的睫状体中呈高水平表达,且可修复由其特异性抑制因子Noggin引起的睫状上皮的缺陷[7]。Wordinger等检测到BMP7表达于人小梁网细胞、视乳头轴突和筛泡细胞,且BMP7表达水平的改变可能会干预小梁网和视乳头组织功能的发挥[6]。睫状体和小梁网组织主导房水的生成和外流,BMP7可能通过改变其在这些组织的表达水平参与POAG的发生及进展。因此,本研究将BMP7纳入研究,以探讨其在POAG发生、发展过程中的作用。
小梁网组织起源于神经外胚层神经嵴的间充质细胞,VN为间充质起源组织的固有成分,神经元特异性烯醇化酶(neuron-specific enolase,NSE)为神经嵴组织来源的一种酶,表达VN及NSE是其生物特性之一;Schlemm管来源于中胚层, 其可合成第Ⅷ因子相关抗原(ⅧR:Ag),利用ⅧR:Ag免疫细胞化学染色,可鉴别中胚层来源的Schlemm管内皮细胞[8]。经免疫组织化学S-P法提示,体外培养细胞为POAG小梁网细胞。
研究表明:TGF-β2在POAG患者房水、小梁网等组织及细胞中表达水平显著增加,且可诱导一系列细胞因子(如:FN,CTGF,PAI-1等)沉积于细胞外基质(extracellular matrix,ECM),增加房水外流的阻力和降低小梁网功能、引起视乳头组织重构等改变,参与POAG的发生、进展[3-4]。Yu等报道:TGF-β2通过激活衰老相关p16-pRb信号转导通路,诱导体外培养人小梁网细胞发生衰老样改变,降低小梁网细胞的功能[9]。赵太宏等对比POAG患者和正常尸眼小梁网细胞凋亡比例表明:POAG小梁网细胞凋亡率明显高于正常人小梁网细胞,且指出:人小梁网细胞数量减少,致其滤过功能降低,此现象可能在POAG发生、发展中起关键作用[10]。Fuchshofer等研究表明:BMP7可完全抑制由TGF-β2诱导的结缔组织生长因子、血小板生成蛋白-1、Ⅳ、Ⅵ型胶原蛋白、FN和PAI-1在人小梁网细胞ECM的表达,并提出POAG的发生可能是因TGF-β2在小梁网组织表达水平增加致BMP7表达量相对性降低,致使两者的动态平衡被打破。Fuchshofer等进一步研究指出,BMP7是通过Smad7信号发挥此作用[11]。
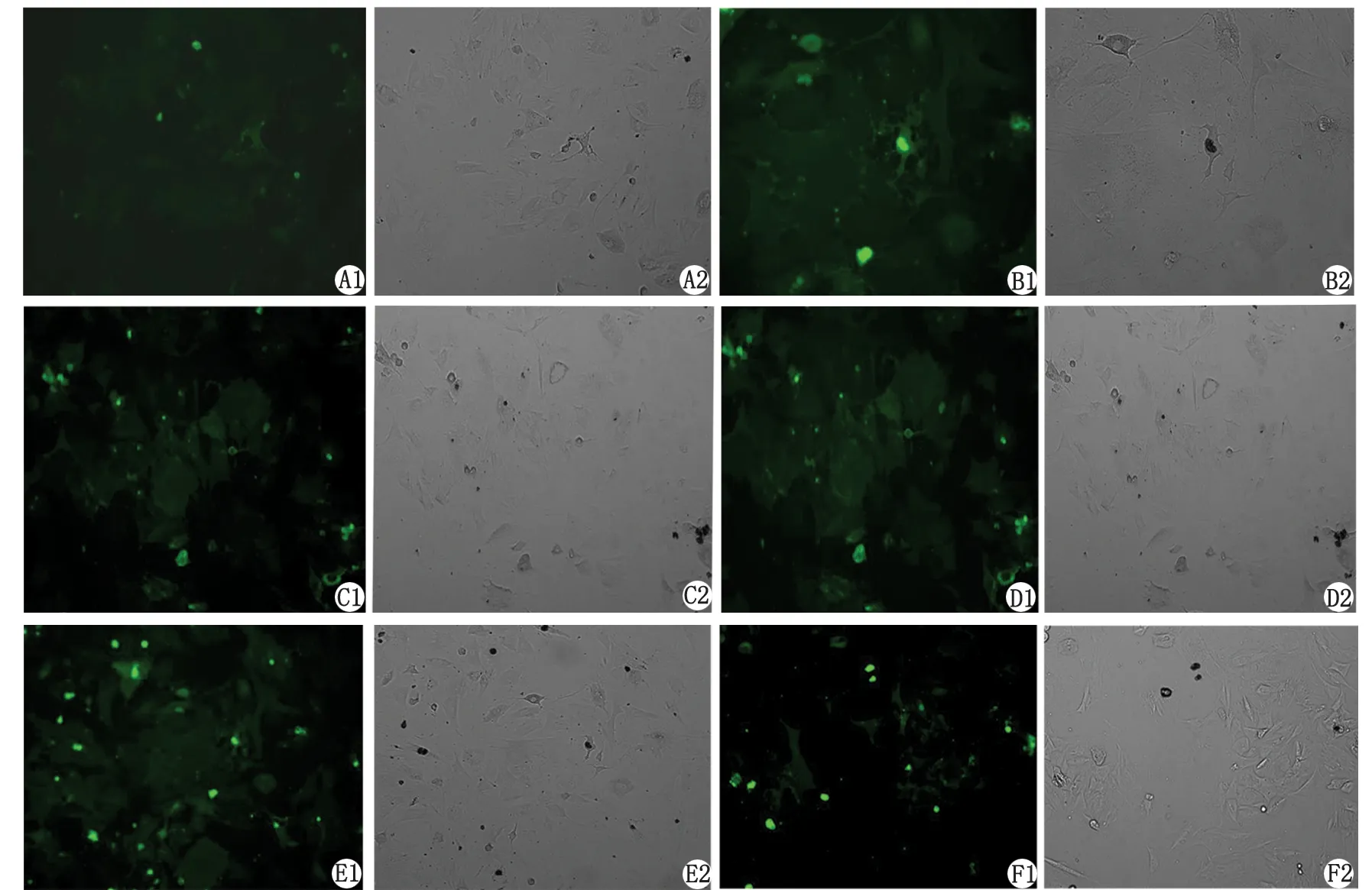
POAG:原发性开角型青光眼; rhBMP7:重组骨形态发生蛋白7. 1:荧光显微镜观察;2:倒置显微镜观察. A~F分别为0(对照组),20,50,80,100,200 ng/mL rhBMP7处理POAG小梁网细胞.图2 POAG小梁网细胞增殖数量Fig 2 The proliferation count of POAG trabecular meshwork cells
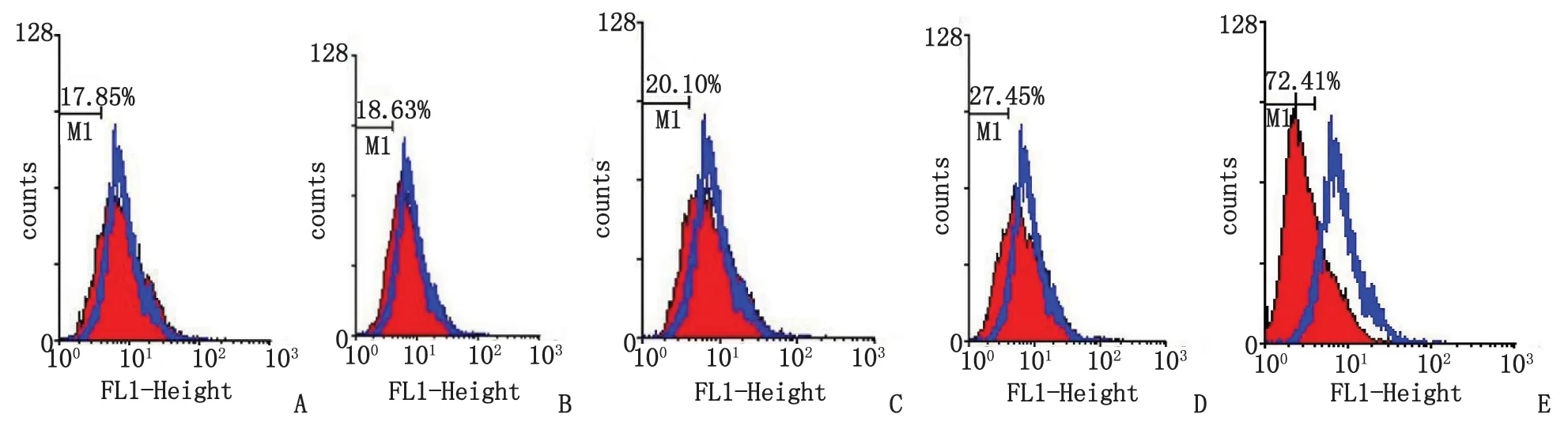
POAG:原发性开角型青光眼; rhBMP7:重组骨形态发生蛋白7. A~E:经20,50,80,100,200 ng/mL rhBMP7处理POAG小梁网细胞.图3 POAG小梁网细胞增殖率Fig 3 The proliferation rate of POAG trabecular meshwork cells
本研究表明:rhBMP7蛋白在20~200 ng/mL浓度范围内,对POAG小梁网细胞具有促增殖作用且呈一定的剂量-时间依赖性。提高BMP7于小梁网细胞的浓度可促进小梁网细胞的增殖,增加小梁网细胞数量,提高房水排出速率,降低眼内压;若能促进POAG小梁网细胞选择性分泌BMP7,实现POAG小梁网细胞的再生和功能的修复,且可抑制因TGF-β2增多所致眼压升高的细胞因子,就可能为POAG的治疗提供新的思路。但是,增殖的POAG小梁网细胞的功能,如:反映收缩功能的肌丝蛋白、反应吞噬功能的线粒体的活性状态等,还有待进一步研究。
