A20在浸润性乳腺癌组织中的表达及其与临床病理特征和预后的关系
2018-07-23曾伟超许建华黄种心
曾伟超, 许建华, 黄种心
乳腺癌是女性最常见的恶性肿瘤之一,约占女性癌症患者总数的25%和癌症总死亡数的15%。截至2012年,我国约有乳腺癌患者170万,其中死亡人数约52万[1]。乳腺癌的早期诊断困难,因此,寻找早期诊断的生物指标有很大的临床意义。A20被称为肿瘤坏死因子α诱导蛋白3(TNF-alpha-induced protein 3,TNFAIP3),是在诱导内皮细胞的反应中检测到的一个诱导性表达蛋白[2]。A20家族为卵巢肿瘤(ovian tumor,OTU)结构域超家族的一个亚组。A20锌指蛋白包含一个可以水解聚泛素链的功能性OTU结构域[3]。研究表明,A20在非霍奇金淋巴瘤的部分亚型中发挥肿瘤抑制基因的作用[4],但也有文献报道,A20可通过提高恶性胶质瘤干细胞的存活率来发挥肿瘤增强因子的作用[5],可见在不同的恶性肿瘤中,A20可能发挥不同的作用。
本研究基于组织芯片技术,运用免疫组织化学方法检测145例乳腺癌组织及与之部分配对的46例癌旁组织中A20蛋白的表达,并分析A20的表达与患者临床病理特征及预后的关系,初步探讨A20在乳腺癌中发挥的作用。
1 对象与方法
1.1对象 收集2004年8月-2008年12月手术的女性乳腺癌患者145例,年龄(59.57±12.53)岁(33~88岁);浸润性导管癌119例,浸润性小叶癌4例,黏液癌2例,导管内癌1例,浸润性导管癌合并浸润性微乳头状癌9例,浸润性导管癌合并浸润性小叶癌3例,浸润性导管癌合并髓样癌2例,浸润性导管癌合并黏液癌5例。纳入和排除标准均遵循乳腺癌临床病理分期(AJCC第六版)[6]。患者术前均未行放疗、化疗及激素治疗。
145例乳腺癌组织芯片及与之部分配对(46例)的癌旁组织芯片均购自上海芯超生物科技有限公司。同一患者的癌组织和癌旁组织形成完全配对。所有标本的使用均征得上海芯超生物科技有限公司伦理委员会同意,患者本人知情并签署知情同意书。
1.2主要试剂与仪器 TNFAIP3抗体(ab92324,英国Abcam公司);聚合HRP标记抗兔IgG(SV0002)及苏木精染色剂(AR1180-1)(中国博士德生物工程有限公司);5% BSA封闭液(SW3015,美国Solarbio公司);DAB显色试剂盒(CW0125)及中性树脂(CW0136)(中国康为世纪生物科技有限公司);恒温摇床(TC-100B,中国上海天呈科技公司);生物显微镜(上海领成生物科技有限公司);组织芯片扫描仪(美国Aperio公司)。相关的雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)及人表皮生长因子受体2(human epidermal growth factor receptor-2,HER-2)基因表达状态等数据由上海芯超生物科技有限公司提供。
1.3方法
1.3.1免疫组织化学Envision两步法检测A20蛋白的表达 组织芯片放入75 ℃烤箱中烤1.5 h;脱蜡:切片在二甲苯Ⅰ脱蜡10 min后,再用二甲苯Ⅱ脱蜡10 min;将切片依次放入100%乙醇、100%乙醇、95%乙醇、80%乙醇及纯化水中,各5 min。高压热修复后自然冷却,用PBS冲洗3次,每次3 min。用0.5% Triton X-100室温通透20 min。PBS浸洗玻片3次,每次3 min,吸水纸吸干PBS,在玻片上滴加正常山羊血清,室温封闭30 min;孵育一抗:水纸吸掉封闭液,不洗,每张玻片滴加足够量的稀释好的一抗TNFAIP3(1∶100),放入湿盒,4 ℃孵育过夜。切片复温45 min后PBS洗涤,滴加兔/鼠二抗工作液,室温孵育1 h,PBS充分淋洗;DAB显色5~10 min,在显微镜下掌握染色程度,PBS或自来水冲洗1 min;苏木精复染3 min,盐酸酒精分化,返蓝;自来水冲洗1 min,脱水、透明、封片、镜检。
1.3.2组织芯片的扫描读片及染色结果判定 读片结果采用双盲法判定,并由2位副高以上职称的病理医师分别读片后进行判定,判定标准采用半定量积分法[7]。在高倍显微镜下观察(×200),随机选择3个有代表性的高倍镜视野进行判定并计分。具体方法如下:(1)染色强度判定,在低倍镜下进行观察,分为弱、中及强阳性,其中弱阳性为浅黄色(+或1)、中阳性为棕黄色(或2)、强阳性为棕褐色(或3)(如组织中既有中阳性又有强阳性时,记为2~3,余类似)。细胞质和细胞核内的棕色染色颗粒被视为阳性,同时依据染色的强度设定得分值,即染色强度评分1分(<1),2分(1<强度≤2),3分(2<强度≤3)。(2)染色阳性率判定,首先在低倍镜下观察组织点的整个视野,然后选取3个染色强度不同的视野,并在高倍镜下进行判读,如果定位于胞核或者胞质、胞膜,则在每个视野中随机记100个细胞,计算其中的阳性细胞所占的百分率,取3个不同视野的均数作为该组织点最终的染色阳性率。视野中的着色阳性细胞数<70%为1分,70%~79%为2分,80%~90%为3分时,91%~100%为4分。(3)总评分及分组情况,以“染色强度评分”和“染色阳性率评分”的乘积为总评分,并进行分组,<8分为抗体低表达组,≥8分为抗体高表达组。
1.3.3随访 通过电话和门诊复查的方式进行随访,随访的起始时间为患者的手术时间,截止时间为2014年7月,随访时间为5.6~10年。
1.4统计学处理 采用SPSS 22.0软件进行统计学处理。A20蛋白在乳腺癌组织及其配对的癌旁组织中的表达差异分析采用卡方检验。生存曲线采用Kaplan-Meier法和Log-rank统计检验进行分析;单因素及多因素生存分析方法采用Cox比例风险回归模型。A20的表达与各临床病理因素及指标之间的相关性分析采用Spearman秩相关检验。所有的检验均为双侧检验,P<0.05为差别有统计学意义。
2 结 果
2.1A20在乳腺癌组织和配对的癌旁组织中表达及其与乳腺癌患者临床病理参数间的关系 因实验结果不理想,剔除11组完全配对的组织样本,余35组完全配对的乳腺癌组织与癌旁组织纳入统计学分析。A20蛋白主要表达于胞质中,部分细胞的胞核亦可着色。35例乳腺癌组织中,高表达25例(71.4%),低表达10例(28.6%)(图1A,1B);在配对的35例癌旁组织标本中,高表达12例(34.3%),低表达23例(65.7%)(图1C,1D)。卡方检验结果显示,A20蛋白的表达在乳腺癌组织和配对的癌旁组织中存在差异(P<0.05)。运用Spearman秩相关方法对A20的表达与145例乳腺癌患者的临床病理参数之间进行相关性分析,结果示二者间不存在直线相关关系(P>0.05,表1)。
2.2A20表达与乳腺癌患者预后相关性分析 145例中,A20高表达71例,其中死亡29例,生存42例,生存率为59.2%;A20低表达74例,其中死亡14例,生存60例,生存率为81.1%。高表达组的平均生存时间为84.055月,95%CI为(75.200~92.910);低表达组的平均生存时间为102.170月,95%CI为(93.905~110.435)(表2)。2组的生存曲线见图2,可见高表达A20组患者的总体生存率明显低于低表达组(χ2=8.492,P=0.004)。
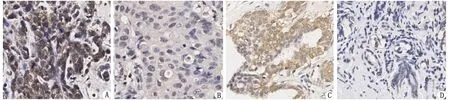
A20蛋白主要表达于胞质中,其中A,C图为高表达,B,D图为低表达; A,B:癌组织; C,D:癌旁组织.图1 A20在乳腺癌和癌旁组织中的表达( ×400)Fig 1 Expression of A20 protein in breast cancer tissue and para-carcinoma tissue( ×400)
表1A20在145例乳腺癌组织中的表达及与临床病理特征之间的关系
Tab1Correlation between the clinicopathological characteristics and A20 expression in breast cancer tissue
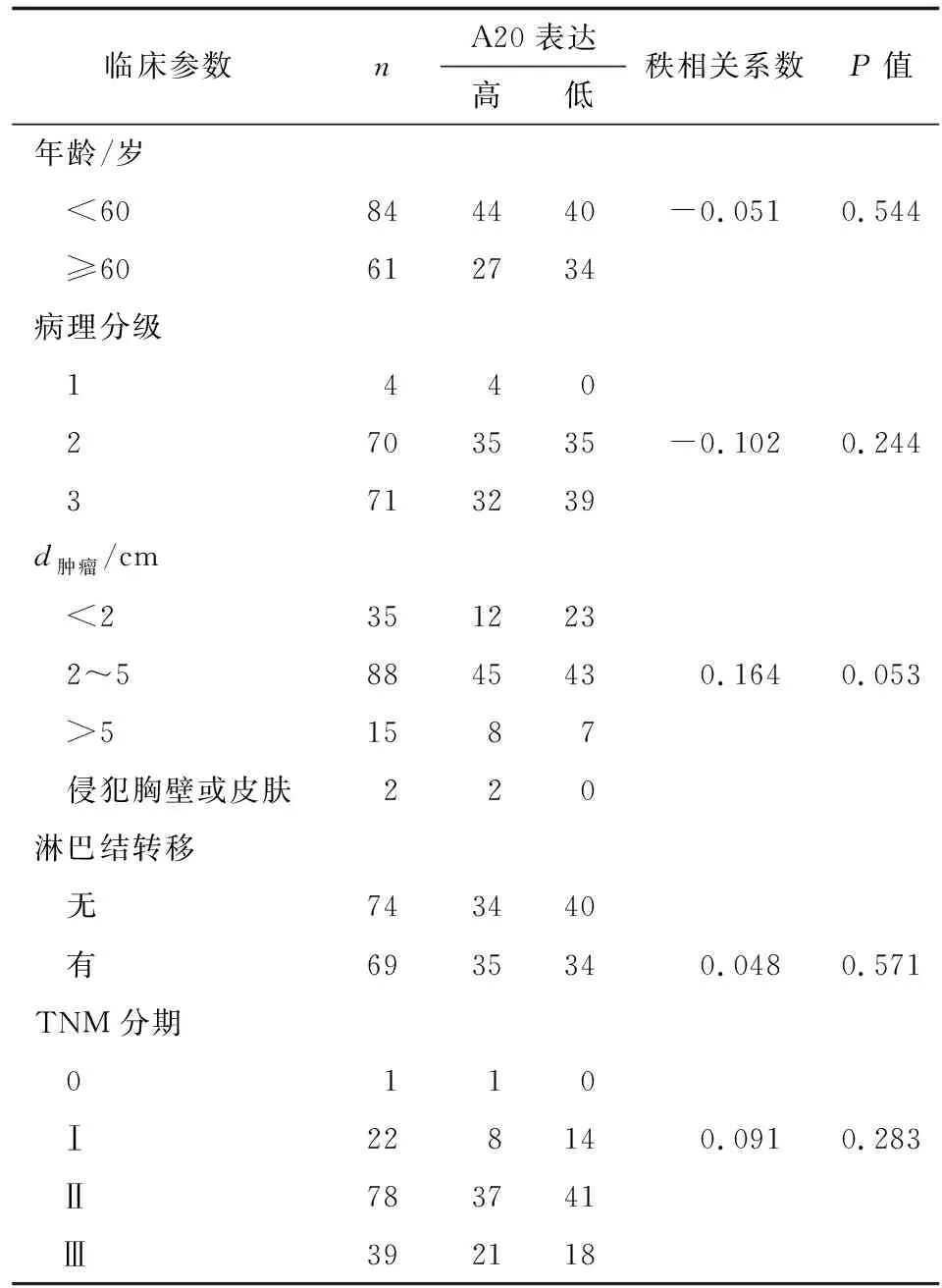
临床参数nA20表达高低秩相关系数P值年龄/岁 <60844440-0.0510.544 ≥60612734病理分级 1440 2703535-0.1020.244 3713239d肿瘤/cm <2351223 2~58845430.1640.053 >51587 侵犯胸壁或皮肤220淋巴结转移 无743440 有6935340.0480.571TNM分期 0110Ⅰ228140.0910.283Ⅱ783741Ⅲ392118
表2乳腺癌中A20高表达组和低表达组生存时间的平均值和95%可信区间
Tab2Mean value and 95% confidence interval of overall survival time between A20 high expression group and A20 low expression group in breast cancer
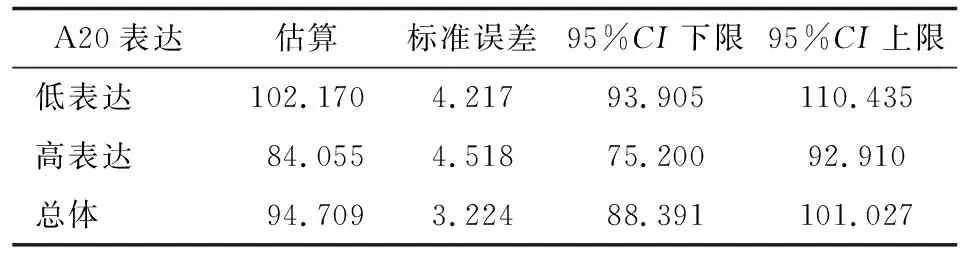
A20表达估算标准误差95%CI下限95%CI上限低表达102.1704.21793.905110.435高表达84.0554.51875.20092.910总体94.7093.22488.391101.027
2.3Cox比例风险回归模型的单因素和多因素分析 将患者的年龄、TNM分期、病理分级、肿瘤大小及部位、淋巴结远处转移、淋巴结侵犯及A20的表达水平等可能影响乳腺癌预后的因素进行单因素分析,结果发现,T分期(P=0.011)、N分期(P=0.005)、TNM综合分期(P=0.004)及A20的表达水平(P=0.005)与乳腺癌患者的总生存率之间存在相关。对这些临床参数进行Cox比例风险回归模型多因素分析结果显示,A20的表达水平(P=0.038)仍是影响乳腺癌患者预后的独立因素(表3)。
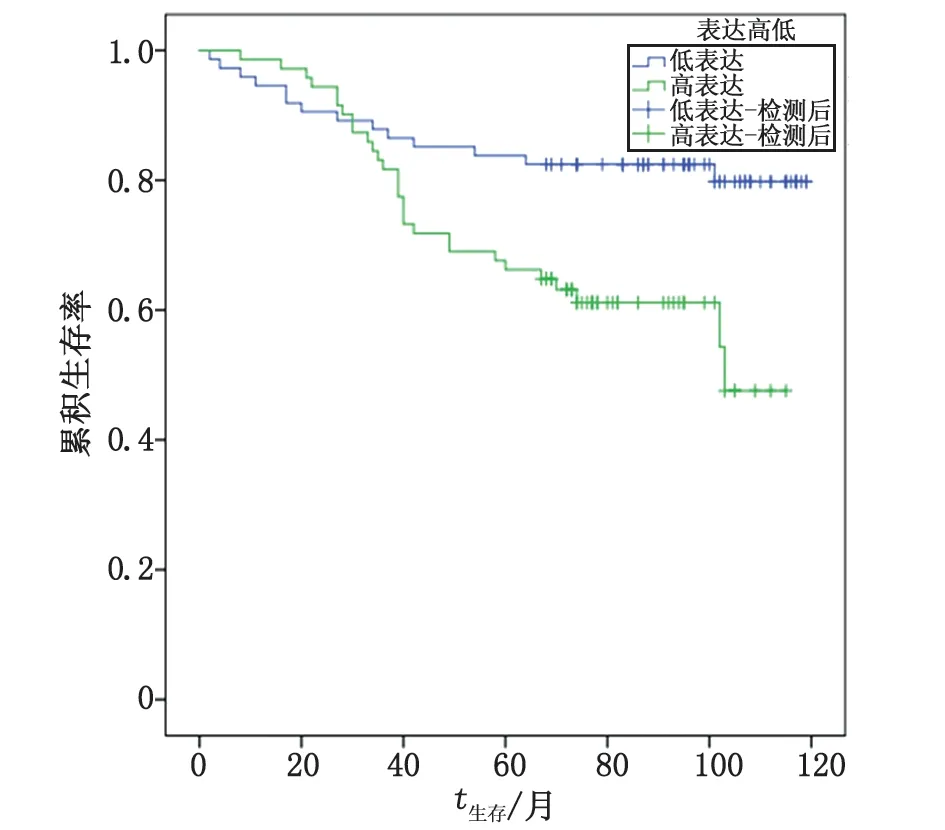
图2 乳腺癌中高表达A20组和低表达A20组的生存曲线Fig 2 Survival curves of A20 high expression group and A20 low expression group in breast cancer
2.4A20的表达与其他相关临床病理指标的相关性分析 运用Spearman秩相关分析A20表达与AR,Ki-67,P53,PR,ER,EGFR和HER-2基因的表达状态之间的相关性,显示P>0.05,可见二者之间不存在直线相关关系。
3 讨 论
A20蛋白是1990年第1次被发现的,它最为人们所熟知的作用是通过抑制NF-κB信号通路来抑制炎症。早有研究发现,A20可以结合到一种名为结合A20的NF-κB抑制因子(A20-bindind inhibitors of NF-κB activation,ABIN)的蛋白上,而这种蛋白通过过表达来模拟A20抑制NF-κB的作用,表明A20的作用是通过与ABIN这种NF-κB抑制蛋白的相互作用来实现的[8]。
A20在肿瘤中发挥的作用一直有2种不同意见。有研究发现,A20可作为一个肿瘤的抑制因子,如在多发性骨髓瘤(multiple myeloma,MM)的研究中发现,A20基因的失活可以通过构成性的NF-κB的激活来促进MM的发病,这种失活作用并非通过体细胞突变或启动子的甲基化,而是通过A20基因的缺失来实现[9]。对脓胸相关淋巴瘤(pyothorax-associated lymphoma,PAL)的研究也发现,A20基因不正常表达常与PAL相关,且A20的异常可能与PAL的发病有关[10]。相反,在对结肠癌、结肠息肉和炎症性肠病中A20与P53表达的相关性研究却发现,在结肠癌组织、腺瘤样息肉以及增生性息肉的上皮组织中,A20表现出高表达,且与结肠息肉的癌变倾向呈正相关关系,A20在炎症性息肉中的表达低于在腺瘤样息肉以及增生性息肉的上皮组织中的表达,且炎症性息肉也显示了较低的癌变倾向;同时研究人员还发现,A20可以与P53结合形成复合体,且在HEK293细胞中发现A20可在蛋白水平上抑制P53[11]。类似的结果也见于对膀胱癌及膀胱息肉的相关研究中[12]。
表3影响乳腺癌预后因素的Cox单因素和多因素分析
Tab3Univariate and multivariate analysis of factors which affect breast cancer patients' prognosis using Cox proportional hazards model
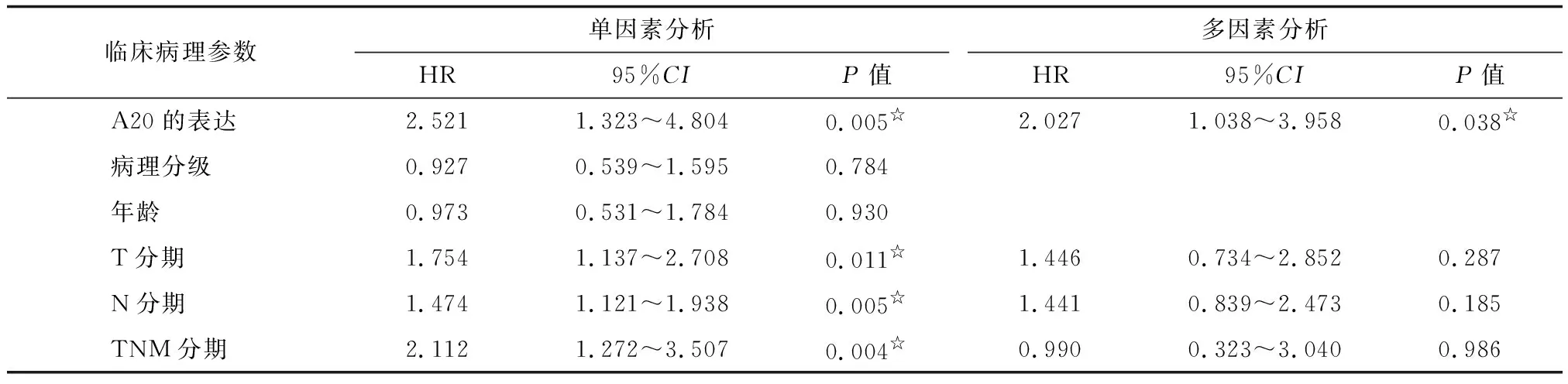
临床病理参数单因素分析HR95%CIP值多因素分析HR95%CIP值A20的表达2.5211.323~4.8040.005☆2.0271.038~3.9580.038☆病理分级0.9270.539~1.5950.784年龄0.9730.531~1.7840.930T分期1.7541.137~2.7080.011☆1.4460.734~2.8520.287N分期1.4741.121~1.9380.005☆1.4410.839~2.4730.185TNM分期2.1121.272~3.5070.004☆0.9900.323~3.0400.986
☆:P<0.05.
组织芯片技术的发展,允许科研工作者高效率地完成多样本的免疫组织化学检测,从而能够初步研究一个基因可能发挥的作用,并分析其与患者临床预后的关系。在应用组织芯片技术研究胰腺癌时发现,A20蛋白在胰腺癌组织中的表达明显低于正常的胰腺组织,因此,A20在胰腺癌的发病过程中可能发挥了潜在的作用[13]。本研究应用组织芯片技术研究乳腺癌时发现,A20蛋白在乳腺癌组织及其配对的癌旁组织中的表达存在差异,但Spearman秩相关方法检测结果显示,A20的表达与患者年龄、病理分级、T分期、N分期和TNM综合分期之间不存在直线相关关系。采用Kaplan-Meier生存分析法和Log-rank统计检验进行生存期单因素分析,可知高表达A20组患者的总体生存率明显低于低表达组,二者间差别有统计学意义。进一步运用Cox比例风险回归模型进行单因素和多因素分析发现,A20的表达可以作为影响乳腺癌患者预后的一个独立的危险因素。因此对A20表达情况的检测有可能成为判断乳腺癌恶性病变程度和评估预后的参照因素,同时提示高表达的A20可能参与了乳腺癌的疾病发展过程并影响患者的预后。运用Spearman秩相关检验分析A20表达与AR,Ki-67,P53,PR,ER,EGFR和HER-2的表达状态之间的相关性,显示P>0.05,二者也不存在直线相关关系。
本研究认为,A20的高表达是影响乳腺癌患者预后的不利因素,A20可能参与了乳腺癌患者疾病的进展,因此A20有望成为一个检测乳腺癌患者疾病发展及预后的新型生物学指标。然而,A20在乳腺癌的发病机制中所起的作用还需进一步进行蛋白及分子水平的功能验证。
