菊苣酸对活性氧诱导脂质和DNA氧化损伤的影响
2018-07-23肖海芳付晶晶王友玲李凡玥宋元达
肖海芳,付晶晶,王友玲,李凡玥,宋元达
(山东理工大学农业工程与食品科学学院,山东 淄博 255000)
当机体受到各种有害因素的刺激时,体内氧化和抗氧化系统之间的平衡被破坏,引起自由基的蓄积,最终导致氧化应激[1-2]。过量自由基攻击体内脂蛋白、脂质体、微粒体和细胞膜等引起脂质过氧化[3-5]。脂质过氧化产物能够改变生物膜的完整性和渗透性,并使其结构改变、功能丧失[6];低密度脂蛋白发生脂质过氧化后结构改变,其氧化产物具有促动脉粥样化和促炎作用[7]。另外,脂质过氧化产物还具有致突变、致癌等毒性[8]。研究证明,脂质过氧化是心脑血管疾病、癌症、神经失调和衰老等疾病的潜在诱因[9-11]。肝脏组织和脑组织作为动物体内重要的器官,在自由基诱导作用下能够发生脂质过氧化,导致肝脏和脑组织损伤。丙二醛(malondialdehyde,MDA)一直被视为脂质过氧化的标记物,硫代巴比妥酸(thiobarbituric acid,TBA)能够与MDA反应,生成粉红色化合物,该物质在532 nm波长处有吸收峰,因此通过分光光度法对其浓度进行检测非常简单、快捷[12]。
除脂质过氧化外,氧化应激也会引起蛋白氧化损伤和DNA链断裂、DNA碱基修饰等形式的氧化损伤[13]。另外,脂质过氧化次级产物活性羰基化合物能够修饰蛋白和DNA等生物大分子[14-15]。DNA作为人类最重要的遗传物质,其氧化损伤能加速细胞的衰老、凋亡,导致神经退行性疾病、炎症和癌症等疾病的发生[16-18]。研究证实,阿尔茨海默症患者脑组织中DNA氧化产物的水平明显升高[19]。
许多研究者致力于寻找有效的天然抗氧化剂,以减轻自由基对机体生物大分子的氧化损伤[20-21]。菊苣酸是来源于菊苣和紫锥菊等植物的一种多酚类化合物,具有多种功能活性[22-23],但目前鲜有其抗氧化活性的系统报道。研究显示,灌胃菊苣酸后,在SD大鼠肝脏和脑组织中检测到菊苣酸[24]。基于以上,本实验拟从生物大分子角度系统研究菊苣酸的抗氧化活性。前期实验结果表明,菊苣酸对蛋白质氧化损伤具有一定的保护作用。本研究将进一步以小鼠肝匀浆和小鼠脑匀浆为脂质模型,以鲱鱼精DNA和pBR322质粒DNA为DNA模型,通过Cu2+/H2O2和2,2’-偶氮二(2-甲基丙基咪)二盐酸盐(2,2’-azobis(2-amidinopropane)dihydrochloride,AAPH)分别诱导其氧化损伤,探讨菊苣酸对脂质和DNA氧化损伤的影响。
1 材料与方法
1.1 动物、材料与试剂
健康雄性SPF级昆明小鼠15 只,体质量(20±2)g,购自第四军医大学实验动物中心,生产许可证号为SCXK(陕)2007-001。实验用昆明小鼠的饲养管理按照国家相关规定进行。
菊苣酸(纯度≥98%)、AAPH 美国Sigma公司;pBR322质粒DNA 大连宝生物工程有限公司;鲱鱼精DNA 北京百瑞金生物科技有限公司;TBA 美国TEDIA公司;三氯乙酸 天津市博迪化工有限公司;其他化学试剂均为分析纯。
1.2 仪器与设备
UV-1700型紫外-可见分光光度计 日本岛津公司;DY89-Ⅱ型匀浆机 宁波新芝生物科技股份有限公司;5419R型高速离心机、移液枪 德国Eppendorf公司;680型酶标仪、PowerPac 220 V电泳供电装置、水平电泳槽、ChemiDox XRS凝胶成像系统 美国Bio-Rad公司;-80 ℃低温冰箱 日本SANYO公司;PHS-3C型pH计 上海雷磁仪器厂;恒温水浴锅 北京科伟永兴仪器有限公司;BP211D型万分之一天平 德国Sartorius公司;VORTEX-5型漩涡混合器 江苏海门其林贝尔仪器制造有限公司;生化分析型超纯水机 成都优普净化科技有限公司。
1.3 方法
1.3.1 小鼠组织匀浆的制备
实验前昆明小鼠以基础饲料适应性喂养一周,自由饮水。将禁食过夜的昆明小鼠断颈处死,固定于泡沫板上,摘取肝脏组织和脑组织。用无菌生理盐水洗去表面血污,剔除脂肪及结缔组织。称取小鼠肝脏组织或脑组织,用眼科剪将其剪碎后加入生理盐水(1 g组织加入9 g生理盐水),然后置于冰浴中匀浆5 min。将得到的组织匀浆3 000 r/min冷冻离心10 min,取上清液分装,-80 ℃保存备用。经检测小鼠肝匀浆和脑匀浆的脂质质量分数分别为0.32%和0.50%。
1.3.2 菊苣酸对Cu2+/H2O2诱导组织匀浆脂质过氧化水平的影响
向多支离心管中分别加入组织匀浆(脂质终质量浓度为2 mg/mL)和终浓度为10、100、500、1 000 μmol/L的菊苣酸溶液,混匀后加入终浓度分别为25.0、0.1 mmol/L的H2O2和CuSO4溶液,空白对照组以同体积pH 7.4磷酸盐缓冲液代替H2O2和CuSO4溶液,氧化模型对照组以同体积的pH 7.4磷酸盐缓冲液代替菊苣酸溶液。混匀后将各离心管于37 ℃孵育90 min,检测组织匀浆脂质过氧化程度。
1.3.3 菊苣酸对AAPH诱导组织匀浆脂质过氧化水平的影响
菊苣酸与组织匀浆的处理方法同1.3.2节。一定体积AAPH溶液经热分解后分别加入各离心管中,使其终浓度为100 mmol/L;空白对照组以同体积的pH 7.4磷酸盐缓冲液代替AAPH溶液,氧化模型对照组以同体积的pH 7.4磷酸盐缓冲液代替菊苣酸溶液。混匀后将各离心管于37 ℃孵育4 h,检测组织匀浆脂质过氧化程度。
1.3.4 菊苣酸对Cu2+/H2O2诱导DNA氧化损伤的影响
一定体积鲱鱼精DNA(终质量浓度为2 mg/mL)或pBR322 DNA(终质量浓度为20 ng/μL)分别与终浓度为25、50、100、200 μmol/L的菊苣酸溶液混合均匀,封口膜封口后置于37 ℃水浴中孵育30 min,然后分别向各样品中加入终浓度分别为1.0、0.1 mmol/L的H2O2和CuSO4溶液,空白对照组以同体积pH 7.4磷酸盐缓冲液代替H2O2和CuSO4溶液,氧化模型对照组以同体积的pH 7.4磷酸盐缓冲液代替菊苣酸溶液。混匀后将各样品于37 ℃孵育90 min,检测DNA氧化损伤程度。
1.3.5 菊苣酸对AAPH诱导DNA氧化损伤的影响
DNA与菊苣酸的处理方法同1.3.4节。终浓度为10 mmol/L的AAPH溶液热分解后加入各样品中,空白对照组以同体积pH 7.4磷酸盐缓冲液代替AAPH溶液,氧化模型对照组以同体积的pH 7.4磷酸盐缓冲液代替菊苣酸溶液。将各样品于37 ℃孵育4 h,检测DNA氧化损伤程度。
1.3.6 脂质过氧化水平测定
通过TBA法检测组织匀浆脂质过氧化程度[25]。向100 μL处理好的脂质样品中分别加入400 μL 20%的三氯乙酸溶液和400 μL 0.67%的TBA溶液,混匀,置于沸水浴中15 min。冷却后5 000 r/min离心10 min。取上清液于532 nm波长处测吸光度。最终结果以脂质过氧化程度表示,根据公式(1)计算。
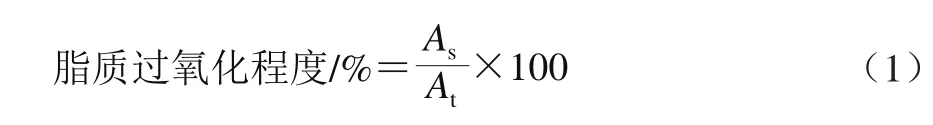
式中:As为样品组在532 nm波长处的吸光度,At为Cu2+/H2O2或AAPH单独处理组在532 nm波长处的吸光度。
1.3.7 鲱鱼精DNA氧化损伤的测定
采用TBA法检测鲱鱼精DNA氧化损伤程度[21],具体操作同1.3.6节。最终实验结果以鲱鱼精DNA氧化损伤程度表示,计算公式同式(1)。
1.3.8 DNA琼脂糖凝胶电泳
取处理好的DNA反应液,加入2 μL上样缓冲液,混合均匀,上样,进行琼脂糖凝胶电泳,电泳电压为100 V,时间为30 min。电泳结束后,采用CHEMIDOCXRS凝胶成像系统对胶片成像,采用Quantity one软件对条带进行半定量分析,定量结果以超螺旋pBR322 DNA相对含量表示,根据公式(2)计算。

式中:Hc为超螺旋pBR322 DNA条带灰度;Hk为开环pBR322 DNA条带灰度。
1.4 数据统计分析
2 结果与分析
2.1 菊苣酸对小鼠肝匀浆脂质过氧化水平的影响
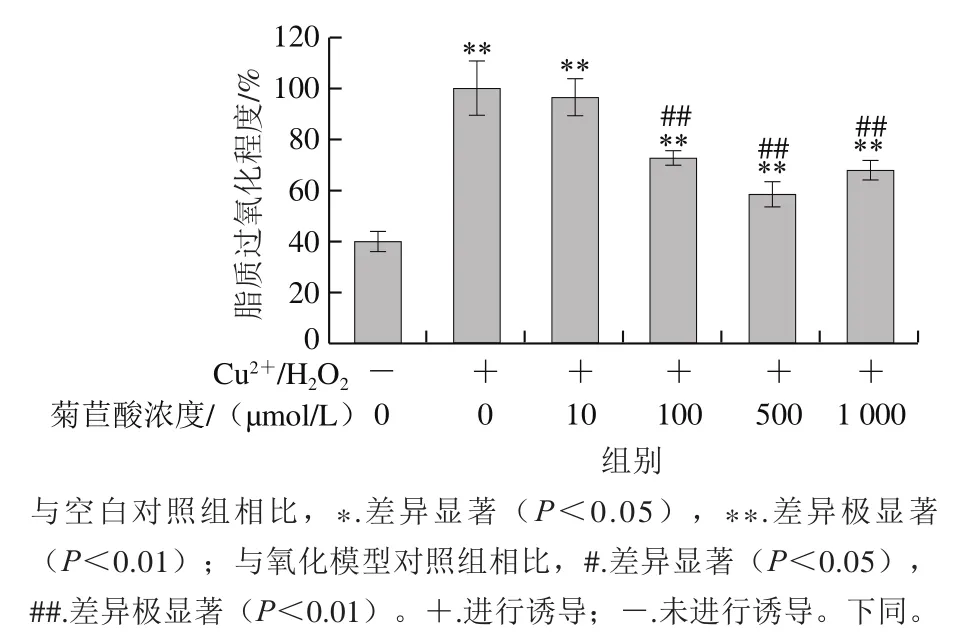
图1 菊苣酸对Cu2+/H2O2诱导小鼠肝匀浆脂质过氧化水平的影响Fig. 1 Effect of chicoric acid on Cu2+/H2O2-induced lipid peroxidation of mouse liver homogenate
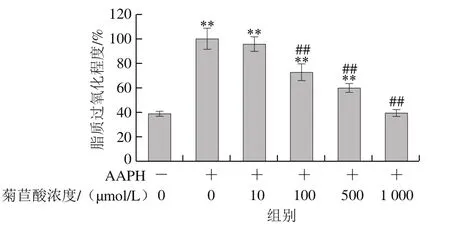
图2 菊苣酸对AAPH诱导小鼠肝匀浆脂质过氧化水平的影响Fig. 2 Effect of chicoric acid on AAPH-induced lipid peroxidation of mouse liver homogenate
作为人体最重要的代谢器官,肝脏中脂质受到自由基攻击后易发生脂质过氧化,引起肝细胞损伤。动物肝匀浆常被用作脂质模型研究活性物质的抗氧化作用[26-27]。由图1、2可以看出,Cu2+/H2O2和50 mmol/L AAPH单独处理后,小鼠肝匀浆脂质过氧化水平与空白对照组相比均明显升高。加入10~1 000 μmol/L菊苣酸孵育后,Cu2+/H2O2诱导体系中小鼠肝匀浆脂质过氧化水平呈不同程度的下降趋势,并且在10~500 μmol/L浓度范围内存在浓度依赖关系,而浓度为1 000 μmol/L的菊苣酸虽然对组织匀浆脂质过氧化也有一定的抑制作用,但与500 μmol/L菊苣酸相比作用效果减弱。上述结果说明,菊苣酸在一定浓度范围内能够抑制Cu2+/H2O2诱导的小鼠肝匀浆脂质过氧化,但在高浓度时抑制作用减弱。在AAPH诱导体系中,10 μmol/L菊苣酸对小鼠肝匀浆无明显保护作用,但100~1 000 μmol/L浓度的菊苣酸对小鼠肝匀浆脂质过氧化均具有明显抑制效果,且呈浓度依赖关系。
2.2 菊苣酸对小鼠脑匀浆脂质过氧化水平的影响
除脂肪组织外,脑是人体脂肪含量最高的组织。脑组织中脂质极易受到自由基破坏,导致多种神经退行性疾病的发生。由图3、4可以看出,Cu2+/H2O2和AAPH诱导体系均能明显升高小鼠脑匀浆的脂质过氧化水平。在Cu2+/H2O2诱导体系中,10~1 000 μmol/L菊苣酸均能明显降低小鼠脑匀浆的氧化损伤程度,提示菊苣酸对小鼠脑匀浆具有明显的保护作用;与图1结果相似,浓度为1 000 μmol/L的菊苣酸对小鼠脑匀浆的保护效果也明显减弱。在AAPH诱导体系中,菊苣酸在10~1 000 μmol/L浓度范围内对小鼠脑匀浆均具有明显的保护作用,且浓度越高,菊苣酸对小鼠脑匀浆的保护效果越强。

图3 菊苣酸对Cu2+/H2O2诱导小鼠脑匀浆脂质过氧化水平的影响Fig. 3 Effect of chicoric acid on Cu2+/H2O2-induced lipid peroxidation of mouse brain homogenate

图4 菊苣酸对AAPH诱导小鼠脑匀浆脂质过氧化水平的影响Fig. 4 Effect of chicoric acid on AAPH-induced lipid peroxidation of mouse brain homogenate
2.3 菊苣酸对鲱鱼精DNA氧化损伤的影响
DNA是活性氧自由基攻击的重要靶分子之一。受到自由基攻击后,DNA发生碱基修饰和链断裂,DNA氧化损伤与多种疾病的发生发展有密切关系。自由基攻击DNA会产生MDA和大量的氧化产物。其中MDA可与TBA反应生成硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)。由于TBARS在532 nm波长处有最大吸收峰,因此,可通过532 nm波长处吸光度衡量DNA样品氧化损伤的程度[28]。532 nm波长处吸光度越大,表明DNA样品氧化损伤越严重。图5、6结果显示,Cu2+/H2O2和AAPH诱导后鲱鱼精DNA氧化损伤程度均明显上升。25~100 μmol/L菊苣酸对Cu2+/H2O2诱导体系中鲱鱼精DNA具有较好的保护作用,但浓度升至100 μmol/L时菊苣酸对其保护效果开始呈减弱趋势;当浓度增加为200 μmol/L时,菊苣酸的保护作用消失。25~200 μmol/L菊苣酸对AAPH诱导的鲱鱼精DNA氧化损伤均具有明显的保护作用,且浓度越高,菊苣酸的保护效果越强。

图5 菊苣酸对Cu2+/H2O2诱导鲱鱼精DNA氧化损伤的影响Fig. 5 Effect of chicoric acid on Cu2+/H2O2-induced oxidative damage to herring sperm DNA

图6 菊苣酸对AAPH诱导鲱鱼精DNA氧化损伤的影响Fig. 6 Effect of chicoric acid on AAPH-induced oxidative damage to herring sperm DNA
2.4 菊苣酸对pBR322 DNA氧化损伤的影响
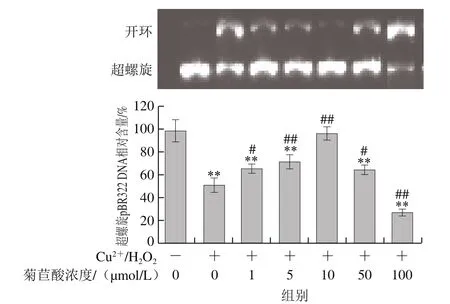
图7 菊苣酸对Cu2+/H2O2诱导pBR322 DNA氧化损伤的影响Fig. 7 Effect of chicoric acid on Cu2+/H2O2-induced oxidative damage to pBR322 DNA
通过琼脂糖凝胶电泳检测pBR322 DNA超螺旋结构向开环结构及线性结构的转变,以反映DNA的氧化损伤程度[29]。由图7可见,空白对照组pBR322 DNA几乎全部以超螺旋结构存在,而经Cu2+/H2O2处理90 min后,以开环形式存在的pBR322 DNA明显增多,说明Cu2+/H2O2诱导体系产生的羟自由基使pBR322 DNA发生氧化损伤,并破坏其超螺旋结构。以1~10 μmol/L菊苣酸孵育后,具有超螺旋结构的pBR322 DNA明显增多,并呈浓度依赖关系。虽然50 μmol/L菊苣酸对Cu2+/H2O2诱导pBR322 DNA氧化损伤也有一定的保护作用,但与10 μmol/L菊苣酸处理组相比保护作用降低;100μmol/L菊苣酸对Cu2+/H2O2诱导pBR322 DNA氧化损伤无保护作用,甚至表现出促氧化作用。上述结果说明,菊苣酸在低浓度时能够抑制Cu2+/H2O2诱导pBR322 DNA氧化损伤,但在高浓度时具有促氧化作用。图8为菊苣酸对AAPH诱导体系中pBR322 DNA超螺旋结构的影响。

图8 菊苣酸对AAPH诱导pBR322 DNA氧化损伤的影响Fig. 8 Effect of chicoric acid on AAPH-induced oxidative damage to pBR322 DNA
由图8可以看出,10 mmol/L AAPH单独处理后,pBR322 DNA超螺旋结构明显被破坏。pBR322 DNA经1~200 μmol/L菊苣酸孵育后,其超螺旋结构明显增多;菊苣酸浓度为25~200 μmol/L时,以超螺旋结构形式存在的pBR322 DNA与空白对照组相比无明显差异。
3 结 论
本研究以不同浓度菊苣酸分别孵育脂质和DNA模型,通过Cu2+/H2O2产生的羟自由基和AAPH产生的烷氧自由基诱导后,分析菊苣酸对脂质和DNA氧化损伤的影响。结果表明,对羟自由基诱导的脂质和DNA氧化损伤,菊苣酸在一定浓度范围内具有明显的抑制作用,但高浓度菊苣酸对二者的保护作用减弱或呈现促氧化作用。在烷氧自由基诱导体系中,菊苣酸对脂质和DNA具有明显保护作用,且菊苣酸浓度越高,保护效果越好。上述实验结果与菊苣酸对小鼠组织蛋白氧化损伤的作用结果基本一致。
