海州常山叶片愈伤组织诱导及不定芽再生1)
2018-07-20杨秀莲胡蝶宋佳妮王良桂
杨秀莲 胡蝶 宋佳妮 王良桂
(南京林业大学,南京,210037)
海州常山(Clerodendrumtrichotomum),马鞭草科大青属,落叶灌木或小乔木,叶片大呈心形且具有特殊气味,又称臭梧桐[1];在我国广泛分布,国外如日本、朝鲜及菲律宾北部也有分布[2]。海州常山形态为白花、红萼、蓝果,且花萼形状奇特,呈五角形,花果期长达半年,是夏季观花、秋季观果赏萼的优良树种[3]。海州常山对不良环境有很强的耐受和抵抗能力,可用于盐碱地区及矿区等土地条件恶劣地区的绿化[4];其枝叶含有可以杀灭红蜘蛛、棉蚜虫和地下害虫的化学物质[5],种子的含油量也很高,可在制备生物农药、开发生物柴油等新能源的领域进行研究和推广[6-7]。综上,海州常山具有很高的研究价值和很好的应用开发前景,可在城市园林绿化中进行广泛推广[8-11]。
海州常山常生长于山坡、野地等地方,前人对其研究较晚,现今栽培应用的还很少。目前针对海州常山的研究大都集中在抗逆性以及茎叶有效化学成分和药理作用方面,对繁殖技术的研究主要集中在扦插和分株繁殖[12]上,组培快繁方面的研究较少,现只见宋婷等[13]、姜丽琼等[14]和包峥焱[15]用海州常山茎段作为外植体进行快繁的研究,未见有外植体经历脱分化、再分化间接形成完整植株的报道。本研究以海州常山嫩叶为外植体,从消毒方法、培养基种类、培养条件、植物生长调节剂配方等方面,对海州常山叶片愈伤组织的诱导、增殖和分化进行探讨,以期建立高效的离体再生技术体系,弥补海州常山完整组培体系的空缺,为种质资源的保护及规模化生产提供参考,也为后续的细胞或分子水平的研究提供基本的试验材料。
1 材料与方法
1.1 材料
材料采自南京林业大学国家级实验教学示范中心海州常山盐城种源1年生扦插苗,选取健康、无病虫害的新梢嫩叶为外植体。
1.2 试验方法
1.2.1 无菌体系的建立
叶片先用加有洗洁精的水清洗,毛刷轻刷去叶面上的杂质后放在流水下冲洗1 h。预处理后,将叶片放置超净工作台,用75%酒精表面灭菌30 s,无菌水冲洗3~4次,再用0.1%的HgCl2或5%的NaClO溶液分别进行1、3、5、7 min的表面灭菌,无菌水冲洗5~6次,最后将嫩叶切成0.5 cm2大小的方块,接种于添加2.0 mg·L-1BA和0.1 mg·L-1NAA的MS培养基上,同时添加7.0 g·L-1琼脂和30 g·L-1蔗糖,以下均同。每个处理接种15瓶,每瓶3块四周具有切口的叶片,重复3次。培养条件为温度(25±2)℃,暗培养。观察其愈伤组织诱导及生长情况,30 d后统计外植体污染率、死亡率和存活率。
1.2.2 愈伤组织诱导基本培养基的筛选
用最佳的消毒方法对叶片消毒后,将其切成0.5 cm2大小的方块,接种到添加2.0 mg·L-1BA和0.1 mg·L-1NAA的MS、1/2 MS、WPM和B5四种不同基本培养基上。每个处理接种15瓶,每瓶3块叶片,重复3次。培养条件为温度(25±2)℃,暗培养。观察其愈伤组织诱导及生长情况,30 d后统计愈伤组织形成率。
1.2.3 愈伤组织诱导光暗条件筛选
将叶片接种在添加2.0 mg·L-1BA和0.1 mg·L-1NAA的MS培养基上,分别进行光暗交替培养和暗培养,每个处理接种15瓶,每瓶3块叶片,重复3次。观察其愈伤组织诱导及生长情况,30 d后统计愈伤组织形成率、褐化率和愈伤组织生长状况。
光暗交替培养条件为温度(25±2)℃,光照强度2 000 Lx左右,光照时间14 h·d-1。
暗培养条件为温度(25±2)℃,无光照。
1.2.4 愈伤组织诱导植物生长调节剂配方的筛选
根据上述试验结果,在最适培养基上进行激素(6-BA+NAA)的筛选,其中6-BA的质量浓度分别为0.5、1.0、2.0、4.0 mg·L-1,NAA质量浓度分别为0.1、0.5 mg·L-1,每个处理接种15瓶,每瓶3块叶片,重复3次。培养条件为温度(25±2)℃,暗培养。观察其愈伤组织诱导及生长情况,30 d后统计褐化率和愈伤组织形成率。
1.2.5 愈伤组织増殖植物生长调节剂配方的筛选
将初代培养获得的色泽透明浅绿、结构较致密的愈伤组织切块接种于MS培养基中。设置原诱导愈伤组织效果最好培养基中的激素处理组合为第1种处理,第2种处理将第1种处理中生长素(NAA)的质量浓度降低一半,第3种处理将第1种处理中的生长素(NAA)质量浓度升高一倍,第4种处理不添加任何生长调节剂作为对照(表1)。每个处理接种15瓶,每瓶3块叶片,重复3次。培养条件为温度(25±2)℃,暗培养。20 d后统计各处理的愈伤组织的增殖情况。

表1 愈伤组织增殖植物生长调节剂配方
1.2.6 愈伤组织分化植物生长调节剂配方的筛选
将愈伤组织切块接种于MS培养基中进行分化培养。其中6-BA质量浓度为0.5、1.0 mg·L-1,NAA质量浓度为0、0.05、0.10 mg·L-1,共6种组合。每个处理接种15瓶,每瓶3块愈伤组织,重复3次。培养条件为温度(25±2)℃,光照强度2 000 lx左右,光照时间14 h·d-1。30 d后统计各处理的愈伤组织的增殖分化情况。
1.3 数据统计分析
试验数据用Microsoft Excel 20010统计汇总后,利用SPSS 24.0统计分析软件对试验数据进行多重比较分析。
试验主要统计指标有:
污染率=(污染的外植体数/接种的外植体总数)×100%;
死亡率=(死亡的外植体数/接种的外植体总数)×100%;
存活率=(存活的外植体数/接种的外植体总数)×100%;
愈伤组织形成率=(产生愈伤组织的外植体数/接种的外植体总数)×100%;
褐化率=(褐化的愈伤组织数/接种的愈伤组织总数)×100%;
增殖率=(愈伤组织体积增大未褐化的数量/接种的愈伤组织总数)×100%;
分化率=(产生芽点分化出芽苗的愈伤组织数量/接种的愈伤组织总数)×100%。
2 结果与分析
2.1 无菌体系的建立
由表2可知,随着消毒时间的加长,外植体污染率呈现下降的趋势,而死亡率呈现上升的趋势,存活率先上升后下降。用0.1% HgCl2灭菌7 min时,外植体污染率达到最低,为6.67%,死亡率达到最高,为57.78%。存活率在消毒5 min时最高,为64.44%,此时,外植体污染率和死亡率分别为22.22%和13.33%。0.1% HgCl2处理下,灭菌5 min后,外植体死亡率显著降低。5% NaClO灭菌时总体上效果比0.1% HgCl2处理差。灭菌7 min,外植体污染率达到最低,为15.56%,死亡率达到最高,为51.11%,存活率在消毒3 min时最高,为42.22%,此时外植体污染率和死亡率分别为42.22%和15.56%。综合来看,0.1% HgCl2灭菌5 min,存活率最高,污染率和死亡率也相对较低,因此,对于海州常山的嫩叶来说,最佳的表面灭菌方法是,先用75%酒精处理30 s,无菌水冲洗3~4次,0.1% HgCl2溶液处理5 min,无菌水冲洗5~6次。
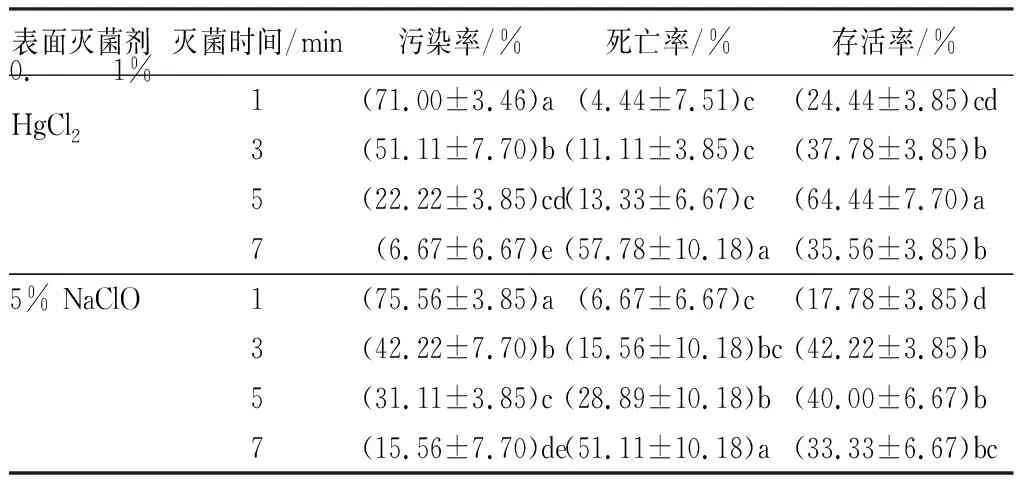
表2 不同消毒方法对叶片表面灭菌效果的影响
注:表中数据为平均值±标准差;同一灭菌剂不同灭菌时间时,同列数据后不同字母代表差异显著(P<0.05)。
2.2 愈伤组织的诱导
2.2.1 不同基本培养基对叶片愈伤组织诱导的影响
由表3可知,B5和1/2 MS培养基的愈伤组织形成率较低,分别为6.67%和15.56%,与MS和WPM培养基的愈伤组织形成率呈极显著差异(P<0.01)。MS、WPM培养基愈伤组织诱导率最高,同为37.78%,但MS基本培养基测定结果3次重复间的偏差值更小,结果更稳定,所以海州常山叶片诱导愈伤组织的最适培养基为MS培养基。

表3 不同基本培养基对叶片愈伤组织诱导的影响
注:表中数据为平均值±标准差;同列数据后不同字母代表差异极显著(P<0.01)。
2.2.2 光暗条件筛选
光暗交替培养和暗培养对海州常山叶片愈伤组织诱导产生极显著影响(P<0.01)。外植体培养到15~20 d时,置于无光条件下培养的叶片开始卷曲(图1A),25 d开始出现愈伤组织,愈伤组织呈黄绿色或绿色,较疏松(图1B),愈伤组织形成率为44.35%,褐化率为53.23%。而置于光照条件下培养的叶片愈伤组织形成率为0,且褐化严重,褐化率高达84.44%,比暗培养高出31.21%(表4)。所以黑暗条件下培养更有利于海州常山叶片诱导愈伤组织。

A.接种20 d左右叶片开始出现卷曲;B.接种25 d叶片开始脱分化进入细胞分裂期;C.愈伤组织黄绿,体积略有增大,较紧实;D.愈伤组织增殖有结构形状生成,表面紧实颗粒状但未分化;E.愈伤组织分化,叶片生长变薄,颜色变深;F.植株长势良好,叶面纹路清晰,叶缘出现波状齿;比例尺:0.5 mm。

图1 海州常山叶片愈伤组织诱导及不定芽再生
注:表中数据为平均值±标准差;同列数据后不同字母代表差异极显著(P<0.01)。
2.2.3 植物生长调节剂配方的筛选
由表5可知,6-BA与NAA不同质量浓度组合的8个处理中,处理1愈伤组织形成率最高,可达66.67%,褐化率最低,为28.89%,与其他7个处理差异显著;其次为处理2和处理5愈伤组织形成率均可达37.78%,二者与处理4、6、8均无显著差异;处理7的愈伤组织形成率效果最差,为4.44%,褐化率也是最高,为91.11%。6-BA为0.50 mg·L-1时愈伤组织形成率均较高,分别为66.67%和37.78%,6-BA质量浓度升高后,愈伤组织形成率有所降低,说明在海州常山叶片愈伤组织的形成过程中,细胞分裂素6-BA在质量浓度较低时起到促进作用。随着6-BA质量浓度的升高,其愈伤组织形成率并非呈现单纯的上升或者下降趋势,在与其搭配的NAA质量浓度变化的共同作用下产生曲线的变化,说明对叶片诱导愈伤组织来说,生长素与细胞分裂素的比值比质量浓度更重要。综合愈伤组织的诱导率和褐化率分析结果,得出海州常山叶片愈伤组织诱导的最佳培养配方为1号处理,即MS+6-BA 0.50 mg·L-1+NAA 0.10 mg·L-1。

表5 不同质量浓度6-BA和NAA对愈伤组织诱导的影响
注:表中数据为平均值±标准差;同列数据后不同字母代表差异显著(P<0.05)。
2.3 愈伤组织的増殖培养
从表6可知,在未添加任何激素的MS培养基上,海州常山愈伤组织不生长并且发生褐化,而其他3个添加了激素的处理都出现了不同程度的增殖甚至是分化,这表明了在海州常山愈伤组织增殖过程中,添加外源生长调节剂能有效促进愈伤组织的增殖(图1C)。在4种处理中,2号处理的愈伤组织增大最明显,生长情况最佳,因此,海州常山愈伤组织增殖培养的最适培养方案为MS+6-BA 0.50 mg·L-1+NAA 0.05 mg·L-1。
表6不同质量浓度6-BA和NAA对愈伤组织增殖培养的影响

处理6-BA质量浓度/mg·L-1NAA质量浓度/mg·L-1愈伤组织平均大小/mm生长情况10.500.1010.86淡黄绿色体积,较致密20.500.0521.76绿色,较致密,有颗粒状结构30.500.2014.33黄绿色,较疏松4007.80不生长并且褐化
2.4 愈伤组织的分化培养
从表7可知,将海州常山愈伤组织接种在分化培养基上培养30 d后,有的生长调节剂处理下愈伤组织量有增加,颜色由浅绿色变黄绿色,表面有颗粒状的小突起出现,但未出现分化(图1D),如处理2:6-BA 0.50 mg·L-1+NAA 0.05 mg·L-1,有的生长调节剂处理下愈伤组织量有增加并出现分化(图1E),如处理6:6-BA 1.00 mg·L-1+NAA 0.10 mg·L-1。从试验结果来看,增殖率和分化率最高的都是处理1,增殖率为55.56%,分化率为13.33%,处理1与处理2、3、5、6均达到差异显著水平。故海州常山愈伤组织最佳分化培养基为MS+6-BA 0.50 mg·L-1+NAA 0.01 mg·L-1。

表7 不同质量浓度6-BA和NAA对愈伤组织分化的影响
注:表中数据为平均值±标准差;同列数据后不同字母表示差异极显著(P<0.01);+生长势差;++生长势一般;+++生长势良好。
继续对不同质量浓度NAA做多重对比(表8),可以得出,海州常山叶片愈伤组织分化过程中不同质量浓度NAA的处理均达到显著水平,且低质量浓度有利于愈伤组织的增殖和分化。由表6所得出的海州常山愈伤组织的最佳增殖培养基处理MS+6-BA 0.50 mg·L-1+NAA 0.05 mg·L-1,在海州常山愈伤组织的分化培养中未能成功诱导分化,说明在该生长调节剂处理下增殖的愈伤组织是非胚性愈伤组织,即表7中的2号处理不适合愈伤组织分化培养。6号处理MS+6-BA 1.00 mg·L-1+NAA 0.10 mg·L-1,增殖率较高,达到42.22%,但分化率较低,仅6.67%,分化后芽苗的生长状况较好,茎生长明显,叶开展(图1F)。由此可推测,6号处理不太适合愈伤组织的增殖分化培养,但可能适合用于后期茎段的初代培养或者不定芽增殖培养。

表8 不同质量浓度NAA对增殖率、分化率的多重比较
注:表中数据为平均值±标准差;同列数据后不同字母表示差异极显著(P<0.01)。
3 结论与讨论
组织培养的关键技术之一是建立无菌体系,外植体消毒方法的选择至关重要[16]。外植体进行表面灭菌要选择合适的灭菌剂及浓度、灭菌时间及操作顺序,不同的植物种类、不同的外植体部位对同样的表面灭菌过程的反应有所差异,最终培养效果也会不同。常用的表面灭菌剂有0.1%的HgCl2、1%~10%的NaClO、1%的AgNO3等,无论是哪种表面灭菌剂,浓度太低时间太短,灭菌不彻底,外植体的污染率就得不到控制;浓度过高,时间过长,对植物造成的伤害太大,会导致外植体细胞的破坏及产生大量次生代谢物质,进而使外植体产生褐化甚至死亡,降低外植体接种在培养基上后续培养的存活率,只有选用适宜的浓度和灭菌时间才能既消灭细菌又保持外植体的活性。本试验中,5% NaClO和0.1% HgCl2灭菌时间太短(如1 min)无法控制污染,时间太长(如7 min)对于叶片有极强的毒害作用,死亡率升高。此外,还发现0.1% HgCl2溶液比5% NaClO溶液进行相同时间灭菌处理时,0.1% HgCl2的效果更好,周宇晴等[17]在试验中也得出0.1% HgCl2效果优于5% NaClO。本试验最终得出适宜海州常山叶片最佳的消毒方法为75%酒精处理30 s,无菌水冲洗3~4次,再用0.1% HgCl2溶液处理5 min,无菌水冲洗5~6次,叶片的成活率最高,达到64.44%。
离体培养的成功与否与基本培养基的类型也息息相关。不同培养基中含有不同浓度的无机营养物、碳源、维生素、生长调节物质和有机附加物等物质,造成培养效果不同。各种植物由于基因型不同适用于不同基本培养基,如棱角山矾叶片适用B5培养基[18],珙桐[19]、悬铃木[20]在WPM培养基长势良好,本试验选择MS、1/2 MS、WPM和B5对海州常山的叶片进行愈伤组织的诱导,结果得出,含有较高浓度硝酸盐和NH4+的MS基本培养基为海州常山叶片愈伤组织诱导的最适培养基。
不同光照条件也会影响植物愈伤组织的生长与发育。本试验中暗培养时海州常山叶片愈伤组织的诱导率高,结构较疏松,而光暗交替培养时愈伤组织结构紧实,不利于分化。这与油桃[21]、毛桃[22]、蔷薇[23]、膝柄木[24]和青钱柳[25]的研究结果相似,都认为暗培养有助于愈伤组织诱导。
愈伤组织诱导和分化也是植物组织培养中的两个关键部分。愈伤组织是在外植体的受创面附近发生细胞加速分裂形成的无组织结构的细胞群。愈伤组织生长情况的不同会影响后续的愈伤组织分化及成苗的培养效果,在试验中,植物生长调节剂的种类及配比对愈伤组织诱导和分化会产生明显的直接影响[26-27]。6-BA和NAA是愈伤组织诱导和分化中常用的两种激素,陈颖[28]进行银杏叶的愈伤组织诱导发现,NAA与6-BA组合效果最好,本试验也采用NAA与6-BA进行质量浓度筛选。试验结果显示,细胞分裂素6-BA对海州常山愈伤组织形成率有极显著的影响,且质量浓度较低时(0.5 mg·L-1)起到促进作用,与Li et al.[29]和陈雪等[30]已报道的结果相似,较高质量浓度的细胞分裂素阻碍愈伤组织的诱导;而低质量浓度的生长素NAA(0.01 mg·L-1)有利于海州常山愈伤组织的分化,这与范小峰等[31]研究结果相似。木本植物进行愈伤组织增殖时,发现采用比愈伤组织诱导阶段更低的生长素质量浓度有利于愈伤组织的增殖[18,32],本试验也证实了这一点,愈伤组织诱导的最适培养基为MS+6-BA 0.50 mg·L-1+NAA 0.10 mg·L-1,愈伤组织最适增殖培养基为MS+6-BA 0.50 mg·L-1+NAA 0.05 mg·L-1。
本研究以海州常山的嫩叶作为外植体,进行愈伤组织的诱导和分化研究,以期为海州常山种质资源的保护及规模化生产提供参考,也是为海州常山遗传转化体系的建立奠定基础,后续就如何克服愈伤组织的褐化,提高愈伤组织分化率和不定芽的生根及移栽还可进一步试验研究。
