培养发散思维能力 提高化学复习效率
2018-07-20江苏
江苏
印志林
化学教学中必须培养学生的创造性思维,思维的创造性又以发散性思维为核心。发散思维就是人们对同一问题从不同角度、不同侧面和不同层次进行分析和探索的思维方法。通过发散构成点、线、面、体的立体知识网络,能最大限度地激发学生的潜能,增强兴趣,发展能力,提高素质。
在注重提高学生科学素养和创新能力的今天,化学复习更应该将发散思维贯穿于教学的全过程。为说明问题起见,现以高考中的热点知识二氧化硫为例,谈谈如何在化学复习中培养学生的发散思维能力。
一、横向发散,扩展知识点
横向发散是指在知识网络中平行知识点之间的发散。通过这种发散,能弄清平行知识点之间的联系,分辨相关概念和原理的适用条件。
复习时先引导学生理清SO2的性质:毒性、水溶性、酸性氧化物、氧化性、还原性、漂白性,然后要求学生思考下列问题:
1.中学化学中有哪些有毒的气体?
2.比较相同条件下SO2、NH3、Cl2、HCl在水中溶解度的大小。
3.从性质上看,氧化物有哪些类型?各类氧化物有哪些通性?
4.比较H2SO3、H3PO4、CH3COOH、H2CO3、H2S、HClO的酸性强弱。
5.元素的价态与其氧化性和还原性之间存在怎样的关系?
6.中学化学中哪些物质有漂白性?漂白的原理有什么不同?
以上问题从SO2的性质出发,横向联系到常见气体的溶解度、气体的毒性与大气污染、氧化物的性质与分类、常见酸的酸性强弱、元素的价态与其性质的关系等基本知识点,比较了容易混淆的几种物质的漂白机理,牵一发而动全身,引导学生由此及彼地联想,通过小组间比赛式的问答,激发了学生的学习热情,也教会了学生复习的方法。
二、纵向发散,延伸知识线
纵向发散是指在知识网络不同层次的知识点之间的发散。通过这种发散,能认识不同层次知识点之间的联系与发展。
SO2的化学性质丰富,其中的重点和难点是其还原性。对于SO2的还原性,教材中只给出了SO2与O2的反应,学生仅仅了解这一点是远远不够的。复习中应从分析该反应的反应原理入手,从两个方面进行发散。
1.从氧气到其他氧化剂
SO2的还原性较强,除O2外,其他很多氧化剂都能与之反应,以下反应都很常见。







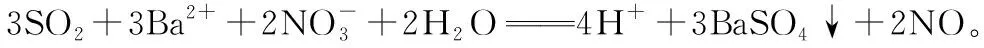


2.从SO2到其他含硫化合物
亚硫酸、亚硫酸盐、亚硫酸氢盐都具有较强还原性,能被氧气等氧化剂氧化,所以这些物质都很容易变质。


上述问题从SO2的还原性入手,由浅入深地纵向发散,让学生深刻地领会到+4价的硫元素有较强的还原性,能与氧气反应,更能与比氧气的氧化性强的物质反应,且反应的结果都是+4价的硫元素被氧化为+6价。虽然上述反应离子方程式的形式有所不同,但本质都是体现了+4价硫元素的还原性,可谓“形散而神不散”。通过这种发散,能促使学生抓住本质,对于知识的理解也更加深刻。
三、迁移发散,编结知识网

1.从价态上分析,此反应有什么特点?
2.归中反应的本质是什么?中学化学中学过哪些归中反应?
3.将H2S通入浓硫酸中,在不加热和加热时分别如何反应?
4.实验室配制亚铁盐(如FeSO4)溶液时,为什么要向溶液中加入少量的铁粉?
5.实验室常用浓盐酸和氯酸钾反应(不需加热)制氯气,写出该反应的化学方程式。
6.工业上可将高浓度NOx气体(含NO、NO2)通入Na2CO3溶液中以制备NaNO2,写出该反应的化学方程式。

( )
A.①③ B.③⑥
C.②④⑥ D.①②④⑤⑦
8.在一定的条件下,NO和NH3可以发生反应生成无污染性的物质。现有NO和NH3的混合物1 mol,充分反应后所得的产物中,若经还原得到的N2比经氧化得到的N2多1.4 g。
(1)写出反应的化学方程式并标出电子转移的方向和数目。
(2)若以上反应进行完全,试计算反应混合物中NO和NH3的物质的量可能是多少。
以上问题从分析SO2和H2S的反应特征着手,总结了常见归中反应的类型,将中学阶段的归中反应尽收其中。在学生的思维高度发散时,又要求归纳归中反应的本质特征,要求将归中反应的规律迁移到实验设计和化学计算中,培养了学生用所学知识解决实际问题的能力;设计的问题密切联系生活和生产实际,让学生感到化学知识就在自己身边,增强了学习化学的兴趣。
四、比较发散,完善知识面
比较发散是指在知识网络中相关联的知识间进行纵横对比的发散。通过这种发散,能深刻理解知识的内涵和外延。
SO2是酸性氧化物,从分子组成形式到化学性质都与CO2有很多相似之处。为了防止CO2的知识对学习SO2的性质造成负迁移,可设计如下问题:
1.写出少量的SO2通入苯酚钠溶液的化学方程式。
2.如何除去CO2中少量的SO2?
3.将少量的SO2通入Ca(ClO)2溶液,写出该反应的化学方程式。


5.下图是检验某无色气体A是SO2和CO2的混合气体的装置图,请回答下列问题。

(1)B中加入的试剂是_________________,作用是___________________。
(2)C中加入的试剂是___________________,作用是___________________。
(3)D中加入的试剂是___________________,作用是___________________。
(4)实验时,C中应观察到的现象是___________________。

五、综合发散,培植知识树
综合发散是在知识网络中进行分析、归纳、运用的发散。通过这种发散使知识系统化,克服思维定式,做到理论联系实际。
化学复习应密切联系生产生活实际,强调知识的灵活运用。为此可设计下列问题:
1.什么是酸雨?酸雨产生的原因有哪些?采取哪些措施可以减少酸雨?
2.传统的煤、石油作燃料,其主要缺点是什么?与传统的煤、石油燃料相比,哪种物质可作为新的能源?主要优点又是什么?
3.收集一份雨水样品,将每隔一定时间测定的雨水样品的pH值记录如下表:

测定时间/h01234…8雨水的pH值4.734.624.564.554.55…4.55
写出酸雨开始呈酸性的化学方程式。这种雨水的pH值逐渐减小,其原因何在?

4.SO2会对环境和人体健康带来极大的危害,工业上采取下列方法减少SO2的排放。
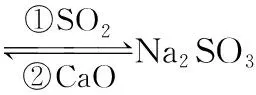

方法2:用氨水除去SO2


5.中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25 g/L。某兴趣小组用下图所示装置(夹持装置略)收集某葡萄酒中SO2,并对含量碱性测定。

(1)仪器A的名称是________,水通入A的进口为________。
(2)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为___________________。
(3)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定。若滴定终点时溶液的pH=8.8,则选择的指示剂为___________________;若用50 mL滴定管进行实验,当滴定管中的液面在“10”处,则管内液体的体积________(填序号:①=10 mL,②=40 mL,③<10 mL,④>40 mL)
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为________g/L。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施___________________。

上述问题涉及SO2的污染、防治及其应用,综合了SO2的性质、化学实验和化学计算等多方面的知识,强调化学知识的实际应用,学生在解题过程中能体会到SO2的弊与利,学会辩证地分析问题,体现了发散思维的流畅性、变通性和独特性。

