巧避陷阱 高效解答
2018-07-20宁夏
宁夏
王开山
NA是定量考查微粒数目的重要形式,近年在全国各省、区(市)高考试题中重现率很高。该类型试题难度不大,但考查形式灵活、多样,部分问题设置了隐蔽的陷阱,不易得分,有较好的区分度。
笔者归纳了近年全国各地区化学高考试题对NA考查常设置的十个陷阱,与大家交流。
陷阱一 特殊物质中的原子数
【例1】用NA表示阿伏加德罗常数的数值,下列说法正确的是
( )
A.0.1 mol氖气中氖原子数目为0.2NA
B.1 mol白磷中含有的磷原子数目为NA
C.常温下,1 L 0.1mol·L-1的NH4NO3溶液中氮原子数为0.1NA
D.室温下,21.0 g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA

答案:D
要点分析:特殊单质中原子数目的确定和混合物中原子数目的确定是考查热点,难度适中。特殊单质主要围绕稀有气体(He、Ne等)、白磷(P4)、臭氧(O3)等进行考查。混合物中原子个数的解答策略经常是 “极端假设法”,这也是高中化学思想方法之一。
陷阱二 特殊物质或反应中的分子数
【例2】用NA表示阿伏加德罗常数的数值,下列说法正确的是
( )
A.常温常压下,4.6 g NO2气体中含有的NO2分子数为0.1NA
B.标准状况下,5.6 L NO和5.6 L O2混合后的分子总数为0.5NA
C.足量MnO2和4 mol浓HCl发生反应,生成Cl2分子数小于NA
D.一定条件下,1 mol N2和3 mol H2反应生成NH3的分子数为2NA

答案:C

陷阱三 特殊晶体中的微粒数
【例3】用NA表示阿伏加德罗常数的数值,下列说法正确的是
( )
A.58.5 g氯化钠固体中含有NA个氯化钠分子
B.1 mol SiO2中含NA个二氧化硅分子
C.1 mol Na2O2固体中含离子总数为4NA
D.熔融状态下,1 mol NaHSO4中总的离子数为2NA

答案:D

陷阱四 特殊物质中的共价键数
【例4】用NA表示阿伏加德罗常数的数值,下列说法正确的是
( )
A.4.5 g SiO2晶体中含有硅氧键数目为0.3NA
B.12 g金刚石含有共价键数目为4NA
C.1 mol石墨中含有共价键的数目为3NA
D.1 mol苯中含有碳碳双键数目为3NA
解析:A.在SiO2晶体中,1个硅原子连接4个氧原子,即1 mol SiO2晶体中含有的硅氧键数目为4NA。4.5 g SiO2为0.075 mol,所以晶体中含有的硅氧键数目为0.3NA;B.在金刚石中,1个碳原子与另外4个碳原子以共价键相结合,任意一个碳碳共价键都被两个碳原子共用,所以共价键的个数是碳原子个数的2倍,即12 g 金刚石含有的共价键数应为2NA;C.石墨中每个碳碳键都被两个碳原子共用,每个碳原子都与另外三个碳原子连接,所以1 mol石墨中含有共价键的数目为1.5NA;D.苯中的碳碳键是介于单键和双键之间的特殊共价键,并非碳碳双键。
答案:A
要点分析:对共价键数目的考查主要集中在部分原子晶体和含有特殊共价键的分子中。考查范围较小,难度适中。1.原子晶体中要采用均摊法确定同种原子之间形成的共价键数,不同种原子之间共价键数的确定不采用均摊法。2.一定量有机物中C=C数目确定的前提是确定有机物分子中是否存在C=C,如苯环中不存在C=C。
陷阱五 特殊氧化还原反应转移电子数
【例5】用NA表示阿伏加德罗常数的数值,下列说法正确的是
( )
A.1 mol Na2O2与足量CO2反应转移电子数为2NA
B.23 g钠在氧气中完全反应失去电子数为NA
C.1 mol Cl2参加反应转移电子数一定为2NA
D.在反应中,每生成3 mol I2转移的电子数为6NA
解析:A. Na2O2与CO2的反应属于“歧化反应”,1 mol Na2O2与足量CO2反应转移电子数为NA;B.钠与氧气反应无论生成Na2O还是Na2O2,反应都是钠元素的化合价从 0价升高到+1价,即23 g钠在氧气中完全反应失去电子数为NA;C.1 mol Cl2参加反应如果全部作氧化剂,则转移电子数为2NA;如果一半作氧化剂,一半作还原剂,则1 mol Cl2参加反应转移的电子数为NA,如Cl2和NaOH溶液的反应;D.具体转移电子数目应视具体反应而定。
答案:B
要点分析:计算氧化还原反应中电子转移的数目,要考虑反应的特殊性。清楚特殊氧化还原反应的历程及反应物或生成物的量与转移电子数的关系是解答的关键。
陷阱六 特殊溶质在溶液中的离子数
【例6】用NA表示阿伏加德罗常数的数值,下列说法正确的是
( )
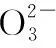
B.1 L 0.1 mol·L-1乙酸溶液中H+数小于0.1NA
C.将0.1 mol FeCl3溶于1 L水中,所得溶液中Fe3+的数目为0.1NA
D.100 mL 1.0 mol·L-1的KClO3溶液中Cl-数目为0.1NA
答案:B
要点分析:溶液中离子数目的考查,要注意:1.离子在水溶液中能不能发生水解,如果是弱酸阴离子或弱碱阳离子,则会发生部分水解,离子的数目会减少;2.离子如果是由弱电解质电离来的,则电离出的离子数是比较少的;3.计算物质的量浓度时要考虑溶液的体积,而非水的体积;4.部分离子是以离子团的形式存在。
陷阱七 特殊物质在特殊状况下的微粒数
【例7】用NA表示阿伏加德罗常数的数值,下列说法正确的是
( )
A.标准状况下,22.4 L CHCl3中含有的氯原子数目为3NA
B.在25℃,101 kPa时,22.4 L氢气中含有氢原子的数目为2NA
C.标准状况下,22.4 L SO3的原子数为4NA
D.标准状况,1.12 L Cl2含有Cl原子数目为0.1NA
解析:A.CHCl3在标准状况下为液体;B.25℃,101 kPa为非标准状况;C.SO3在标准状况下为液体;D.标准状况,1.12 L Cl2为0.05 mol, 含有0.1NA个原子。
答案:D
要点分析:通过标准状况下气体摩尔体积(22.4 L·mol-1)计算微粒数目是高频考点,难度不大。运用22.4 L·mol-1计算一定体积的物质中所含微粒数时要满足:1.物质的状态为气态;2.在标准状况下(0℃、101kPa)。
陷阱八 特殊分子中的中子数
【例8】用NA表示阿伏加德罗常数的数值,下列说法正确的是
( )
A.0.1 mol D2O中含有的中子数为0.8NA
B.0.1 mol18O2和16O2的混合物中中子数为1.8NA
C. 4.8 g C18O2中含有的中子数为2.6NA
D.0.1 mol H37Cl的中子数为1.8NA
解析:A.1个D原子含有1个中子,0.1 mol D2O中含有NA个中子;B.根据“极端假设法”,0.1 mol18O2和16O2的混合物中中子数大于1.6NA小于2NA;C.C18O2的摩尔质量为48 g/mol,1 mol C18O2的中子数为26NA,4.8 g C18O2的中子数为0.1 mol,即含有的中子数为2.6NA;D.1 mol H37Cl的中子数为20NA,0.1 mol的H37Cl含有的中子数为2NA。
答案:C
要点分析:中子数目的考查主要集中在同位素原子方面,准确确定同位素原子的中子数和摩尔质量是解答的关键。
陷阱九 特殊电化学问题中的电子转移数
【例9】用NA表示阿伏加德罗常数的数值,下列说法正确的是
( )
A.氢氧燃料电池工作时,每消耗1 g氢气,转移电子数为NA
B.电解饱和食盐水,每生成标况下22.4 L氯气,转移电子数为NA

D.电解精炼铜时,阳极质量减轻64 g,转移电子数为2NA

答案:A
要点分析:原电池和电解池种类繁多,但只要抓住工作原理和关键的电极反应式就能轻松解答该类试题。
陷阱十 特殊分散系中的胶粒数
【例10】用NA表示阿伏加德罗常数的数值,判断下列说法是否正确。
A.1 mol FeCl3加入沸水中完全反应转化为Fe(OH)3胶体后,胶体粒子数目为NA( )
B.饱和FeCl3溶液与沸水完全反应生成1 mol Fe(OH)3胶体,则原溶液中Fe3+数目为NA( )
解析:FeCl3与水反应制备Fe(OH)3胶体属于水解,反应的Fe3+只是其中的一部分,不会完全反应生成Fe(OH)3胶体。
答案:A.× B.×
要点分析:很多胶体都是水解生成的,胶粒的数目小于原溶液中的离子数目。

