Granger因果分析1型糖尿病患儿静息态fMRI数据
2018-07-19张俊然王梅云刘太元四川大学电气信息学院四川成都60065河南省人民医院影像科河南郑州450003
杨 冰,张俊然*,杨 豪,王梅云,刘太元(.四川大学电气信息学院,四川 成都 60065;.河南省人民医院影像科,河南 郑州 450003)
糖尿病是一组以慢性血糖水平增高为特征的代谢疾病群,若长期不加以控制,可引起患者微血管和神经组织病变,造成认知功能障碍及脑结构病变等[1-2]。1型糖尿病(type 1 diabetes mellitus, T1DM)是由遗传、自身免疫和环境因素共同作用所致的慢性疾病, 约占我国糖尿病患者总数的5%,且多为儿童及青少年[3]。T1DM早期对儿童认知功能的损害无明显症状,但随着病程延长,认知损害症状可能明显且日趋严重。
T1DM患者认知功能障碍主要表现为整体智力[1]、学习技能、联想记忆和解决问题能力[4]下降,注意力分散,概念性推理能力、记忆力、视空间能力、读写能力、信息处理速度、精神运动速度下降等[3],认知功能减退可从儿童期延续至成年,且成长过程的脑发育并不能代偿认知功能受损[1]。对T1DM的结构影像学研究[5-6]显示,T1DM患者右侧大脑楔叶、楔前叶、额叶灰质体积,以及右侧后顶叶的白质体积较正常人有所变化。静息态fMRI研究[7]结果显示,T1DM患者扣带皮层与右侧额下回、额极区的功能连接降低,但与双侧楔前叶与左侧下顶叶的功能连接增强。脑功能活动一般以功能环路为基础,相对于单纯发现脑区结构变化或脑区功能连接差异而言,对脑区间交互的分析有助于探索患者认知功能障碍的神经机制。Granger因果分析(Granger causality analysis, GCA)是一种基于数据驱动的分析方法,可避免由于对模型的预假设出现错误而导致结论可靠性低的问题,在对认知障碍神经机制的发掘中具有明显优越性。海马是短期记忆存储脑区,与轻度认知损害密切相关[8],且对胰岛素及葡萄糖变化具有很高敏感性[9-10]。本研究以海马作为种子点进行Granger因果分析,从效应连接变化的角度对T1DM患者认知损害机制进行探讨。
1 资料与方法
1.1 一般资料 收集2015年6月—2016年4月河南省人民医院T1DM患儿18例(T1DM组),其中男8例,女10例,年龄6~14岁,平均(11.2±3.0)岁,糖化血红蛋白(9.55±2.08)mmol/L,空腹血糖(10.33±4.28)mmol/L,智商(韦氏儿童量表)评分(97.67±7.57)分;均未接受治疗,无抑郁症、孤独症、癫痫。另收集同期健康受试儿童13名(对照组),其中男7名,女6名,年龄6~14岁,平均(10.1±2.4)岁,智商评分(101.92±11.01)分。T1DM组与对照组智商差异无统计学意义(t=-1.278,P=0.211)。本研究经河南省人民医院伦理委员会审批通过,所有受试者父母或监护人均签署相关知情同意书。
1.2 仪器与方法 采用Siemens Magnetom Trio Tim 3.0T MR成像仪,对受试者于静息状态下行420 s平面回波成像(echo-planar imaging, EPI),TR 2 000 ms,TE 30 ms,层数33,层厚4 mm,间隔0,翻转角90°,FOV 240 mm×240 mm,矩阵64×64,体素大小3.75 mm×3.75 mm×4.00 mm,扫描时间点210个。
1.3 数据预处理 采用DPARSF分析软件对静息态fMRI数据进行预处理,包括剔除前10个时间点数据、时间层校正、头动校正(纳入标准:最大头动<2 mm,转动<2°)、空间标准化[Bounding box坐标范围:(-90,-126,-72;90,90,108)]、采用4 mm全宽半高高斯核对图像进行平滑、滤波频率0.01~0.08 Hz,并将头动参数、白质、脑脊液信号作为协变量剔除。
1.4 Granger因果分析 采用Granger因果分析方法描述种子点和全脑其他体素时间序列间的效应连接。从解剖自动标记(anatomical automatic labeling, AAL)模板中分别提取左、右侧海马作为种子点。以REST 1.8分析软件(http://www.restfmri.net)进行全脑范围Granger因果分析,包括种子点对全脑每个体素的因果效应(XtoY,表示X的活动对Y的活动施加了因果影响,即外向流)以及全脑每个体素对种子点间的因果效应(YtoX,表示Y的活动对X的活动施加了因果影响,即内向流)。
1.5 统计学分析 采用REST 1.8统计学分析软件。采用双样本t检验对T1DM组和对照组间结果进行统计分析,同时将各组受试者年龄、性别作为协变量剔除。最后采用高斯随机场理论校正(Gaussian random field-correction, GRF)进行校正(体素水平P<0.01,簇水平P<0.05)。
2 结果
以双侧海马为种子点,全脑Granger因果(Granger causal, GC)分析均未发现内向流存在组间差异。以左、右侧海马分别作为种子点的GC连接组间差异结果映射图见图1,连接示意图见图2。相对于对照组,以左侧海马为种子点,T1DM组左侧海马对双侧额中回、岛盖部额下回、三角部额下回、中央后回、辅助运动区、脑岛、前扣带和旁扣带脑回、内侧扣带和旁扣带脑回、缘上回,左侧的内侧额上回、中央前回,右侧背外侧额上回的外向流显著减弱,且两侧半球减弱的区域显示出较强的对称性,见表1;以右侧海马为种子点,T1DM组右侧海马对双侧辅助运动区、内侧扣带和旁扣带脑回,左侧额中回、岛盖部额下回、三角部额下回、内侧额上回、中央后回、缘上回、前扣带、旁扣带脑回的外向流显著减弱,见表2。

表1 以左侧海马为种子点的GC外向流组间比较有差异脑区
注:经GRF矫正,体素水平P<0.01,簇水平P<0.05
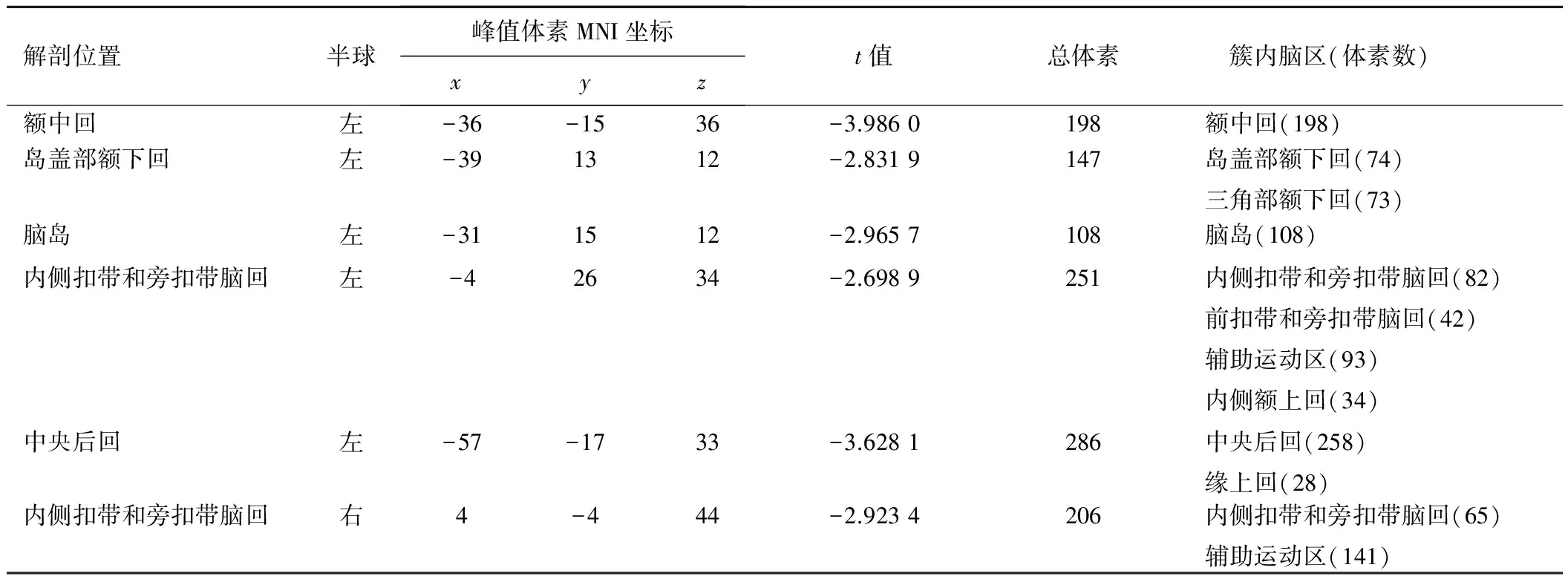
表2 以右侧海马为种子点的GC外向流组间比较有差异脑区
注:经GRF矫正,体素水平P<0.01,簇水平P<0.05

图1 Granger因果分析组间差异脑区 A.以左侧海马为种子点的外向流差异脑区; B.以右侧海马为种子点的外向流差异脑区 (蓝色表示与对照组比较,T1DM组GC连接强度减弱;颜色越浅表示组间差异越大)

图2 相对于对照组,T1DM患儿大脑效应连接GC差异连接示意图
3 讨论
海马是短期记忆存储脑区,与随时对记忆信息进行调用、处理的认知功能(如语言、视觉信息处理、联想等)关系密切[11],还对代谢失调具有高度敏感性[12],易受T1DM影响而萎缩[13]。以海马为种子点的效应连接减弱,可提示海马所参与的神经回路被抑制,即患者出现明显认知功能下降前已发生神经功能损害。本研究组间分析显示T1DM组与对照组之间的GC连接差异均集中在外向流,未发现以海马为种子点的内向流组间差异;与对照组相比,T1DM组双侧海马对左侧额中回、布洛卡区(左侧三角部额下回、岛盖部额下回)、辅助运动区、扣带皮层(内侧扣带、前扣带和旁扣带脑回)的GC连接强度同时出现明显降低,提示这些脑区对海马信息的提取能力减弱(图2)。本研究2组智商评分差异无统计学意义,虽然T1DM患儿早期无明显认知损害症状,但海马对外效应连接的减弱提示患儿早期大脑连接已发生改变,对T1DM相关的轻度认知损害发展具有早期警示作用。
前额叶在大脑执行控制、工作记忆等认知活动中发挥重要作用。额中回是前额叶的重要组成部分,参与执行控制、记忆相关等认知活动[14]。海马-前额叶回路参与工作记忆[15-16]。T1DM组静息态下双侧海马对左侧额中回的GC连接强度降低,表明海马-前额叶回路受到抑制,提示T1DM患儿可能出现学习记忆表现偏低的现象或趋势。左侧三角部和岛盖部额下回是布洛卡区的重要组成部分,在语言产生以及前额叶联想整合功能中具有重要作用。T1DM组双侧海马对布洛卡区GC连接减弱,推测患儿大脑正常的语言认知网络强度被削弱,且语言认知表现可能受到影响。此外,中央前、后回是人体运动区,但在许多语言认知任务中,两个脑区均出现不同程度的激活[17-18],推测中央前、后回参与大脑的语言认知处理。本研究T1DM组海马对中央前、后回GC连接减弱,也可能与患者语言认知功能的损害有关。前扣带皮层在执行功能、情绪和学习等认知信息加工中有重要作用[19],Sorg等[20]对轻度认知损害患者静息态fMRI的研究显示海马同扣带、额叶的功能连接降低。本研究T1DM组双侧海马对前扣带和旁扣带脑回以及额叶连接强度减弱,提示患儿可能出现更为明显的认知损害症状。
本研究未发现T1DM组存在显著内向流变化,而双侧海马内、外向流分布失衡。由于T1DM引起的代谢失调影响海马所参与的神经回路,并影响海马体积[14,21],推测T1DM造成海马释放神经信号能力减弱,进而导致海马外向流减弱。本研究中以左侧海马为种子点的GC连接减弱区域呈高度半球对称性,而以右侧海马为种子点的弱化连接区域主要集中在左侧半球且范围小于左侧海马的连接区域。相关研究[22-23]同样发现左侧海马更多地参与认知功能处理,而更高认知参与度需同更多的脑区进行交互。左侧海马与更大范围辐射区域的连接减弱原因可能在于其对认知活动的参与度更高,左侧海马受损伤后导致与其存在交互关系的更多脑区连接减弱。
