白藜芦醇通过沉默调节蛋白1-解偶联蛋白2信号通路降低小鼠睾丸间质细胞TM3的氧化损伤
2018-07-16张晓春陈指龙伍小松
张晓春 陈指龙 方 娟 黎 陈 伍小松 杨 青*
(1.湖南农业大学动物医学院,长沙 410128;2.湖南农业大学动物科学技术学院,长沙 410128)
当机体遭受体内外各种有害刺激时,由于机体内氧化系统与抗氧化系统平衡失调,机体内活性氧(ROS)会大量聚集,使组织细胞暴露于高浓度氧分子或氧的化学衍生物,从而引起细胞的氧化损伤。研究发现氧化损伤可引起动物严重的生精障碍,导致睾丸组织发生明显的病理变化,睾丸指数和精子数下降,精子畸形率升高,造成雄性动物不育[1-2]。白藜芦醇(RES)是一种广泛存在于葡萄、花生、虎杖、决明、藜芦等植物性食物中的天然多酚类物质,具有很广泛的生物学活性,在治疗氧化损伤、炎症、过敏、肿瘤、心血管疾病等方面都得以应用[3-4]。目前,RES在畜禽生产中也被广泛应用,它能提高畜禽的生产性能、改善畜禽酮体品质和肉品质、提高畜禽免疫力和抗氧化能力[5]。高糖高胆固醇饮食可导致小鼠睾丸间质细胞的睾酮合成能力受损,添加RES能够通过减轻其氧化应激,并通过激活沉默调节蛋白1(SIRT1)及影响下丘脑-垂体-性腺轴的调控发挥保护作用[6]。成海建等[7]研究发现RES可通过激活SIRT1/腺苷酸活化蛋白激酶(AMPK)信号通路促进牛皮下脂肪细胞的凋亡。周曦等[8]研究发现RES可能通过调控SIRTl/解偶联蛋白2(UCP-2)信号通路抑制血管内皮细胞氧化应激损伤。SIRT1具有去乙酰化酶活性,通过对组蛋白、多种转录因子、转录共调控因子的翻译后修饰(去乙酰化),可调节与氧化应激、凋亡、炎症反应相关基因和蛋白质的转录[9]。UCP2作为解偶联蛋白,能影响线粒体的跨膜电位,当线粒体内膜电势升高时,UCP2能够降低细胞膜内外氢离子(H+)浓度,促进氧消耗,从而抑制ROS的产生[10]。目前,虽已明确RES的抗氧化作用效果,但对于其具体的作用机制尚未完全明确。因此,本研究以小鼠睾丸间质细胞TM3为研究对象,在过氧化氢(H2O2)诱导的氧化应激状态下研究RES对氧化损伤细胞的治疗作用,并阐明其可能的作用机制,以期为防治由氧化损伤引起的雄性生殖系统疾病提供理论依据。
1 材料与方法
1.1 试验材料

1.2 试验方法
1.2.1细胞培养
小鼠睾丸间质细胞TM3细胞株用DMEM/F12培养基(添加10%的胎牛血清和1%青-链霉素),置于37 ℃、5%CO2培养箱中培养。每天更换培养基,待细胞长至对数生长期即汇合度达到80%~90%时,使用胰酶消化制备细胞悬液。
1.2.2iCELLigence细胞功能分析仪监测细胞增殖情况
将细胞消化离心后,用含1%胎牛血清的DMEM/F12培养基重悬细胞并计数,制备成密度为2.5×104个/mL的细胞悬液待用。在E-Plate L8板中加入含1%胎牛血清的DMEM/F12培养基(150 μL/孔),放入iCELLigence实时无标记细胞功能分析仪(Roche,德国),在仪器配备的iPad软件中,选择增殖试验,用含1%胎牛血清的DMEM/F12培养基自动调零。随后取出E-Plate L8板,每孔加入细胞悬液300 μL,每组设置3个重复孔,待细胞静置30 min后将E-Plate L8板重新放置于iCELLigence实时无标记细胞功能分析仪内,点击开始进行实时监测。具体操作过程中:1)在确定建立氧化损伤细胞模型的适宜H2O2浓度的试验中,待细胞生长曲线进入对数期后(即在培养板中培养24 h后),将E-Plate L8取出,轻轻吸出100 μL培养基,再加入100 μL含不同浓度H2O2的培养基,使终浓度分别0(正常对照组)、150、200、250和300 μmol/L,轻轻混匀后再将E-Plate L8板置于分析仪中,继续监测8 h,此过程共监测32 h。2)在确定RES安全浓度的试验中,待细胞生长曲线进入对数期后(即在培养板中培养24 h后),将E-Plate L8取出,分别采用0(正常对照组)、2.5、5.0和10.0 μmol/L的RES处理,继续监测24 h,此过程共监测48 h。3)在RES干预处理氧化损伤细胞的试验中,待细胞生长曲线进入对数期后(即在培养板中培养24 h后),先将细胞用150 μmol/L的H2O2处理8 h,再分别用0(H2O2组)、2.5、5.0和10.0 μmol/L的RES处理,同时设未经H2O2和RES处理的正常对照组,继续监测24 h,此过程共监测56 h。设置iCELLigence系统每隔15 min实时监测细胞增殖情况,制作增殖曲线,不同曲线可反映不同处理条件下细胞实时增殖情况,细胞增殖情况用增殖指数(proliferation index,PI)表示。在监测结束时测定各个培养板中细胞的存活率。
1.2.32′,7′-二氯荧光素二乙酸酯(DCFH-DA)探针法检测细胞中ROS含量
待RES(5.0 μmol/L)处理氧化损伤细胞结束后,按照ROS检测试剂盒说明书测定细胞中ROS含量,具体操作如下:去掉培养上清液,加入含10 μmol/L DCFH-DA探针的新鲜培养基,37 ℃孵育细胞40 min,用胰酶消化细胞,1 000 r/min离心10 min,弃去上清液,用磷酸盐缓冲液(PBS)清洗1次,离心留细胞沉淀,用PBS重悬细胞,调整细胞密度为6×105个/mL,使用荧光酶标仪在激发波长为485 nm、发射波长为525 nm处检测荧光强度。DCFH-DA本身没有荧光,当其进入细胞后被酯酶水解为DCFH,而DCFH可被细胞内的ROS氧化为强绿色荧光物质DCF,因此,其荧光强度与细胞内ROS的含量成正比,可用荧光强度表示ROS含量。
1.2.4实时荧光定量PCR(quantitative real-time PCR,RT-qPCR)检测细胞中SIRT1和UCP2的mRNA相对表达量


表1 实时荧光定量PCR引物序列
F和R分别代表上游和下游引物。
F and R represent forward and reverse primers, respectively.
1.2.5蛋白质印迹(Western-blot)法检测细胞中SIRT1和UCP2的蛋白质相对表达量
待RES处理氧化损伤细胞结束后,弃掉培养基,用预冷的PBS洗涤细胞2次,加入200 μL RIPA细胞裂解液(含1% PMSF),吹打均匀,冰上放置30 min,期间剧烈振荡3次,每次30 s,将细胞裂解液置于4 ℃,12 000 r/min离心10 min后吸取上清液,采用BCA蛋白定量试剂盒进行蛋白质浓度的测定。取适量蛋白质样品用5 Loading Buffer混匀,100 ℃水浴中煮5 min使蛋白质变性。使用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白质,每孔上样量为30 μg,然后将蛋白质转印到聚偏二氟乙烯(PVDF)膜上,使用0.2%明胶室温摇床封闭1 h,分别加入不同的一抗4 ℃孵育过夜;用三羟甲基氨基甲烷吐温(TBST)洗膜3次,每次10 min;加入相对应的HRP标记二抗室温摇床孵育1 h,TBST洗膜3次,每次10 min;最后用ECL化学发光液进行显色,于ChemiDocTMXRS+成像系统中检测蛋白质条带并用Quantity One软件分析条带的密度值和表达量,以β-actin为内参。
1.3 数据统计分析
试验数据以平均值±标准差(mean±SD)表示,利用SPSS 17.0统计分析软件中的单因素方差分析(one-way ANOVA)进行方差分析,采用LSD法进行两两比较。P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 H2O2对TM3细胞增殖的影响
不同浓度H2O2处理TM3细胞8 h后,根据iCELLigence细胞功能分析仪实时监测结果(图1)可知,与正常对照组相比,各浓度H2O2组的细胞存活率均极显著下降(P<0.01),且呈浓度依赖。其中用150 μmol/L的H2O2处理时细胞存活率下降至75%左右,达到预计的损伤效果。因此,在后续试验中选用150 μmoL/L的H2O2处理细胞8 h构建本试验中所需的氧化损伤细胞模型。
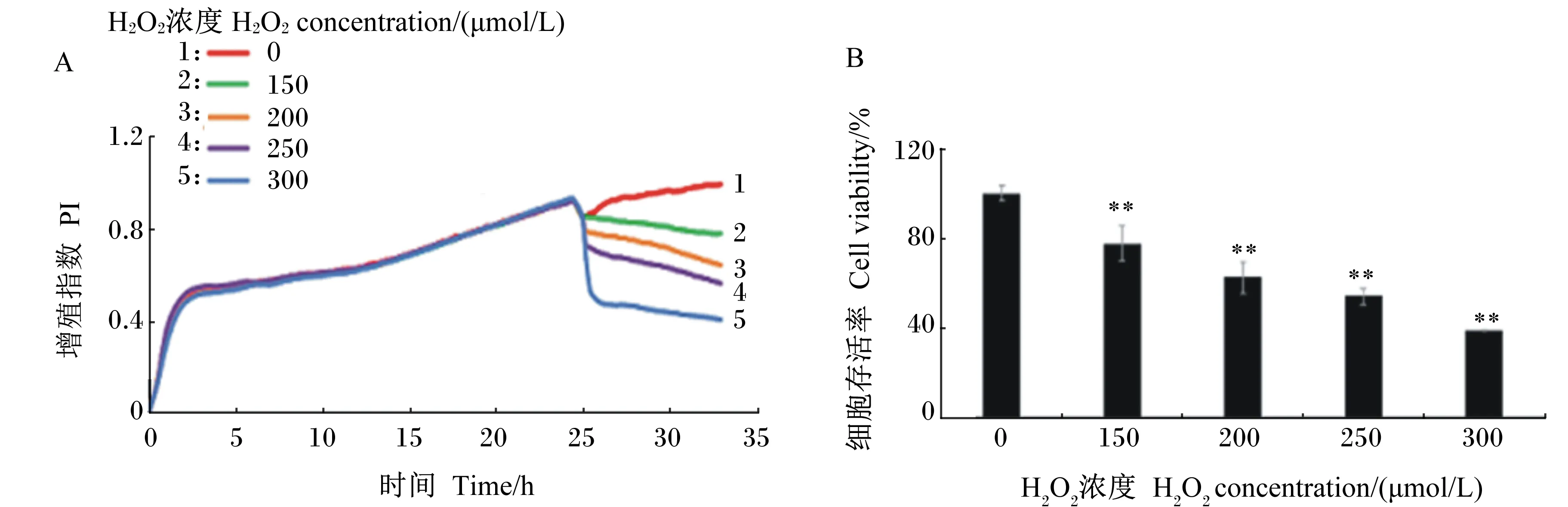
A:iCELLigence细胞功能分析仪实时监测H2O2对TM3细胞增殖的影响。B:不同浓度H2O2处理TM3细胞8 h后对细胞增殖的影响。
A: real-time monitor the effect of H2O2on proliferation of TM3 cells by iCELLigence cell function analyzer. B: effects of different concentrations of H2O2on proliferation of TM3 cells after treated for 8 h.
数据柱标“**”表示与正常对照组相比差异极显著(P<0.01)。下图同。
Value columns of each with “**” mean extremely significant difference compared with the normal control group (P<0.01). The same as below.
图1不同浓度H2O2对TM3细胞增殖的影响
Fig.1Effects of different concentrations of H2O2on proliferation of TM3 cells
2.2 RES对TM3细胞增殖的影响
为研究RES对H2O2致TM3细胞氧化损伤的作用效果,首先检测了RES对TM3细胞增殖的影响,由图2可知,用浓度分别为2.5、5.0和10.0 μmol/L的RES处理正常细胞24 h后,各浓度RES组与正常对照组的细胞存活率无显著差异(P>0.05)。由图3可知,当用RES处理氧化损伤细胞24 h后,与H2O2组(仅经H2O2单独处理,未经RES处理的氧化损伤细胞)相比,各浓度RES组的细胞存活率均显著提高(P<0.05),但仍无法恢复到正常对照组水平,且各浓度RES组间无显著差异(P>0.05),因此,后续试验中选取浓度为5 μmol/L的RES对氧化损伤TM3细胞进行处理。
2.3 RES对氧化损伤TM3细胞中ROS含量的影响
由图4可知,正常细胞经H2O2的处理后,细胞内相对荧光强度极显著增强(P<0.01),即表明细胞中ROS含量显著升高;而氧化损伤细胞经RES处理后,细胞内相对荧光强度极显著下降(P<0.01),但仍无法恢复至正常对照组的水平。这说明RES能够在一定程度上抑制氧化损伤TM3细胞中ROS的产生。
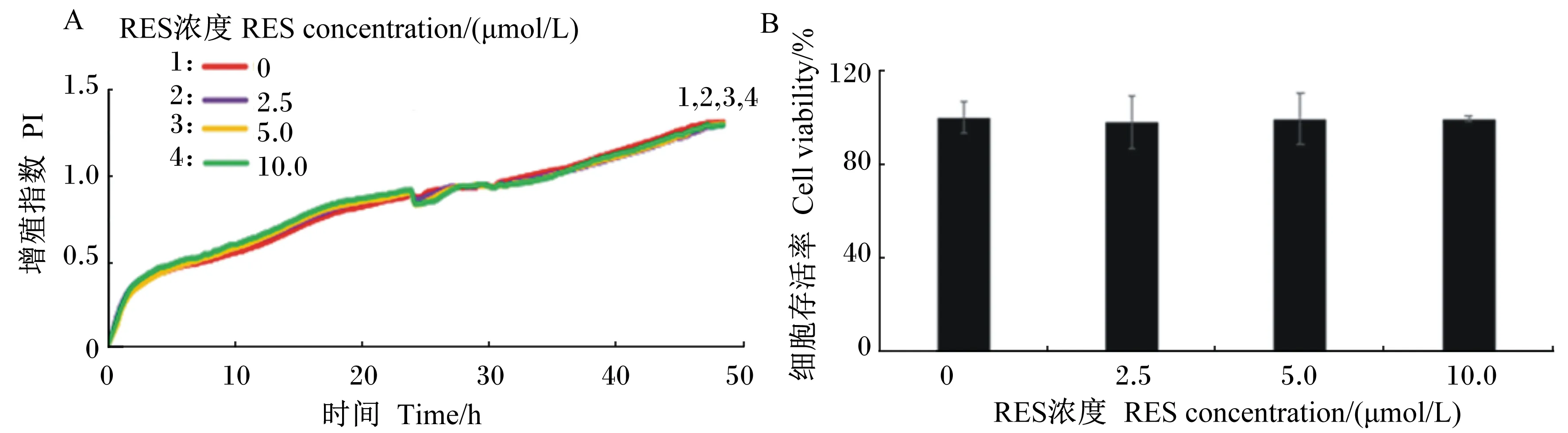
A:iCELLigence细胞功能分析仪实时监测RES对TM3细胞增殖的影响。B:不同浓度RES处理TM3细胞24 h后对细胞增殖的影响。
A: real-time monitor the effects of RES on proliferation of TM3 cells by iCELLigence cell function analyzer. B: effects of different concentrations of RES on proliferation of TM3 cells after treated for 24 h.
图2不同浓度RES对TM3细胞增殖的影响
Fig.2Effects of different concentrations of RES on proliferation of TM3 cells
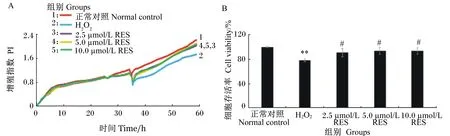
A:iCELLigence细胞功能分析仪实时监测RES对H2O2诱导氧化损伤TM3细胞增殖的影响。B:RES处理24 h对H2O2诱导氧化损伤TM3细胞增殖的影响。
A: real-time monitor the effects of RES on proliferation of H2O2-induced oxidative-damaged TM3 cells by iCELLigence cell function analyzer. B: effects of RES on proliferation of H2O2-induced oxidative-damaged TM3 cells after treated for 24 h.
数据柱标注“#”表示与H2O2组相比差异显著(P<0.05)。
Value columns with “#” mean significant difference compared with H2O2group (P<0.05).
图3RES对H2O2诱导氧化损伤TM3细胞增殖的影响
Fig.3Effects of RES on proliferation of oxidative-damaged TM3 cells induced by H2O2
2.4 RES对氧化损伤TM3细胞中SIRT1和UCP2 mRNA和蛋白质相对表达量的影响
由图5-A可知,正常细胞经H2O2的处理后,细胞中SIRT1 mRNA相对表达量极显著降低(P<0.01),UCP2 mRNA相对表达量极显著增加(P<0.01)。而氧化损伤细胞经RES处理后,细胞中SIRT1 mRNA相对表达量极显著增加(P<0.01),UCP2 mRNA相对表达量极显著降低(P<0.01)。由图5-B可知,细胞中SIRT1和UCP2蛋白质相对表达量的变化趋势与其mRNA相对表达量变化趋势一致,即H2O2处理导致SIRT1蛋白质相对表达量极显著降低(P<0.01),而使UCP2蛋白质相对表达量表达极显著增加(P<0.01);RES处理可极显著提高氧化损伤细胞中SIRT1蛋白质相对表达量(P<0.01),显著降低UCP2蛋白质相对表达量(P<0.05)。
3 讨 论
3.1 H2O2诱导TM3细胞氧化损伤模型的建立
目前,在细胞氧化损伤模型的建立中,多以H2O2作为诱导剂,不同类型的细胞对诱导剂的敏感性不一样,因此诱导剂的浓度和处理时间非常关键[11-12]。当诱导剂浓度过高或处理时间过长时会导致细胞损伤太严重,不利于抗氧化机制的研究;而当损伤程度太弱时,细胞可能通过自身修复影响相关的研究。对于细胞氧化损伤模型,一般通过噻唑蓝(MTT)法检测,根据其吸光度值来判断细胞增殖情况从而确定氧化损伤程度,MTT法虽然有其优势,如重复性较好、特异性强等,但每次只能确定1个时间点细胞的增殖情况。本试验中采用iCELLigence细胞功能分析仪实时监测,可更直观地判断细胞的增殖情况,而且监测过程中不需要特殊试剂,可减少因多次操作所导致的误差。本试验中,通过iCELLigence细胞功能分析仪实时监测,发现150 μmol/L的H2O2处理细胞8 h,细胞存活率下降至75%左右,符合后续抗氧化损伤试验的要求,因此确定采用150 μmol/L的H2O2建立细胞氧化损伤模型。
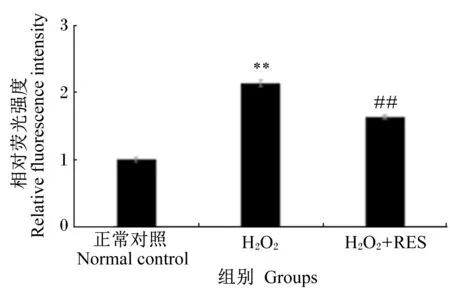
数据柱标注“##”表示与H2O2组相比差异极显著(P<0.01)。下图同。
Value columns with “##” mean extremely significant difference compared with H2O2group (P<0.01). The same as below.
图4RES对H2O2诱导氧化损伤TM3细胞中ROS含量的影响
Fig.4Effects of RES on ROS content in oxidative-damaged TM3 cells induced by H2O2
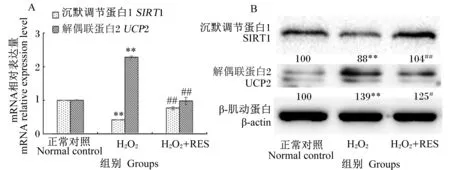
A:qPCR检测RES对H2O2诱导氧化损伤TM3细胞中SIRT1和UCP2 mRNA相对表达量的影响。B:Western-blot法检测RES对H2O2诱导氧化损伤TM3细胞中SIRT1和UCP2蛋白质相对表达量的影响。
A:detection of the mRNA relative expression levels ofSIRT1 andUCP2 in H2O2-induced oxidative-damaged TM3 cells with treatment of RES by qPCR. B: detection of the protein relative expression levels of SIRT1 and UCP2 in H2O2-induced oxidative-damaged TM3 cells with treatment of RES by Western-blot method.
同行数据肩标“**”表示与正常对照组相比差异极显著(P<0.01),肩标“##”表示与H2O2组相比差异极显著(P<0.01),肩标“##”表示与H2O2组相比差异显著(P<0.05)。
Values in the same line with “**” superscript means extremely significant difference compared with the normal control group (P<0.01), with “##” superscript means extremely significant difference compared with the H2O2group (P<0.01), and with “#” superscript means significant difference compared with the H2O2group (P<0.05).
图5RES对H2O2氧化损伤TM3细胞中SIRT1和UCP2mRNA及蛋白质相对表达量的影响
Fig.5Effects of RES on mRNA and protein relative expression levels ofSIRT1 andUCP2 in oxidative-damaged TM3 cells induced by H2O2
3.2 RES对氧化损伤细胞的保护作用
研究表明,动物体中90%的ROS源于线粒体电子呼吸传递链,ROS的产生与线粒体能量代谢紧密相关,当ROS含量增加时,会对线粒体的结构、功能造成损伤,而线粒体受到损伤后又会促进ROS的生成,如此恶性循环,加重氧化损伤程度[13-14]。解偶联蛋白(UCPs)是位于线粒体内膜上的一类转运蛋白,它们可以介导线粒体内膜的“质子漏”使能量以热的形式散失[15]。UCP2作为UCPs家族成员之一,是UCPs在生殖系统中的主要存在形式[16-17]。大量试验表明,UCP2可以调控ROS的生成,并参与多种组织的抗氧化损伤作用。Brand[18]提出了UCP2对ROS的负调控假设模型,当ROS含量增加时,过氧化物在化学转化过程中产生的某种物质激活UCP2的质子漏活性,导致线粒体膜电位的下降,UCP2就以一种负反馈调节的方式来限制ROS的生成,表明在氧化应激过程中,UCP2可以通过降低ROS的生成量保护机体免受过氧化损伤。同样的结论在Zhang等[19]、王晓娜等[20]的试验中也得到证实。Zhang等[19]的试验表明,高温诱导的凋亡能引起小鼠睾丸内ROS含量增加,UCP2蛋白质表达量也随之增加;王晓娜等[20]试验发现,精子内UCP2蛋白质的表达量与过氧化氢的作用浓度呈正相关,UCP2为了对抗增加的ROS,表达量也随之增加。SIRT1作为一种核蛋白,能够以转录的形式抑制UCP2的转录活性,通过与UCP2启动子结合,抑制UCP2基因的表达,减少其编码的线粒体内膜蛋白的生成,从而抑制线粒体中解偶联反应的发生[21]。相关研究表明,经不同药物诱导的大鼠或小鼠氧化应激模型中,SIRT1都表现出低表达状态,而SIRT1一经激活,可导致UCP2的表达下降[8,22-23]。结合以上信息推测,在本试验中,RES通过对SIRT1/UCP2信号通路的调节发挥对氧化损伤小鼠睾丸间质细胞TM3的保护作用。
本试验结果显示,与正常对照组相比,H2O2组细胞中ROS含量极显著增加,SIRT1 mRNA及蛋白质的相对表达量均极显著降低,而UCP2 mRNA及蛋白质的相对表达量极显著升高,提示细胞被H2O2损伤后细胞中SIRT1含量的降低可能诱导UCP2含量的增加,以抵抗细胞中增加的ROS。UCP2生成量增加,解偶联线粒体内氧化磷酸化过程,减少ATP的生成,ROS的生成量应该下降,但氧化应激在细胞中UCP2表达增强的情况下仍持续存在,推测可能是由于UCP2增加的量不足以抵抗ROS的过量产生。相比氧化损伤细胞,采用RES处理后由H2O2所致的SIRT1 mRNA及蛋白质表达的下调和UCP2 mRNA及蛋白质表达的上调均在一定程度上受到抑制,且细胞中ROS含量也极显著下降,提示RES作为SIRT1的激活剂,能够促进其表达。SIRT1被激活后,可抑制UCP2的表达,理论上应该会产生更多的ROS,但实际采用RES处理后氧化损伤细胞中ROS的含量相对未经RES处理的氧化损伤细胞而言是减少的,分析原因可能是UCP2对ROS存在负反馈调节,即UCP2表达被抑制后,细胞中ROS的含量增加,UCP2通过负反馈调节的方式限制ROS的产生。
此外,在本研究中发现,在正常TM3细胞中UCP2 mRNA的表达较丰富,而其蛋白质较难检测到,而经H2O2损伤后TM3细胞中UCP2蛋白质的相对表达量极显著增加。这种情况的出现可能与抗体的特异性有关;也可能是在生理状态下,某些器官中的UCP2 mRNA并不最终表达为蛋白质,而在病理状态下就可以启动UCP2 mRNA翻译为蛋白质。在Fisler等[24]的研究中也在胰腺、脾脏、心脏、下丘脑、肺、睾丸、巨噬细胞等检测到大量的UCP2 mRNA,而用Western blot法仅在下丘脑、巨噬细胞、白色脂肪组织、脾脏、胰岛的实质细胞中检测到了UCP2蛋白质。
4 结 论
SIRT1/UCP2信号通路介导了H2O2致TM3细胞的氧化损伤,RES通过活化SIRT1抑制UCP2表达,UCP2通过负反馈调节方式削弱氧化损伤细胞内ROS的生成,从而在一定程度上抑制TM3细胞的氧化损伤。
