姬松茸多糖诱导巨噬细胞释放NO的机制
2018-07-14房雷雷赵肖通张彦青解军波
房雷雷 赵肖通 张彦青 解军波
(1. 天津商业大学生物技术与食品科学学院,天津 300134;2. 天津市食品生物技术重点实验室,天津 300134)
一氧化氮(nitric oxide, NO)是一种新型生物信息传递分子,可由单核巨噬细胞RAW264.7等产生,在免疫、循环、呼吸、神经等系统中发挥重要作用,已成为当代生物学研究的一大热点[1]。试验证明,真菌多糖具有较强的免疫活性,且大多数真菌多糖能够增强机体免疫力[2-4],其中重要途径之一是促进巨噬细胞产生细胞因子和免疫活性物质(如NO等)[5-7]。
姬松茸(Agaricusbrasiliensis)别名巴西蘑菇、小松菇、柏氏蘑菇,属担子菌亚门,层菌纲,伞菌目,蘑菇科,蘑菇属,为现今世界上可人工栽培的珍稀药食兼用菌之一[7]。研究[8]发现姬松茸对免疫系统有重要的调节作用,对非特异性免疫、特异性免疫和细胞免疫体系均有增强作用。在姬松茸的免疫调节作用中,姬松茸的多糖成分为主要活性成分,且大量文献[9-10]证明姬松茸多糖能在多条途径和多个层面显示免疫活性。
姬松茸多糖免疫调节作用的相关研究大多集中于具体表征而非探究其机制,且多以小鼠单核巨噬细胞RAW264.7建立细胞模型,一些研究结果已经表明姬松茸多糖能够促进巨噬细胞增值、释放NO和分泌肿瘤坏死因子(Tumor nerosis factor-α, TNF-α)、γ-干扰素(Interferon-γ, IFN-γ)、白细胞介素1(Interleukin-1-β, IL-1β)与白细胞介素8(Interleukin-8, IL-8)等[11-13]。本试验拟建立小鼠单核巨噬细胞RAW264.7细胞模型,分析姬松茸多糖对巨噬细胞NO释放与诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)表达的影响,同时研究其对NF-κB抑制蛋白(IκBα)磷酸化水平的影响,从姬松茸多糖影响NF-κB信号传导途径的角度出发,深入探讨姬松茸多糖诱导巨噬细胞释放NO的机制,以期为开发姬松茸多糖提供新的理论依据。
1 材料与方法
1.1 材料与试剂
姬松茸多糖样品:多糖含量为99%,实验室自制;
脂多糖( Lipopolysaccharides, LPS):美国Sigma公司;
全蛋白提取试剂盒:上海生工生物工程股份有限公司;
DMEM(Dulbecco's modified eagle medium)培养基、胎牛血清(FBS)、青链霉素:美国Gibco公司;
山羊p-IκBα抗体:美国Santa Cruz公司;
BCA蛋白浓度测定试剂盒:北京索莱宝科技有限公司;
兔iNOS、(HRP)-共轭抗山羊二抗抗体:美国Thermo公司;
兔β-actin抗体、抗兔二抗抗体:北京博奥森生物技术有限公司。
1.2 仪器与设备
电子分析天平:BP211D型,德国Sartoriμs公司;
超纯水系统:Milli-Q型,美国Millipore公司;
多功能酶标仪:SpectraMax®M3型,美国Molecular Devices公司。
1.3 溶液配制
DMEM完全培养液:分别向DMEM培养基中加入终浓度为10%和1%的胎牛血清和青链霉素双抗,保存于4 ℃冰箱中;
亚硝酸钠溶液:称取适量亚硝酸钠,并用DMEM完全培养液溶解,溶解完全后配制成终浓度为1 mmol/L亚硝酸钠储备液,并稀释成5,10,25,50,75,100 μmol/L,于4 ℃冷藏备用;
Griess溶液:称取适量Griess试剂并溶于250 mL蒸馏水中,配制成浓度为40 mg/mL的溶液,0.22 μm微孔滤器过滤除菌,分装,放置于4 ℃冰箱避光保存;
LPS溶液配制:称取LPS脂多糖标准品粉末,加入DMEM完全培养液溶解,溶解后混匀,得到终浓度为1 μg/mL 的LPS溶液,过滤除菌,冷藏备用;
姬松茸多糖溶液配制:精密称取姬松茸多糖样品10 mg,将样品置于10 mL的容量瓶中,用DMEM完全培养液稀释并定容,制得1 mg/mL的姬松茸多糖储备液,配制成不同浓度溶液(6.25,12.50,25.00,50.00 μg/mL),过滤后冷藏。
1.4 方法
1.4.1 小鼠单核巨噬细胞RAW264.7的培养 培养基为DMEM完全培养液,细胞放置于10 cm的细胞培养皿中,于37 ℃恒温培养箱,通入5% CO2中培养(相对湿度90%)。细胞每隔1~2 d传代一次,试验接种细胞为对数生长期细胞。
1.4.2 RAW264.7细胞释放NO的测定 运用Griess试剂测定NO的释放量,研究姬松茸多糖对巨噬细胞NO释放作用的影响。
(1) NO标准曲线的测定:取75 μL不同浓度(0,5,10,25,50,75,100 μmol/L)的亚硝酸钠置于96孔板,每孔再加入75 μL Griess溶液,混匀后静置3 min后,采用酶标仪检测540 nm处吸光度。
(2) 将培养的RAW264.7细胞悬液(5×105个/mL)以每孔100 μL接种于96孔板,并培养24 h。然后,用姬松茸多糖样品处理2组细胞:一组是将细胞在1 μg/mL LPS和姬松茸多糖溶液(浓度分别为0.00,6.25,12.50,25.00,50.00 μg/mL)下培养24 h;一组是将25 μg/mL的姬松茸多糖溶液加入细胞后分别培养2,4,6,8,10,12,16,24,30,36 h。而后,吸取75 μL上清液于新96孔板中,并添加 Griess溶液、混匀、静置,而后测定吸光度,并根据标准曲线计算得到NO浓度。
1.4.3 RAW264.7细胞iNOS表达的测定 收集已加入0.00,6.25,12.50,25.00,50.00 μg/mL姬松茸多糖溶液培养24 h的巨噬细胞,采用全蛋白提取试剂盒提取RAW264.7细胞全蛋白,并选用BCA试剂盒检测其蛋白含量。蛋白质免疫印迹法(Western Blot,WB)[14]测定iNOS的表达量(β-actin为参比蛋白),而后采用凝胶成像系统处理胶片,并运用Quantity One软件分析试验结果。WB试验选用抗体为:兔iNOS、兔β-actin抗体、抗兔二抗抗体。
1.4.4 RAW264.7细胞p-IκBα蛋白表达的测定 采用WB法测定,姬松茸多糖浓度为25 μg/mL,姬松茸多糖作用巨噬细胞时间为0,15,30,45,60 min,所选用抗体为山羊p-IκBα抗体与(HRP)-共轭抗山羊二抗抗体,其他试验步骤同1.4.3。
1.4.5 数据处理 上述所有试验均重复6次,数据用“平均值±SD”表示,数据统计分析采用SPSS软件,并选用单因素方差分析(ANOVA)中LSD最小显著差法检验组间差异性。所有图像采用Microsoft Office Excel 2007软件进行分析处理。
2 结果与分析
2.1 姬松茸多糖诱导RAW264.7细胞释放NO
采用Griess法对巨噬细胞NO释放量进行检测,并以各浓度亚硝酸钠为底物,利用Griess试剂测定吸光度值,得NO标准曲线为y=0.018x+0.010(R2=0.999)。
通过亚硝酸钠标准曲线计算得到各组NO浓度,结果见图1。由图1(a)可知,25 μg/mL姬松茸多糖作用RAW264.7细胞36 h内,NO浓度随作用时间的延长而逐渐增加,具有较强的时效性。图1(b)表明,与空白对照组相比,6.25,12.50,25.00,50.00 μg/mL姬松茸多糖作用24 h后, RAW264.7细胞NO释放量极显著增大(P<0.01),且作用效果随剂量的增大而增强。以姬松茸多糖浓度为x值,以NO浓度为y值进行线性分析,得到回归方程为y=0.130 2x+2.35,判定系数R2为0.736 6,表明姬松茸多糖对NO释放的影响具有一定程度的线性关系。综上表明,姬松茸多糖能够诱导RAW264.7细胞释放NO,且具有一定的时效性和剂量依赖性。
研究[15]表明,NO的释放是巨噬细胞的非特异性免疫——一种重要的机体防御过程的重要环节,当受到如肿瘤细胞、病原体及微生物等刺激时,巨噬细胞被活化并产生一系列的效应分子,NO便是其中之一。一方面,NO被作为巨噬细胞发挥杀伤靶细胞的重要信使分子,通过细胞间信息交换载体功能发挥免疫调节作用;另一方面,NO对巨噬细胞吞噬的各类肿瘤细胞与微生物等具有细胞毒性[16]。LPS是革兰氏阴性菌细胞壁外膜的主要成分,能够诱导巨噬细胞释放NO等多种因子参与免疫反应[17]。本试验结果显示姬松茸多糖作用后能够显著促进RAW264.7细胞释放NO,与相关文献[11-12]报道姬松茸多糖对巨噬细胞NO生成的试验结果相一致,说明姬松茸多糖对巨噬细胞的免疫活性有正向的促进作用。可见,姬松茸多糖能够通过增加巨噬细胞NO的释放而调节机体的免疫反应。
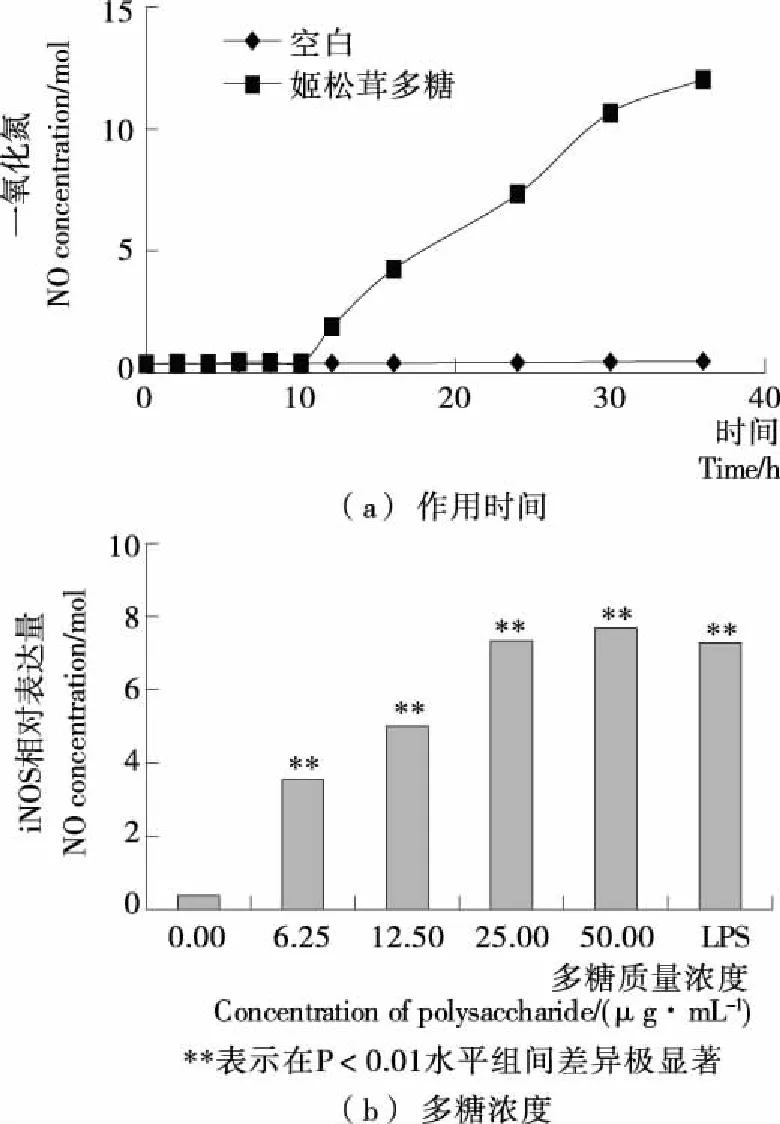
图1 姬松茸多糖对巨噬细胞释放NO作用的影响
Figure 1 The effects ofAgaricusbrasiliensispolysaccharide on NO production in RAW264.7 cells
2.2 姬松茸多糖对RAW264.7细胞iNOS表达水平的影响
iNOS催化L-精氨酸生成NO,是哺乳动物体内NO合成的唯一途径[18],故本研究选用Western Blot法进一步检测姬松茸多糖对巨噬细胞iNOS表达量的影响,以β-actin为内参蛋白。由图2可知,与空白对照组相比,不同浓度姬松茸多糖(0.00,6.25,12.50,25.00,50.00 μg/mL)作用24 h后,能够明显增强RAW264.7细胞中iNOS的表达水平(P<0.01)。线性分析得回归方程为y=0.106 4x+3.052 3,判定系数R2=0.649 1,证明不同浓度姬松茸多糖作用后,对RAW264.7细胞iNOS表达水平的影响有一定的剂量依赖性。说明姬松茸多糖能够显著诱导巨噬细胞合成iNOS,且呈现剂量依赖性。
此外,iNOS表达量与NO释放量的量效关系呈现一致的趋势,进一步验证了姬松茸多糖能够诱导RAW264.7细胞表达iNOS蛋白进而大量释放NO。

Figure 2 The effects ofAgaricusbrasiliensispolysaccharide on iNOS protein expression in RAW264.7 cells
2.3 姬松茸多糖对RAW264.7细胞IκBα蛋白磷酸化水平的影响
NF-κB具有多项调节作用,是iNOS基因转录与表达的调控因子,静息状态下保持P50-P65-IκB三聚物的形式。当收到活化信号后,IκB的丝氨酸残基被磷酸化,并从NF-κB解离进入胞核,起到活化转录因子的效用[18]。而后,P50-P65二聚体与κB基序结合,表现出一系列重要生物学、病理学活性[19]。
如图3所示,25 μg/mL的姬松茸多糖处理RAW264.7细胞不同时间(0,15,30,45,60 min)后,p-IκBα蛋白的含量随处理时间的延长而增加,45 min时达到最高,表明姬松茸多糖可以引起IκBα蛋白磷酸化水平的升高,表示姬松茸多糖能够诱导IκBα蛋白的磷酸化,从而证明姬松茸多糖能够激活NF-κB信号转导途径。
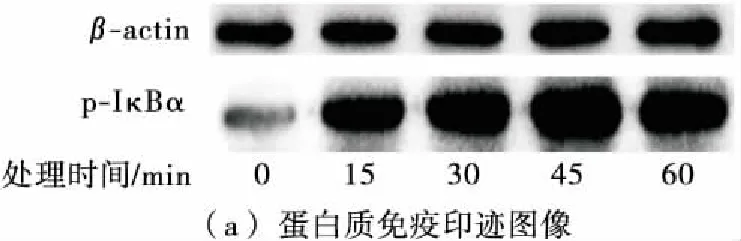
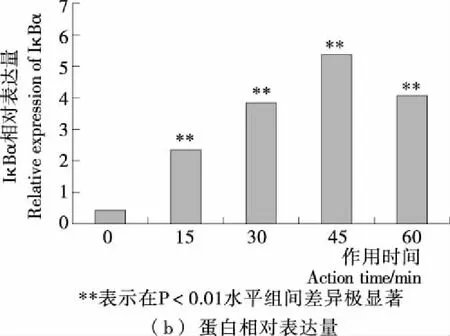
图3 姬松茸多糖对RAW264.7细胞IκBα蛋白磷酸化 水平的影响
Figure 3 Effects ofAgaricusbrasiliensispolysaccharide on phosphorylation of IκBα protein in RAW264.7 cells
研究[20]表明,iNOS蛋白的表达、NO的释放与NF-κB信号转导通路的活化密切相关,NF-κB/IκB途径在其中起重要作用,故由试验结果可推测姬松茸多糖能够通过激活巨噬细胞NF-κB通路诱导其合成iNOS从而促进释放NO。
3 结论
本试验以巨噬细胞释放NO的行为变化为靶点,检测姬松茸多糖的免疫调节作用并探究其机制。试验结果显示,姬松茸多糖作用于小鼠巨噬细胞RAW264.7后,可通过激活NF-κB信号转导通路上调iNOS蛋白的表达,进而促进NO释放,从而发挥免疫调节作用,作用效果显著且具有良好的时效和量效性。本文选用了NF-κB信号转导通路探究姬松茸多糖对巨噬细胞的NO释放作用的影响机制,在后续的研究中,将对多糖的免疫活性及其他相关信号通路与机理等做进一步深入的探索。
