精子细胞XRCC1基因rs25487位点多态性与少弱精患者的相关性研究*
2018-07-14姚佳欣陈诗言刘青松苏敏张大鹏
姚佳欣陈诗言刘青松苏敏张大鹏
(1.川北医学院检验系,四川 南充 637000; 2. 川北医学院附属医院检验科, 四川 南充 637000;3. 什邡市人民医院检验科, 四川 德阳 618400)
据统计,全球已婚夫妇不孕不育的比例高达10%~15%,其中男性原因引起的不育约占50%[1-2]。少精弱精症是造成男性不育或生育力下降的主要原因之一。少精弱精症的病因不明,可能与精索静脉曲张、睾丸发育受阻、染色体畸变及相关基因突变等有关。研究表明,在人类精子形成过程中,基因表达转录水平的改变(基因突变或易感性)会影响相关基因蛋白的表达,导致精子发生障碍[3-4]。其中精子DNA损伤将影响精子受精能力、受精卵分裂以及胚胎发育[5]。当精子DNA损伤后,与DNA损伤修复相关基因多态性也可能会影响其功能,导致不同个体修复能力有所差异,最终影响男性生育力[6]。
X射线交叉互补修复基因1(X-rayrepaircrosscomplementing1,XRCC1)是一种重要的DNA碱基切除修复基因[7],通过编码蛋白质与DNA连接酶Ⅲ相互作用,修复DNA单链断裂[5]。该基因rs25487位点G→A与无精症发病风险存在争议。有研究表明,外周血XRCC1基因rs25487位点G→A与陕西回族[8]和汉族[4]人群的无精症发病风险存在关联,认为AA基因型可增加无精症发生的风险;也有研究认为AA基因型可以减少特发性无精子症的易感风险[7]。故本研究采用精子细胞DNA为研究对象,证明XRCC1基因rs25487位点G→A多态性与少弱精的相关性。
1 材料与方法
1.1研究对象少弱精患者来自川北医学院附属医院2015年9月~2016年8月门诊病例,所有病例经精液常规检查,按世界卫生组织(WHO)标准进行,均符合少弱精子症的诊断标准。纳入标准:少精:精液量<2.0ml;弱精:MI (a+b级精子百分率)<50%。健康对照人群为随机选自在同一医院男性健康体检者,且精液常规检测未发现异常,无既往相关病史。共入选182例少弱精患者和73例健康正常男性 。少弱精患者的平均年龄为(30.62±6.15)岁,健康对照者的平均年龄为(29.18±5.01)岁。
1.2样本收集精液标本采集前,要求禁欲5~7 d,手淫法取精液于干燥消毒的量杯中,置于37℃恒温水浴箱内液化,1h内利用。精液分析完成后,经4000 r/min离心10min,弃上清,留取沉淀物进行DNA提取。
1.3精子基因组DNA提取采集精液沉淀物,利用血液基因组DNA提取试剂盒[天根生化科技(北京)有限公司]进行精子细胞DNA提取。参照试剂说明书和通过两次裂解及延长消化时间至30min的改进,提取精子细胞基因组DNA,-80℃保存备用。
1.4XRCC1基因rs25487位点基因多态性检测采用聚合酶链反应-限制性段长度多态性(PCR-RFLP)方法检测。XRCC1基因rs25487位点的上游引物:5′-TCA CAC CTA ACT GGC ATC TTC ACT-3′,下游引物:5′-CTC CTT CCC TCA TCT GGA GTA CC-3′,20μl扩增反应体系中包含2×PCR Taq Green Master Mix 10μl,7μl Nuclease-Free Water和上、下游引物各0.5 μl(C=1. 0 mol/L),DNA模板2 μl。PCR反应条件为:95℃预变性5min;95℃变性30s,59℃退火30s,72℃延伸45s,35个循环后,72℃延伸10min。产物经10 g/L琼脂糖凝胶电泳(100V电压,0.5×TBE电泳缓冲液)20min,凝胶成像后分析结果。取8.5μl的PCR产物,加入1μl Buffer Tango和0.5μl限制性内切酶MSPⅠ (Fermentas,Lithuania),总体积10μl,37℃水浴孵育24h。酶切后,20 g/L琼脂糖凝胶电泳(100V,0.5×TBE电泳缓冲液)50min,凝胶成像后分析结果。
1.5 统计学分析利用SPSS 13.0软件进行统计分析,精液常规分析结果采用随机t检验;XRCC1基因rs25487位点SNP多态性采用Chi-square检验,以P<0.05为差异有统计学意义。
2 结果
2.1XRCC1基因rs25487位点遗传多态性检测结果经过PCR扩增,琼脂糖电泳扩增片段大小在330bp位置(图1A)。限制性内切酶酶切后,野生型产物GG基因型产生177、153bp两个片段,突变纯合子产物AA基因型只有330bp片段,突变杂合子产物GA基因型产生330、177、153bp3个片段(图1B)。

图1 XRCC1基因rs25487位点PCR产物和酶切产物琼脂糖电泳图Figure 1 Electrophoresis diagram of the PCR products and enzyme-digested products of XRCC1 gene rs25487 site
注:A. PCR产物电泳图,M:Marker Ⅲ,泳道1和2为正常组精子细胞DNA的PCR产物,泳道3和4为少弱精患者精子细胞DNA的PCR产物;B.酶切后产物电泳图,M:50bp DNA Ladder Marker;泳道1和3为GG基因型,泳道2为AA基因型,泳道4为GA基因型
2.2XRCC1基因多态与精液质量的关联分析精液常规检测结果显示,在相同的年龄阶段,少弱精患者的精子浓度和精子活率显著低于健康人群,精液的液化时间显著增加,差异均存在统计学意义(P<0.05),而精液量无显著差异(P>0.05),见表1。不同基因型与精液常规参数的关系结果显示,XRCC1基因Rs25487位点多态性与精液量不存在关联(P>0.05),但与液化时间、精子活力和精子浓度存在显著关联。携带AA纯合突变型个体与GG野生型相比,精子浓度和精子活力明显降低,液化时间明显延长,差异均有统计学意义(P<0.05),见表2。

Table1Comparisonofclinicaldatabetweendifferentexperimentalgroups

参数少弱精组(n=182)健康对照组(n=73)tP年龄(岁)30.62±6.1529.18±5.011.630.104精子浓度(×109/L)35.33±27.0678.98±40.399.7870.000精液量(ml)4.47±1.834.49±1.300.9150.361液化时间(min)47.33±21.0141.10±17.45-2.2190.004RP活率(×10-2)30.00±13.5763.78±9.8819.1360.000

表2 XRCC1基因Rs25487位点多态性与精液常规常见参数的关系Table 2 The correlations between the polymorphism of XRCC1 gene Rs25487 site and parameters of routine semen analysis
注:与野生型相比,①P<0.05
2.3XRCC1基因rs25487位点基因型和等位基因频率的分布情况与健康对照组相比,少弱精患者携带突变型基因型的比例显著增加,差异有统计学意义(P<0.05)。与GG基因型个体相比,携带AA基因型的个体患少弱精症的风险是GG基因型的7.84倍(95%CI低值为1.019),说明AA基因型是少弱精症的易感因素。XRCC1基因rs25874位点两种等位基因频率G、A在少弱精组和健康对照组中分布差异无统计学意义(P>0.05),见表3。
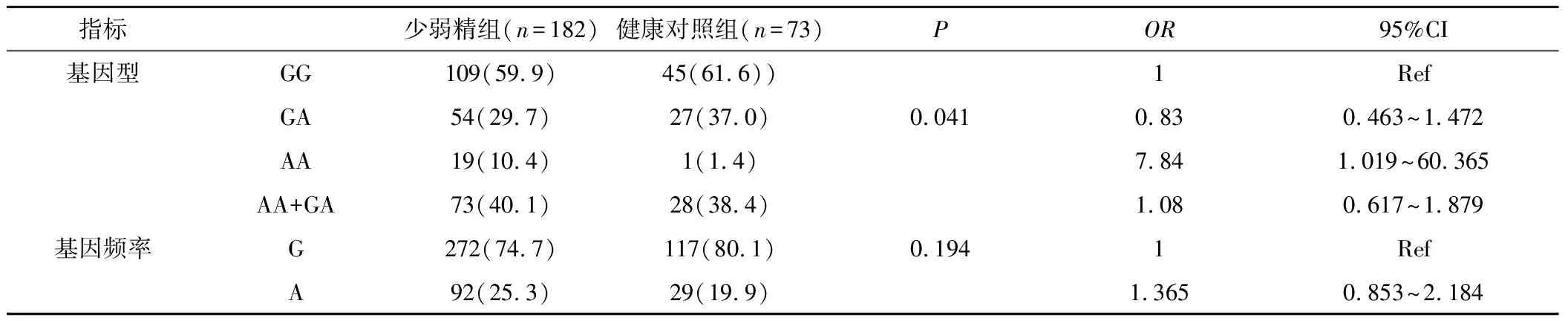
表3 少弱精患者XRCCI基因 rs25487位点基因型和等位基因频率与健康对照组之间的相关性[n(×10-2)]Table 3 The correlation genotype and allele frequency of rs25487 with the normal group
3 讨论
精液量、液化时间、精子浓度和精子活率是衡量精子质量常用指标,也是造成男性不育或生育力下降的主要原因。精浆是精子活动的介质和营养来源,可中和阴道的酸性分泌物,以免影响精子活力,故精液量减少可导致精子活力低下;液化时间延长或不液化可抑制精子活动,从而减少受孕机会,其主要原因是前列腺分泌液化因子减少,导致蛋白水解酶缺乏[9]。精子浓度和精子活力可以直接反应遗传能力,如果二者下降可能同时伴有精子DNA损伤率上升,精浆活性氧升高,精子细胞凋亡率上升,精子形态的变化以及精子膜完整性下降[10]。本研究中,我们对少弱精患者和健康人群此两种参数比较发现,精液量差异无统计学意义(P>0.05),但少弱精患者的液化时间显著增加,精子浓度和精子活力显著降低,差异有统计学意义(P<0.05)。
男性生殖是一系列复杂的生理过程,大约有2000多个基因参与此过程的调控。近年研究发现,很多常染色基因参与和调节男性生殖过程[11]。XRCC1是第一个被分离出来的参与修复离子辐射所致损伤的哺乳类动物的修复基因[12]。XRCC1基因定位于人类染色体19q13.2~13.3区域,大小为33kb,包含17个外显子和16个内含子[13]。研究表明,XRCC1基因位点rs25487与精子生成障碍可能相关。张健等通过对79例回族非梗阻性无精症患者和82例对照组进行XRCC1基因rs25487位点基因分型和等位基因频率分析发现,GA与GA+AA基因型是非梗阻性无精症的危险因素,A等位基因突变在非梗阻性无精症患者中的频率明显高于对照组(P<0.05)。提示XRCC1基因rs25478位点G→A可能与回族人群非梗阻性无精症的发病风险存在关联[8]。另有研究对该位点在特发性精子缺乏汉族人群中的研究发现同样类似结果[4]。但也有研究认为,与GG基因型相比,AA基因型可以减少特发性无精子症的易感风险[7]。
在本研究中,我们选择汉族少弱精患者为研究对象,采用精子DNA对XRCC1基因rs25487位点GG、AA、GA3种基因型频率进行分析,结果显示,少弱精患者和对照组中XRCC1基因rs25487位点GG、AA、GA3种基因型频率的分布存在显著性差异(P=0.041):与GG基因型相比,AA基因型患少弱精症风险是GG基因型的危险因素(OR=7.84,95%CI:1.019~60.365),与其他一些肿瘤易感性的研究结论相似[14-15];而两种等位基因频率G、A分布差异无统计学意义(P>0.05)。这与之前报道不完全一致,其原因可能为研究对象不同和DNA来源不同。
外周血(体细胞)和生殖细胞(精子细胞)中DNA存在差异。外周血和精液都能够检测出DNA反应遗传性状[16],但精子发生是一个非常复杂的过程,容易受到外部环境因素的影响而可能发生断裂或突变[17],常常能发现精子细胞与体细胞存在基因型的不同[18]。因此,精液能直观地反映配子状态,利用精液来提取DNA更有利于男性不育的病因研究和检测[19]。同时研究表明,不育男性与正常男性精子在转录水平上存在重要区别[20],且不育男性精子细胞内某些相关基因的多态性将是不育诊治研究的突破点。因此,本研究采用精子细胞DNA作为研究少弱精XRCC1基因rs25487位点多态性的结果更能直接说明基因多态性与生精障碍的相关性。但是因精子遗传物质处于高度浓缩状态,一直以来被认为是一种转录沉默的细胞[19],且精子DNA含非常丰富的鱼精蛋白和组蛋白,且与鱼精蛋白之间形成牢固的二硫键,导致精子DNA很难从核蛋白中分离[4]。研究表明,提取高质量精液基因组DNA成功的关键因素是精子裂解液[19]及消化时间。然而市场上精子裂解液价格昂贵,造成众多研究者采用外周血DNA替代精子DNA作为研究精子的对象。本研究采用血液基因组DNA提取试剂盒,通过两次裂解及延长消化时间,成功获取精子DNA,获得满意的PCR产物和酶切效果。
4 结论
本研究结果显示,少弱精患者的精子浓度和精子活力显著降低,液化时间显著延长,且XRCC1基因rs25487位点AA基因型是患少弱精症遗传的易感基因位点。
