寒温带兴安落叶松林土壤细菌微生物量和群落组成研究
2018-07-14杨立宾朱道光崔福星李金博宋瑞清倪红伟
杨立宾,隋 心,朱道光,崔福星,李金博,宋瑞清,倪红伟
(1.黑龙江省科学院自然与生态研究所,黑龙江 哈尔滨 150040; 2.东北林业大学 林学院,黑龙江 哈尔滨 150040;3.黑龙江大学 生命学院,黑龙江 哈尔滨 150040)
土壤微生物既是森林生态系统中的分解者,同时也是消费者,在森林生态系统中参与物质的循环、能量的流动和信息的传递。土壤微生物的种类组成和群落结构很大程度上决定着土壤的生物活性[1-2],因此通过土壤微生物的结构特征变化能够预测森林生态系统的结构和功能[3-4]。目前,有关土壤微生物的研究越来越多,而土壤微生物中土壤细菌的种类和数量最多[5],与此相关的研究也受到广泛关注。由于土壤细菌数量大、种类多,用传统的微生物培养方法进行分离鉴定远远不能反映土壤微生物的真实情况[6-8]。磷脂脂肪酸分析法通过对生物活体细胞膜重要组分进行鉴定,从而获得土壤微生物量以及多样性等方面信息[9]。高通量测序技术是第二代测序技术,具有通量高、灵敏度好、可重复性强等优点,能够系统、全面地测定和分析土壤微生物的群落结构特征及其功能。目前这些技术已广泛地应用于环境、医疗等与微生物相关的研究领域中[10]。
大兴安岭林区地处北半球高纬度区域,是响应全球气候变化最敏感的地区之一[11-12]。兴安落叶松Larix gmelini作为主要的建群种和优势种,是大兴安岭地区的地带性植被,也是寒温带气候条件下形成的气候演替顶级群落;其垂直分布能够达到森林分布的最上限,且林分面积大,蓄积量高,是我国主要的木材生产基地[13],也是我国北方森林生态系统的重要组成部分,对改善东北乃至全国的森林生态环境、促进林业可持续发展具有重要作用[14]。
目前大兴安岭地区有关土壤微生物的报道多是基于传统培养法进行的研究,这遗漏了土壤中的绝大多数微生物,难以反映微生物结构和功能的全貌。因此,本研究在黑龙江呼中国家级自然保护区内2014年建成的兴安落叶松林永久性固定监测样地中,以自然形成的藓类兴安落叶松林、杜香兴安落叶松林、草类兴安落叶松林和杜鹃兴安落叶松林为研究对象,采用磷酸脂肪酸法和高通量测序分析方法对土壤细菌的微生物量和组成结构进行分析研究,探讨不同林型土壤细菌群落结构变化特征和影响因子,揭示其变化规律,为兴安落叶松林的保护研究和大兴安岭森林生态系统保护等提供理论参考。
1 材料与方法
1.1 研究区概况与样品采集
研究区域位于大兴安岭呼中国家级自然保护区内,样地位于2014年建成的大兴安岭兴安落叶松林25 hm2永久性固定监测样地内。样地地形平缓,海拔为847~974 m,年均气温-4 ℃,年均降水量497.7 mm,年平均相对湿度为71%。群落结构比较简单,以兴安落叶松为主要优势种的寒温带针叶林,形成藓类-兴安落叶松林、杜香-兴安落叶松林、草类-兴安落叶松林和杜鹃-兴安落叶松林4种主要群落类型;分别对应冰冻沼泽土、表浅棕色针叶林土、生草棕色针叶林土和典型棕色针叶林土4种土壤类型。样地内共有Dbh>1 cm的木本植物41种,其中乔木4种,灌木14种,草本127种,隶属于21科39属。
2016年7月对样地的4个不同类型土壤进行样地调查采样工作。4个林型对应的土壤类型下文中分别以A、B、C、D代替。在大样地中每个类型土壤选取3个样方(20 m×20 m),去除腐殖质层,用直径为10 cm的土钻在每个样方地的四角和中心位置分别采集土层0~10 cm处的土壤样品,充分混合后作为土壤的混合样品。人工挑出凋落物、细根和小石块等杂物后过2 mm尼龙筛并分成2份,一份放置冷藏箱内4 ℃保存,带回实验室,保存于-80 ℃,用于土壤微生物测定;另一份土壤带回实验室用于测定土壤理化参数。
1.2 试验方法
土壤理化性质的测定在黑龙江省科学院自然与生态研究所进行。土壤含水率采用铝盒烘干法测定,土壤含水率采用烘干法测定;pH值采用电位法测定;土壤总氮、碱解氮、有机碳质量分数采用CN元素分析仪测定;土壤全磷质量分数采用钼锑抗比色法测定;土壤有效磷质量分数采用NaHCO3浸提比色法测定;土壤全钾、速效钾质量分数采用火焰光度计法测定。
磷脂脂肪酸分析法的提取过程和分析方法主要参考Bossio[15]和刘波等[16]提出的方法。称取相当于8 g干土的新鲜土样,加入缓冲液经震荡、抽提、浓缩等环节,再经有机溶剂抽提,以19:0甲酯为内标进行测定[17]。PLFAs的检测采用美国MIDI公司生产的微生物自动鉴定系统(Sherlock Microbial Identifica-tion System Sherlock MIS4.5)进行,电子轰击电离源(EI)到质谱检测,峰面积通过计算机自动积分。
本研究用PLFAs总量表示土壤微生物总生物量,细菌的生物量可以通过 i15∶0,a15∶0,15 ∶ 0,i16 ∶ 0,16 ∶ 1ω9,16 ∶ 1ω7t,i17∶ 0,a17∶ 0,17∶ 0,18∶ 1ω7,cy19:0的PLFAs 的总含量进行估算,放线菌的生物量用10Me16∶0、10Me17∶0、10Me18:0的含量来估算;可用16∶0(10Me),17∶0(10Me),18∶ 0(10Me),i15∶ 0,a15∶ 0,i16∶ 0,i17 ∶ 0 和 a17 ∶ 0 的 总 含 量 来 估 算 革 兰 氏 阳性 菌 的 含 量 ,可 用 16 ∶ 1ω5,16 ∶ 1ω7 t,16∶ 1ω9,cy17∶ 0,18∶ 1ω5,18∶ 1ω7 和cy19∶0 的总含量来估算革兰氏阴性菌的含量[18]。
土壤微生物总DNA提取采用美国强力土壤试剂盒(MOBIO12888),按照说明书的操作步骤进行提取。将提取出的土壤微生物总DNA溶解在100 µL 去离子水中,取5 µL的DNA用1.0%的琼脂糖凝胶电泳检测(0.5×TAE缓冲液),分析DNA的完整性和相对浓度并由测序公司进行高通量测序。细菌16S扩增引物采用通用引物(338F/806R)。根据 barcode 标签序列和前引物序列筛选出有效序列后,将测序接头与barcode序列去除,并对处理后的有效序列进行数据统计。用mothur和chopseq对所得序列进行分析,以97%相似性为标准划分操作分类单元。将优化序列根据silva库中的参考序列对 OTU 进行分类鉴定。在纲(classis)的水平上做样品群落分布柱状图,比较4个土壤环境中的细菌分布情况[19]。
1.3 数据处理
不同林型土壤理化性质、PLFAs含量、生态学指数的显著性分析采用单因子方差分析(ANOVA)和最小显著差数法(LSD),不同林型土壤特征对土壤细菌微生物量和群落组成的影响采用R语言中的线性冗余分析(RDA)。用Coverage表示测序深度指数,分别用Ace和Chao1指数表示细菌群落丰度,用Simpson和Shannon指数表示细菌群落物种的丰富度和多样性;以上指数用mothur进行分析。
2 结果与分析
2.1 土壤理化性质
通过表1可以看出,4个林型不同土壤类型间的土壤含水率随海拔升高而降低并存在显著性差异,其中A林型含水率最大,接近90%,趋向饱和状态;B林型居中,C林型和D林型无显著性差异。从pH值可以看出各林型土壤均为酸性,其中B林型土壤pH值酸性最强并与其他3个林型存在显著性差异。4个林型其土壤各个营养元素之间存出现不同程度的显著性差异。土壤全氮、碱解氮A林型最高并明显高于其它各林型,土壤全氮随海拔升高而降低。全磷各林型差距不大,随海拔升高而降低并存在显著性差异。有效磷A林型明显高于其它并存在显著性差异。土壤全钾和速效钾含量B林型较低,4个林型无明显分布规律。土壤有机碳A林型最高,B林型最低。
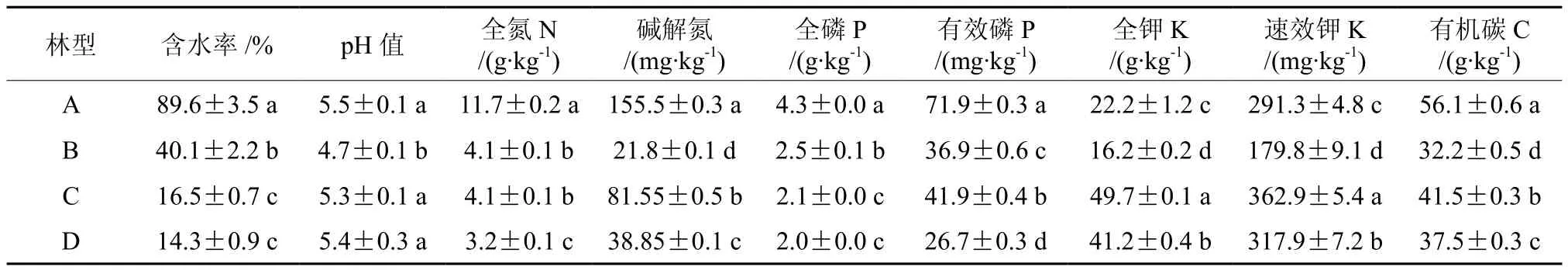
表 1 不同林型土壤理化性质†Table 1 Soil physical and chemical characteristics in different forest types
2.2 土壤细菌群落脂肪酸特征
通过磷脂脂肪酸生物标记分析(见表2),可以看出兴安落叶松4种林型土壤细菌群落PLFAs种类丰富,含有多种饱和、不饱和、分支和环状的磷脂脂肪酸的生物标记。试验共检测出C12~C20共44种PLFAs生物标记(表2)。磷脂脂肪酸生物标记在4个林型中土壤中分布为不完全分布类型,磷脂脂肪酸种类、含量(表2)以及各菌群总含量(见表3)均存在差异。D林型含有42种PLFAs,A和B数量相同含有41种,C林型含有38种。磷脂脂肪酸总量A林型最高,为1 869 μg/g;C 林型最低,为 1 085 μg/g;各林型之间存在显著性差异。
将磷脂脂肪酸中的主要类群(Ba、Gp、Gn、Ac)进行统计和分析(表3),可以看出4个林型土壤中细菌(Ba)含量最大,革兰氏阴性菌(Gn)次之,放线菌(Ac)含量最少。PLFA细菌总量和细菌(Ba)含量A林型最高,B林型和D林型次之,C林型最低。革兰氏阳性菌(Gp)含量D林型最高,C林型最低。革兰氏阴性菌(Gn)含量A林型最高,C林型最低。各样地中革兰氏阴性菌含量多于革兰氏阳性菌含量,比值大于1,说明革兰氏阴性菌占主要优势。
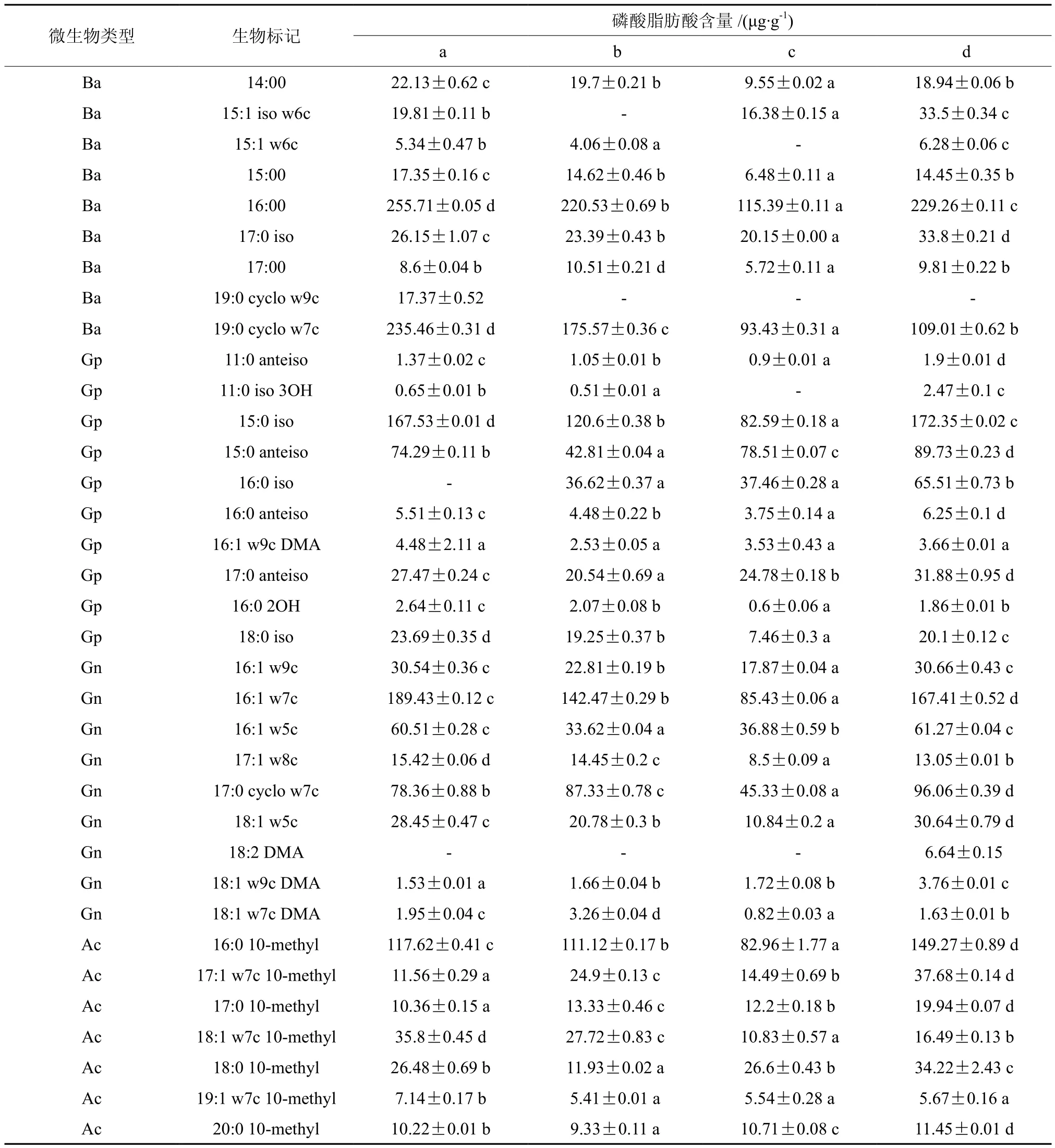
表 2 土壤细菌群落磷脂脂肪酸生物标记分析†Table 2 Analysis of PLFAs biomarkers related to the soil bacterial communities
采用Sat/Mon(饱和直链脂肪酸与单烯饱和脂肪酸含量之比)、Gp/Gn(革兰氏阳性菌与革兰氏阴性菌PLFAs含量之比)来分析不同微生物类型的相对含量。结果发现(表3),Sat/Mon比值各林型中藓类兴安落叶松林最高并依次降低,具有显著性差异。Gp/Gn比值各林型土壤的比较发现,除草类兴安落叶松林之外比值均小于1,说明除了该林型之外各林型中Gp含量少于Gn,革兰氏阴性菌占绝对优势;其中草类兴安落叶松林最高为1.123 8,杜香兴安落叶松林最低为0.669 4,各林型间Gp/Gn比值存在显著性差异。
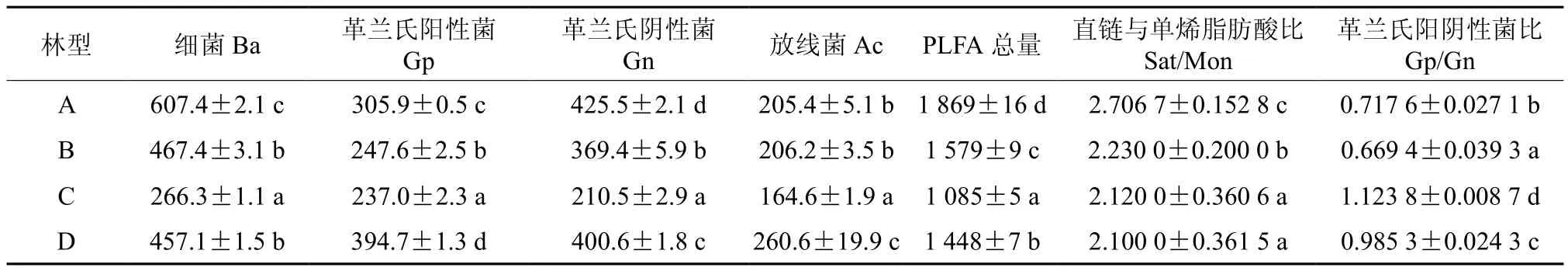
表 3 土壤细菌磷脂脂肪酸含量†Table 3 PLFAs contents of bacteria in soils (μg/g)
2.3 土壤细菌测序结果分析
土壤样品原始序列条数为51 080,通过优化过滤低质量序列后得到有效序列总数为45 763。供试土壤样品序列经拆分、去冗余后在97%相似度下进行OTU聚类,共得到1 188个OTU。各林型OTU数目A最低并与其它三组存在显著性差异,为174,B、C、D分别为338、336、340。如图1所示,不同类型土壤的样品稀释性曲线均趋向平缓,但尚未呈现饱和;这说明了供试样品取样合理,测试数据量合理,实际土壤细菌群落结构置信度较高,能够真实的反应土壤样本的细菌群落组成结构,但可能还有一些少量的土壤细菌没有被发现。
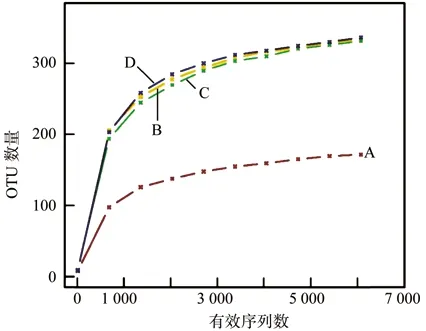
图1 相似度为0.97条件下各土壤样品的稀释性曲线Fig.1 Rarefation curves of each soil sample at cutoff level of 3%
Coverage指数表示各样品文库的覆盖率,其数值越高,则样本中序列没有被测出的概率越低。该指数实际反映了本次测序结果是否代表样本的真实情况。如表4所示,不同类型土壤环境样品测序的coverage指数A最高为0.995,B、C、D为0.994。说明本试验的测序结果能够准确的反映供试土壤样品的真实情况,这与稀释性曲线显示的结果相一致。
Ace指数和chao1指数是用来估计群落中OTU数目的指数,是生态学中估计生物物种总数和菌群丰富度的常用指数。如表4所示,不同林型土壤细菌的Ace指数和chao1指数C>D>B>A,B、C、D与A存在显著性差异。说明B、C、D林型中的土壤细菌总数和菌群丰度较高,而A林型最较低。
用Shannon指数和Simpson指数来估算供试土壤样品中微生物的alpha多样性。Shannon指数D>B>C>A,Simpson指数值D>B>C>A,说明B、C、D林型土壤细菌群落的信息量最大且复杂程度最高,而A林型土壤细菌群落的均匀度较高。
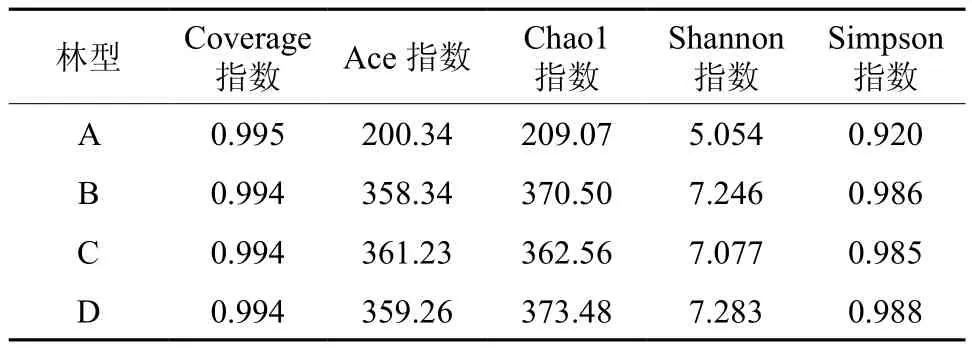
表 4 相似度为0.97条件下各土壤样品多样性指数Table 4 Diversity index of each soil sample at cutoff level of 3%
测序共获得19门35纲55目87科92属细菌。图2所示,在纲分类水平上分属于5个主要类群,主要包括变形菌Alphaproteobacteria、γ-变形菌Gammaproteobacteria、酸杆菌Acidobacteria、β变形菌Betaproteobacteria、放线菌Actinobacteria。γ-变形菌各林型样品中的丰度为2.4%~41.61%,在A林型中为最优势菌门,表现出明显的优势地位。变形菌在所有样品中的丰度为12.95%~33.78%,在B、C、D林型中为最优势菌门。
在纲的分类水平上,A林型中共获得17纲细菌,其中γ-变形菌相对丰度最高,为41.61%,为该林型的优势菌;其余相对丰度较高的依次为β变形菌(24.57%)、变形菌(12.95%)、酸杆菌(11.57%)。B林型中共获得28纲细菌,其中变形菌相对丰度最高,为33.78%,为该林型的优势菌;其余相对丰度较高的依次为酸杆菌(13.51%)、放线菌(11.06%)。C林型中共获得32纲细菌,其中变形菌相对丰度最高,为26.29%,为该林型的优势菌;其余相对丰度较高的依次为放线菌(11.94%)、β-变形菌(10.13%)、γ-变形菌(10.05%)。D林型中共获得28纲细菌,其中变形菌相对丰度最高,为21.9%,为该林型的优势菌;酸杆菌含量为20.51%,为次优势菌。在属分类水平上各土壤环境中优势菌不相同,共有菌相对丰度也不同,说明不同类型土壤细菌组成和群落结构存在差异(P<0.05)。
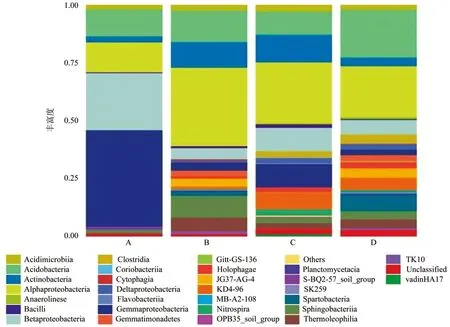
图2 纲分类水平下的微生物群落组成Fig. 2 Composition of bactetial community at class level
2.4 土壤理化性质对土壤细菌的影响
从图3可以看出,冗余分析结果表明有效磷对土壤细菌生物量的影响较大,与土壤细菌Ba、革兰氏阳性菌Gp、革兰氏阴性菌Gn、放线菌Ac呈负相关。β-变形菌Betaproteobacteria和γ-变形菌Gammaproteobacteria与土壤pH值、有机碳、全氮、碱解氮、土壤含水率正相关,与全钾、速效钾负相关。变形菌Alphaproteobacteria和放线菌Actinobacteria与全磷和有效磷正相关。酸杆菌Acidobacteria与有效磷负相关。藓类兴安落叶松林(A)分布在X正半轴上,其土壤细菌群落结构与其它3个林型差异较大;草类兴安落叶松林(C)和杜香兴安落叶松林(B)分布在第三象限,与杜鹃兴安落叶松林(D)的土壤细菌群落结构也存在较大差异;相比之下4个林型中,杜香兴安落叶松林(B)与草类兴安落叶松林(C)土壤细菌群落结构差异较小。
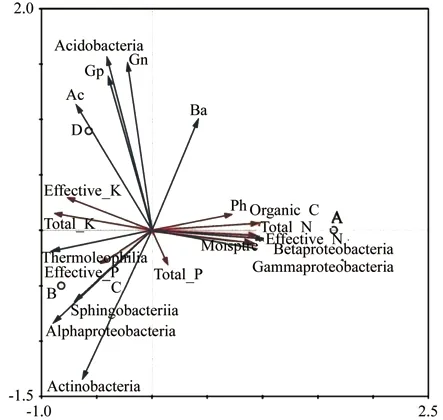
图3 不同林型土壤理化性质与土壤微生物群落结构的RDA排序结果Fig. 3 RDA ordination of soil microbial compositionand soil physical and chemical characteristics
3 讨 论
3.1 土壤细菌微生物量
有研究表明,不同林型的土壤微生物群落结构特征存在差异[20],土壤理化性质能够影响土壤微生物量和群落结构[21],其中土壤含水率[22]、土壤pH值[23]、土壤养分含量[24-25]等为重要影响因子。本研究中,兴安落叶松4种不同林型土壤细菌的微生物量群落结构分布明显不同,所测试的土壤细菌总量、革兰氏阳性菌总量、革兰氏阴性菌总量随土壤含水率升高而升高,这说明了湿润的土壤能够提高微生物的活性,从而增加微生物量,并影响微生物的群落结构[26]。细菌、革兰氏阳性菌、革兰氏阴性菌含量在土壤pH值、土壤有机质、全氮、碱解氮含量最高的藓类兴安落叶松林中最高,这可能与细菌喜好较高pH值和高有机质的土壤环境有关[27-28]。
饱和直链脂肪酸/单烯饱和脂肪酸比(Sat/Mon),革兰氏阳性菌/ 革兰氏阴性菌(Gp/Gn)是描述环境胁迫下土壤微生物群落结构状况的主要指标[29]。本研究中4个林型土壤微生物Sat/Mon比值随全氮、全磷、土壤有机碳含量升高而增大且比值均大于1,这与Carrasco[30]等认为的Sat/Mon值小于1含有较高有机质含量的结果相反。Gp/Gn比值除草类兴安落叶松林之外均小于1,表明Gp含量少于Gn,Gn占主导,说明这些地区容易分解的有机物含量较高[29]。同时Gp/Gn值随土壤全钾和速效钾升高而增大,产生该结果的原因有待进一步研究。
此外,有研究指出土壤细菌群落与地表苔藓类、泥炭层[31]的厚度密切相关。本研究中藓类兴安落叶松林的地表植被为苔藓层、泥炭层所覆盖,该区域中的特征磷脂脂肪酸,如一般性、非特异性细菌16:00含量最高,这与林英华等[27]的研究结果相一致。一般饱和脂肪酸14:00和单烯不饱和脂肪酸16∶1w9c属于常见细菌的特征脂肪酸,在4个林型中均显示出随有机质含量的变化而变化,可能与可利用的碳源有关[32]。
3.2 土壤细菌结构和多样性
有研究指出[33]土壤中变形菌门相对丰度在10%~77%之间,平均丰度为39%,酸杆菌门相对丰度在5%~46%之间,平均丰度为20%,疣微菌门相对丰度在0~21%之间,平均丰度为7%。本研究中变形菌门、酸杆菌门、疣微菌门相对丰度均在该范围内,这与Shen等[34]对长白山森林主要土壤细菌丰度 (变形菌49.6%、酸杆菌18.7%、放线菌12.8%、疣微菌0.17% )的研究结果相类似,但与白晓旭等[35]对宝天曼森林土壤细菌丰度(变形菌29.0%、酸杆菌18.5%、疣微菌10.0%)的研究结果差别很大。造成该差异的原因可能来自于变形菌门中的β变形菌纲的丰度变化(大兴安岭11.46%,长白山18.6%,宝天曼5.6%)[35],其丰度可能受pH值(长白山和大兴安岭平均pH值在5以上,明显高于宝天曼的2.4~4.5)和土壤养分等环境因子影响[36]。
4种不同林型土壤细菌种类分布明显不同,存在很多差异性类群。藓类兴安落叶松林与其他3个林型显示出较大差异,藓类兴安落叶松林以γ-变形菌为主要优势菌群,而其他3个林型以变形菌为主要优势菌群,这与相关研究结果相似[37-38],但是与李新等[39]研究认为的变形菌为盐碱土壤或碱性土壤中主要类群的研究结果不相同。
土壤细菌的生物量和群落结构具有高度的复杂性,生物地理学研究者认为经纬度是影响其差异的重要因素[40-41],也有学者认为土壤环境、立地条件、地上植被等[42-43]是其影响的重要因素。本研究中,4个林型中土壤细菌微生物量和群落结构规律性不强,特别是藓类兴安落叶松林的多项数据与其它3个样地相差较大,这可能与该林型所处的特殊地理位置有关。藓类兴安落叶松林处于山坡底部,水分含量接近饱和状态且土壤层下部存在永冻层,地上植被多以泥炭藓为主,腐殖质层厚。从研究结果看,土壤含水率、土壤养分含量高,这可能是造成藓类兴安落叶松林的特殊性和研究结果规律性不显著的原因。基于前期对兴安落叶松林不同林型真菌的研究结果和本次对土壤细菌的群落结构和微生物量的研究,课题组已对大兴安岭寒温带兴安落叶松林土壤微生物有了初步认识,下一步将在25 hm2永久性固定监测样地进行区域尺度的土壤微生物群落结构的监测研究。
4 结 论
(1)磷脂脂肪酸法测试结果表明兴安落叶松林中4个林型的土壤细菌微生物量和群落组成存在较大差异,其中藓类兴安落叶松林与其它3个林型表现出明显不同。
(2)通过测序,共获得19门35纲55目87科92属土壤细菌。在纲分类水平上分属于5个主要类群,主要包括变形菌Alphaproteobacteria、γ-变形菌Gammaproteobacteria、酸杆菌Acidobacteria、β变形菌Betaproteobacteria、放线菌Actinobacteria。
(3)冗余分析表明,土壤细菌微生物量和群落组成受土壤环境和土壤养分影响程度不同。有效磷对土壤细菌生物量的影响较大,土壤pH值、土壤含水率和土壤养分对土壤细菌的群落组成影响比较明显。
