病毒类疫苗的无菌生产工艺布局
2018-07-13李锦秀
徐 哲 李锦秀
(中国航空规划设计研究总院有限公司,北京100120)
0 引言
无菌是生物技术中的一个重要概念。培养基、发酵设备等只有处于无菌前提下,微生物接种后,才能实现纯种培养,最终得到所需的产品。
生物疫苗可分为细菌类疫苗和病毒类疫苗。细菌类疫苗以培养、发酵工艺为主,病毒类疫苗以细胞培养、病毒扩增工艺为主,这两类疫苗的工艺生产具有相似性。
本文针对不同生产工艺的、非最终灭菌的病毒类生物疫苗产品,对其生产车间的工艺布局进行了分析,提出了更经济、更高效、更合理的工艺布局模式。
1 生产工艺流程及设备分析
1.1 工艺流程分析
病毒类疫苗的生产流程(图1)可以分为以下几个阶段:(1)细胞复苏培养及扩增,该生产过程为无毒生产过程;(2)细胞扩增到一定程度后进行细胞洗涤,并加入病毒液接种,然后带毒培养,并不断洗涤;(3)细胞培养好后,收集疫苗液;(4)如果制作灭活疫苗则需要进行病毒灭活、制作过程,如果生产活疫苗则不需要该过程;(5)配制疫苗原液;(6)分装入库。同时,病毒接种前需要经过复苏培养及扩增阶段。
1.2 工艺设备分析
目前,病毒类生物疫苗的原液生产工艺主要包括:转瓶培养、细胞工厂培养以及生物反应器培养(罐培养)等。
转瓶培养技术是传统的细胞培养技术,工艺相对落后。现国内各企业通过工艺的优化升级,逐步将传统的转瓶培养工艺升级为细胞工厂培养或者生物反应器培养工艺。
细胞工厂培养技术,对贴壁细胞的大规模培养有着明显优势。首先,采用细胞工厂培养工艺,适用于扩大生产,无需添加生产设备,大大缩短了从研发到生产的时间。其次,细胞工厂培养工艺的一次性投入很少,无需大型昂贵设备,也无需复杂的管道设计。此外,细胞工厂培养工艺能够灵活地根据市场需求,安排生产规模。因此,越来越多的疫苗生产厂家采用细胞工厂培养技术大规模培养细胞。
生物反应器培养技术,作为现阶段比较先进的一种技术,与传统的转瓶培养技术以及细胞工厂培养技术相比,具有如下优点:(1)单位体积内的有效工作细胞数量增加;(2)全密闭、管道化的系统生产流程及过程自动化监控、控制技术,不仅减少了污染细胞的可能性,而且减轻了劳动力强度,减少了人为误操作因素的影响;(3)生物反应器容积的扩大,提升了终端产品的均一性,结合后期纯化工艺,不但产品产量明显提高,产品质量也获得提升;(4)生产疫苗所用劳动力和车间、水、电、原材料、能源等成本远低于传统的转瓶培养工艺,综合成本大大降低。

图1 病毒类疫苗生产流程
2 不同生产工艺步骤的洁净室级别
某一工艺步骤需满足的洁净室级别取决于各工艺步骤的执行情况,主要有两种基本情况:开放系统的操作(开放工艺步骤)和密闭系统的操作(密闭工艺步骤)。
这两种情况的具体设计理念如下:密闭工艺步骤要求产品在整个工艺步骤持续时间内装在完全关闭、密封的容器(或罐等)中,需通过泄漏试验对容器(或罐等)进行气密性验证。如有必要的话,可以采用经完整性检测并且被用作阻挡容器(或罐等)外洁净室空气接触的屏障——除菌级通风过滤器对容器(或罐等)进行通风。如果在密闭工艺步骤中必须向产品中添加物质或取样,就需使用适当的无菌装置,例如蒸汽穿阀装置,一次性无菌连接、无菌取样系统或熔管器/密封器。如果满足这些前提条件,所有密闭工艺步骤可在D级环境下进行。D级是GMP指南中所定义的用于如CIP/SIP之前进行拆卸和组装设备的最低洁净室级别。
对于开放工艺步骤和系统,基于产品染菌风险,一般区分为两种情况:
情况1:如果产品明显暴露于洁净室空气中,就是完全开放的工艺步骤或系统。例如,产品置于瓶中,但瓶盖被移开进行取样;或产品置于罐中,但人孔(检修孔)盖被打开用于添加溶液。
情况2:关闭的但非密封的容器、罐等也被视为开放系统,相关工艺步骤也被定义为开放式步骤。例如,产品置于带盖的玻璃瓶中,但瓶和盖之间没有保证气密性的胶垫。但此种情况下的产品染菌风险远远低于情况1。
通常情况下,产品灭菌前的开放式工艺步骤应该在C级环境下完成。C级比D级高一个级别(D级适用于密闭工艺步骤),更重要的是,C级是第一个对动态粒子有要求的房间级别。
产品灭菌前,上述情况2的系统/工艺步骤可以在C级洁净室下进行,不需额外的保护处理。然而情况1的系统/工艺步骤,由于产品染菌的风险高,需要借助UAF(单向流)装置进行额外的局部保护。
产品灭菌后,情况1的开放式工艺,需在B+A环境下进行(或A级隔离器,二选一)无菌操作。情况2的开放式工艺,不适用于无菌产品生产,需确保A级环境外的产品容器完全密封。
需要注意的是,所有不直接与产品生产相关的工艺步骤,即非关键步骤,如设备清洁、工装清洗、灭菌密封等将在D级区完成。必要时,清洁品的开放处理可在D级区域内的UAF装置保护下完成。
3 不同生产工艺的工艺布局分析
非最终灭菌的不可除菌过滤的病毒类生物疫苗产品,鉴于其产品特性,不可最终除菌过滤及灭菌,要求在原液生产过程中,在最后一步可除菌或灭菌工艺之后,全程无菌操作以满足无菌要求。
非最终灭菌的不可除菌过滤的病毒类生物疫苗的生产工艺一般包括:转瓶培养工艺、细胞工厂培养工艺以及生物反应器培养工艺。
3.1 转瓶培养工艺的工艺布局
受传统惯例、对GMP等法规认识不深、无菌概念不清晰等因素的影响,传统的转瓶培养工艺一般在C级环境下的局部层流保护下生产。
根据法规要求,C级环境下的局部层流保护环境,不可作为无菌操作环境,其层流保护下的环境不是无菌环境,在该环境下生产,产品染菌风险较高,影响产品质量及收率。
如按照无菌操作要求,将生产车间环境提升至B级背景下的A级环境,则会大大增加造价以及运行成本。由于转瓶培养工艺的收率相对较低,在增加成本的同时,不能有效提高收率,因此车间整体的布局经济性、可行性较低。
现阶段各企业经过工艺优化升级,逐步淘汰了转瓶培养工艺的大规模生产,仅在病毒培养等局部工艺或小规模生产中采用。传统转瓶培养工艺的车间局部工艺布局如图2所示。
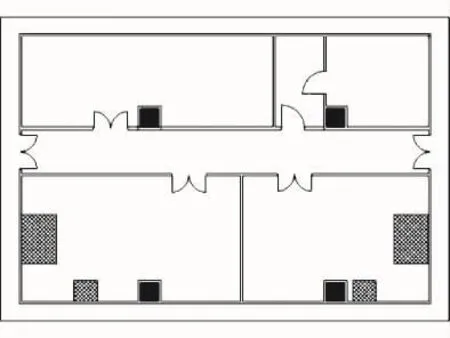
图2 传统转瓶培养工艺的车间局部工艺布局
由图2可以看出,传统的转瓶培养工艺均是在C级环境下的层流保护下进行,无菌环境的保证性较差。因此需对传统的转瓶培养工艺的工艺布局进行优化升级,如图3所示。优化升级后的工艺布局,将装瓶培养无菌操作设置在B级背景下的局部A级层流保护中,实现无菌操作,保证了产品质量。培养箱设备放置在低级别的D级区,开口设在B级区,在方便使用的同时,减少了对B级区的影响,便于设备维修、维护。退出部分设置前室,对操作间仅开设一个门,降低对操作间无菌环境的影响。
3.2 细胞工厂培养工艺的工艺布局
细胞工厂培养工艺在连接、换液等操作环节不能够实现密闭操作。传统的国内原液生产车间,以二倍体细胞狂犬疫苗为例,其车间工艺布局如图4所示。将细胞培养、毒种接种以及培养等工艺设置在C级环境中,在C级背景下的局部层流保护下进行生产暴露操作,仅将最后的纯化操作设置在B级环境下。这种操作不能实现无菌,染菌风险较大。由于二倍体狂犬病毒疫苗不可最终除菌过滤,生产过程如果不能实现全程无菌化操作,则产品质量不能得到有效控制。
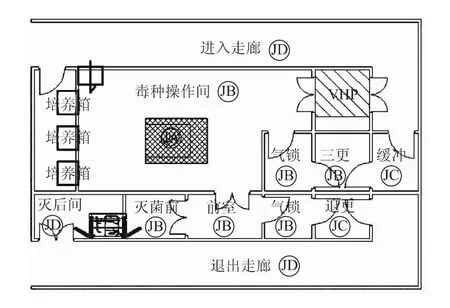
图3 优化升级后的转瓶培养工艺车间局部工艺布局
D级环境下进行,因此有两种选择:
(1)将培养设置在B级环境下,这样方便操作和使用,物料无需反复进出B级区,但能耗较大,在大规模生产中可行性不高。
(2)为了保证无菌环境,充分考虑能耗等因素以及物料如何有效进出B级区,B级区需要采用VHP灭菌、湿热灭菌等有效的灭菌手段以控制无菌环境。根据VHP的特性,进出时长在1 h以上,不利于细胞、病毒的培养。同时,细胞工厂反复进出B级区,在增加工作量的同时,也不利于B级环境的保持。因此,考虑将操作间与恒温室采用背靠背的模式,利用穿墙连接,实现物料在B级操作间内无菌操作的同时,在D级环境下培养。优化后的细胞工厂车间局部工艺布局如图5所示。

图4 原细胞工厂培养工艺的生产车间局部工艺布局
根据无菌操作要求,原液生产一般在B级背景下的A级环境下完成。操作完成后,放置于恒温室内恒温培养一段时间后,反复进行换液等操作,若干次后收获原液。恒温培养时,细胞工厂处于密闭状态,因此在D级环境下的恒温室培养即可。
由于细胞操作在B级环境下进行,恒温培养在
3.3 生物反应器培养工艺的工艺布局
根据反应器的性能及特点,生物反应器可分为两类:一类是非全密闭反应器,即反应器本身培养过程是全密闭化的,但不可实现在线清洗等操作;另一类是全密闭反应器,即反应器可实现全密闭化生产、清洗、操作等。因此,需根据不同的反应器类型,有针对性地进行工艺布局。

图5 优化后的细胞工厂车间局部工艺布局
非全密闭生物反应器,是一种多用于小规模生产下的小容量生物反应器,一般为玻璃等材质。根据无菌要求,其生产操作需要在B级背景下的A级环境中进行。非全密闭生物反应器局部工艺布局如图6所示。

图6 非全密闭生物反应器局部工艺布局
从图6可以看出,非全密闭生物反应器的生产操作间为B级环境,能耗较大,适用于不可完全密封、在线清洗的操作场合。而生物反应器经过长期发展,优化升级,可实现全密闭培养和操作,实现在线清洗、灭菌等。通过生物反应器的优化升级,可降低对环境的要求,如果全过程实现密闭操作,则生产环境可降为D级,全密闭生物反应器局部工艺布局如图7所示。
从图7可以看出,全密闭生物反应器的生产操作间为D级环境,能耗较低。

图7 全密闭生物反应器局部工艺布局
4 结语
随着GMP的深入发展及其对产品质量要求的不断提高,无菌概念越来越受到关注与重视。本文针对不同生产工艺要求的病毒类疫苗的无菌生产,对其工艺布局进行了分析和优化,提出了经济、有效、可行性较高的工艺布局模式。在满足无菌操作要求的基础上,充分考虑车间运行成本,减少了高级别空调区域的面积,提高了工艺布局的经济性与可行性。