双须骨舌鱼卵黄蛋白受体基因(vtgr)组织表达及生物信息学分析
2018-07-13周康奇潘贤辉牟希东郑曙明胡隐昌宋红梅杨叶欣
周康奇,潘贤辉,刘 奕,牟希东,郑曙明,胡隐昌,宋红梅,杨叶欣
(1.西南大学,重庆北碚400715;2.农业部休闲渔业重点实验室,广东省现代休闲渔业工程技术研究中心,中国水产科学研究院珠江水产研究所,广州510380)
卵黄蛋白原(Vitellogenin,Vtg)的合成及其在卵黄蛋白原受体(Vitellogenin receptor,Vtgr)中的胞吞方式,在卵生动物繁殖过程中起着至关重要的作用。目前,对于鱼类肝组织Vtg合成的激素驱动机制已被广泛研究,并被证明受17β-雌二醇(E2)调控。E2通过激发雌激素受体(ER)进行信号传导,刺激肝细胞合成Vtg并释放到血液中。然后,经血液循环到达卵巢,被卵母细胞膜微绒毛上分布的Vtgr蛋白通过胞吞作用摄入,从而为胚胎发育提供营养物质[1,2]。研究结果表明卵母细胞膜内确实存在表面受体Vtgr,其主要功能在于结合并以胞吞形式为卵母细胞摄取Vtg,从而为胚胎发育提供营养[3-5]。目前,大部分学者对非洲爪蟾(Xenopuslaevis)等[6-8]卵生脊椎动物的vtgr和Vtgr蛋白研究已较为深入,包括vtgr结构差异、vtgr的表达特征、蛋白功能和作用途径等方面。而对克氏原螯虾(Procambarusclarkia)等[9-11]甲壳动物与昆虫则主要集中于对vtgr结构和功能的研究。
双须骨舌鱼(Osteoglossumbicirrhosum)隶属于骨舌鱼目(Osteoglossiformes)骨舌鱼科(Osteoglossidae)骨舌鱼属(Osteoglossum),俗称银龙鱼(SilverArowana),分布于南亚马逊河流域,属于亚洲国家名贵特种观赏鱼之一[12]。迄今为止,关于双须骨舌鱼研究多在性腺组织学观察[13]、SSR引物筛选[14]、染色体核型分析[15]和性别相关基因amh功能分析[16]等方面,其目的都在于探索一种有效鉴定性别的方法。而本次研究双须骨舌鱼性腺发育中的vtgr基因及其表达特征,旨在进一步了解vtgr基因特点,进而为性别鉴定方法的建立提供思考。本研究拟通过克隆获得vtgr全序列,探究vtgr在雌雄鱼上的组织表达特征,并对性腺发育至Ⅱ、Ⅲ和Ⅳ期的雌雄鱼vtgr表达量进行分析,探讨两者间的变化规律,从分子水平上为下一步研究双须骨舌鱼性腺的发育机理提供基础数据。同时,该数据将与本实验室对vtg的研究结果相对应,进一步分析两者在双须骨舌鱼性腺发育过程中的相互作用。
1 材料与方法
1.1 实验材料
本研究共用双须骨舌鱼24尾,其中雌雄各12尾,Ⅱ期雌雄各3尾:体长(40.63±0.80) cm,体重(361.23±10.4) g;Ⅲ期雌雄各6尾:体长(43.23±2.18) cm,体重(604.27±11.24) g;Ⅳ期雌雄各3尾:体长(45.62±1.74) cm,体重(689.33±10.21) g。性腺发育分期参考汪学杰等[13]关于双须骨舌鱼性腺发育分期的研究结果。实验用鱼均来源于珠江水产研究所观赏鱼基地。
rTaq,PrimrScript RT Reagebt Kit (with gDNA Eraser),Smarter Race5′/3′Kit Components,E.Coli DH5α,pMD19-T Vector,SYBR Green Master Mix等购自于TAKARA公司;TRlzol Reagent,Tissue RNA kit等购自于OMEGA公司,TIANgenl Midi Purification Kit,TIANprep Mini Plasmid Kit购自于天根生化科技(北京)有限公司。
1.2 实验方法
1.2.1总RNA的提取及cDNA第一链的合成
提取性腺发育至Ⅱ期、Ⅲ期和Ⅵ期双须骨舌鱼卵巢和精巢组织总RNA。此外,随机挑选6尾2龄双须骨舌鱼(性腺发育Ⅲ期,雌雄各3尾),分别提取性腺、肝、脾、肾、鳃、心、头肾、脑等8种组织总RNA,然后用BioTek CytationTM5多功能酶标仪测定总RNA浓度和纯度,以及1.0%琼脂糖电泳检测总RNA完整性。各取1.2 ng RNA反转录成cDNA样品,-20 ℃保存备用。
1.2.2vtgr基因克隆
根据双须骨舌鱼vtgr的转录组拼接序列,并参考GenBank中美丽硬仆骨舌鱼(Scleropagesformosus)、金线鲃(Sinocyclocheilusgrahami)、红腹水虎鱼(Pygocentrusnattereri)、大西洋鲑(Salmosalar)、斑马鱼(Daniorerio)等鱼类vtgr基因序列设计双须骨舌鱼vtgr基因核心序列引物,分别为vtgr-F1/R1和vtgr-F2/R2(表1)。25 μL PCR反应体系含有18.9 μL ddH2O,2.5 μL 10×Buffer,2 μL dNTPs(2.5 mmol/L),各0.4 μL上下游引物(10 μmol/L),0.6 μL cDNA,0.2 μL rTaq 。PCR条件为:95 ℃ 4 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 90 s,30个循环;72 ℃ 10 min。PCR产物用1.0%的琼脂糖凝胶电泳分离,胶回收、连接、转化,筛选阳性克隆测序。
用VectorNTI软件将2对引物测序结果进行比对,并将其拼接得到vtgr核心序列。然后根据该序列分别设计的5′RACE和3′RACE巢式PCR引物vtgr-5′n、vtgr-5′w与vtgr-3′w、vtgr-3′n(表1),扩增vtgr的5′端和3′端序列。将vtgr核心序列、5′端和3′端序列经VectorNTI软件拼接,获得完整的双须骨舌鱼vtgrcDNA全序列(图1)。
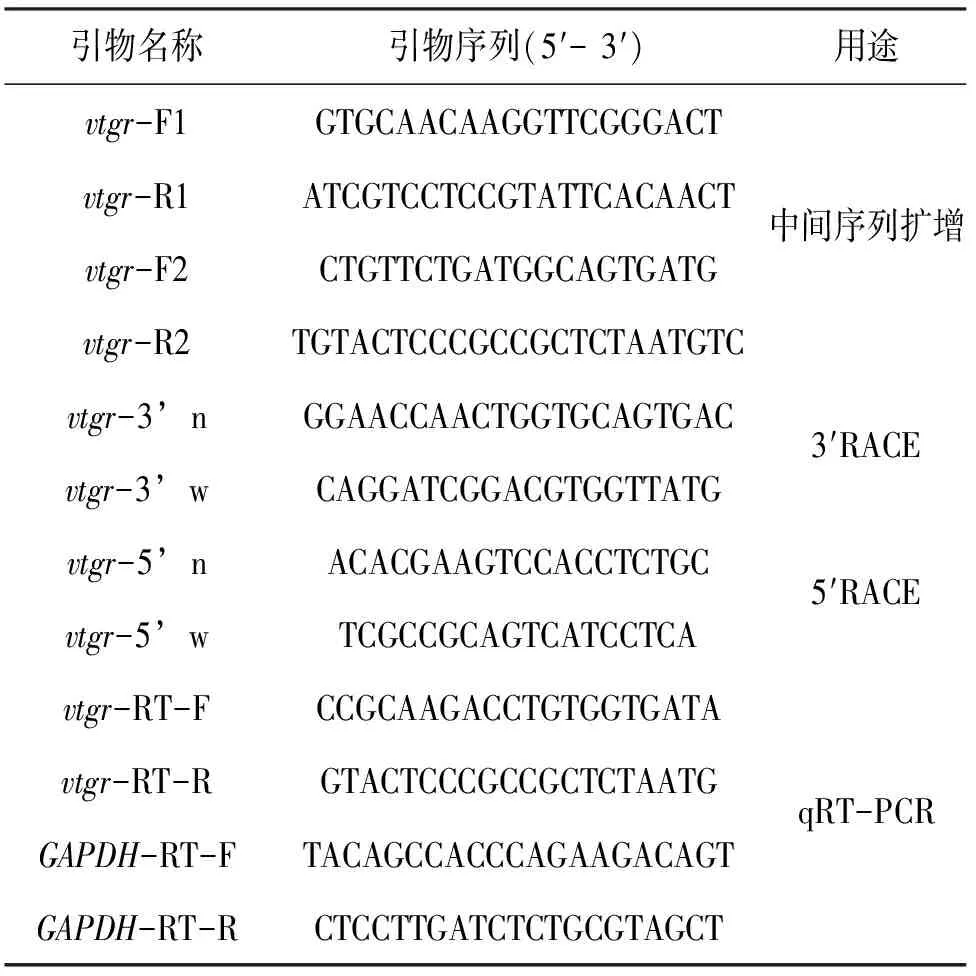
表1 实验中用的引物Tab.1 Primers used in this study
1.2.3基因序列分析
运用NCBI内ORF Finder工具对vtgr全序列进行开放阅读框(ORF)查找,并用BioEdit软件翻译ORF。用ProtParam 软件分析蛋白质理化性质(http://web.expasy.org/protparam/);用TMHMM软件进行跨膜区结构预测(http://www.cbs.dtu.dk/services/TMHMM-2.0/);用Prabi SOPMA软件进行蛋白二级结构预测(https://npsa-prabi.ibcp.fr/cgi-bin/);用SWISS-MODEL软件进行蛋白三级结构预测(https://swissmodel.expasy.org/);用ProtScale(http://web.expasy.org/protscale/)软件进行亲疏水性分析;用SignalP 软件分析信号肽(http://www.cbs.dtu.dk/services/SignalP);用NetNGlyc 1.0 Server软件进行糖基化分析(http://www.cbs.dtu.dk/services/NetNGlyc/);用NetPhos 2.0 Server软件进行磷酸化分析(http://www.cbs.dtu.dk/services/NetPhos-2.0/);用ClustalX1.83软件和Clustal Omega软件进行氨基酸序列多序列比对(http://www.ebi.ac.uk/Tools/msa/clustalo/);用SMART软件进行结构域分析(http://smart.embl-heidelberg.de/);用NCBI中的BLASTP程序进行基酸序列同源性检索,并用MAGE 5.2软件构建系统进化树(从GenBank选用vtgr编码氨基酸序列见表2)。

图1 双须骨舌鱼vtgr克隆策略Fig.1 Clone strategy of vtgr gene in O.bicirrhosum图中F1/R1和F2/R2都与表1引物对应
1.2.4组织表达
选用双须骨舌鱼GAPDH作为内参基因,其引物序列引用王且鲁等[16](表1)。根据测得的双须骨舌鱼vtgrcDNA全序列设计一对荧光定量PCR(qRT-PCR)引物vtgr-RT-F和vtgr-RT-R(表1)。分别将以上2对引物的PCR扩增产物连接到pMD19-TVector并转入大肠杆菌感受细胞中,经测序、比对后,将阳性克隆菌落进行过夜培养,再进行质粒提取。
用BioTek CytationTM5多功能酶标仪测定质粒浓度,然后对其以10倍梯度稀释,共设12个梯度。用QuantStudio6 Flex仪器制作标准曲线,若R2>0.99,斜率在-3.0~-3.6之间,则说明标准曲线制作合格,可进行实验数据检测。qRT-PCR体系共20 μL,包括10 μL SYBR Green Master Mix,1 μL cDNA,8 μL ddH2O,各0.5 μL上下游引物(10 μmol/L)。反应条件:50 ℃ 2 min;95 ℃ 5 min;95 ℃ 15 s,55 ℃ 30 s,72 ℃ 30 s,40个循环;溶酶曲线:95 ℃, 15 s;60 ℃,2 min;95 ℃,15 s;每个样品重复3次。用QuantStudioTM Real-Time PCR Solftware v1.2软件计算每个样品的目的基因和内参基因扩增后的拷贝数(Qty),各样品的目的基因和内参基因Qty值之比即为目的基因相对表达量。用excel作图,实验数据统计分析用SPSS 20软件进行单因素方差分析(One-Way ANOVA)和Duncan多重比较分析显著性差异。

表2 用于构建系统进化树的物种Tab.2 Species used to construct phylogenetic trees
2 结果与分析
2.1 vtgr全序列分析
用VectorNTI软件拼接得到vtgrcDNA全序列为2 841 bp(登录号:MG266905),ORF为2 556 bp,共851个编码氨基酸。序列两端分别存在26 bp的5′非编码区(untraslated region,UTR)和258 bp的3′UTR,且3′端含有典型的poly(A)尾和一段加尾序列AATAAA。经ProtParam和ProtScale 软件预测该基因的蛋白分子质量为93.6 ku,等电点pI为4.78,分子式为C3984H6212N1136O1303S84,亲水性平均系数为-0.409,表明亲水性强。
2.2 vtgr编码氨基酸序列生物信息学分析
2.2.1信号肽与跨膜区域分析
用SignalP 4.1 软件分析结果显示,该序列信号肽区域分值(S)为0.243,信号肽剪切位点分值(C)为0.460,剪切位点分值(Y)为0.938,mean S和D分别为0.851、0.671,高于临界值0.450,表明该蛋白存在信号肽,并位于N端的1~26位氨基酸区域(图2)。经TMHMM软件分析表明,该序列含有一个跨度为16个氨基酸的跨膜区域(TM),位于第589至604位氨基酸(图3),说明该蛋白为跨膜蛋白。

图2 vtgr编码蛋白质序列信号肽Fig.2 The vtgr encoded a protein sequence signal peptide
2.2.2糖基化位点与磷酸化位点分析
用NetNGlyc 1.0软件分析发现该序列含有4个N-糖基化位点,分别位于第17、129、359、570位氨基酸。N端糖基化位点的存在对蛋白修饰和调节功能具有重要作用。用NetPhos 2.0软件分析表明该序列共含有32个磷酸化位点,其中23个丝氨酸(Ser),5个苏氨酸(Thr)和4个酪氨酸(Tyr)磷酸化位点。
2.2.3结构域分析
用Smart软件分析显示该序列含有8个A型低密度脂蛋白受体结构域(Low-density lipoprotein receptor domain class A,LDLa),2个类表皮生长因子结构域(Epidermal growth factor-like domain,EGF),1个钙结合类表皮生长因子(Calcium-binding EGF-like domain,EGF-CA),5个低密度脂蛋白受体YWTD结构域(Low-density lipoprotein-receptor YWTD domain,LY)(图3)。
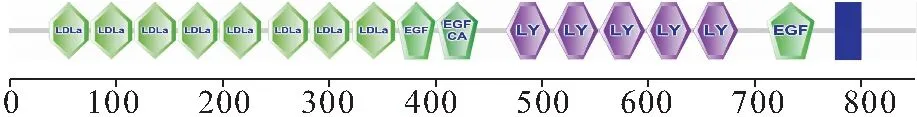
图3 vtgr基因编码蛋白质序列保守域Fig.3 The vtgr gene encodes conserved domains of protein sequences
2.2.4二级结构三级结构预测
用PredictProtein软件预测发现,vtgr不含有α-螺旋结构,主要由β-折叠和无规则卷曲构成,各占27.17%和72.83%,并含有跨膜区域与HMTMM预测结果相同(图4-A),含有丰富β-折叠在蛋白质肽链中有交联作用,可推测该蛋白结构化学性质较为稳定。同时,SWISS-MODEL软件预测的三级结构结果也显示该蛋白不含有α-螺旋结构,C端具有β-折叠和无规则卷曲组成的球型空间结构(图4-B)。
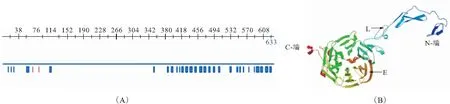
图4 vtgr编码氨基酸序列二级结构(A)和三级结构(B)Fig.4 The secondary structure and tertiary structure of vtgr encoded amino acid sequence (A):蓝色的为β-折叠结构;红色和空白处为无规则卷曲结构;(B):E为β-折叠结构;L为无规则卷曲结构.
2.3 vtgr编码蛋白序列同源性与系统进化树分析
2.3.1vtgr编码蛋白序列同源性分析
用ClustalX1.83和Clustal Omega软件进行氨基酸序列比对分析发现,双须骨舌鱼vtgr与美丽硬仆骨舌鱼相似度最高,达到95.96%;其次与大西洋鲑、虹鳟、红腹水虎鱼、白斑狗鱼、斑马鱼等相似度都超过80%,分别为87.02%、86.97%、86.9%、85.61%和85.48%;与小家鼠、智人、原鸡相似度分别是72.23%、71.68%和70.99%,而与非洲爪蟾的相似度最低,为52.95%(图5)。此外,本研究将双须骨舌鱼vtgr与塞内加尔舌鳎两种vldlr结构型进行氨基酸序列比对发现,双须骨舌鱼vtgr基因结构和塞内加尔舌鳎vldlr2相同都缺少O-联糖结构域(O-glycan domain),且存在1个胞浆区(Cytoplasmic domain,CD)(图6)。
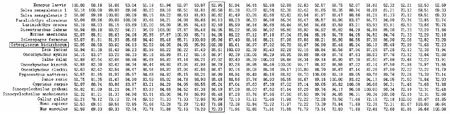
图5 vtgr编码蛋白序列比对相似度百分比矩阵图Fig.5 The similarity percentage matrix of vtgr gene encoding protein sequence 每一列表示其他物种与其中一种物种(100%)进行编码蛋白质序列比对获得的相似度结果;红框表示其他物种与双须骨舌鱼进行编码蛋白质序列比对获得的相似度结果。

图6 vtgr编码氨基酸序列比对Fig.6 Sequence alignment of vtgr coding protein方框内依次为8个LDLa;2个EGF;1个EGF-CA;5个LY;1个TM;1个CD。O-glycan存在于塞内加尔舌鳎vldlr1。
2.3.2vtgr系统发育树分析
运用MEGE5.2软件中Neighbor-Joining法构建进化树分析双须骨舌鱼vtgr与其他物种亲缘关系结果表明,双须骨舌鱼与美丽硬仆骨舌鱼聚为一支,该结点的自引导值为100%,表明二者亲缘关系最近,这与传统鱼类学分类结果一致;而与斑马鱼、虹鳟、牙鲆、银大马哈鱼等鱼类亲缘关系较远(图7)。
2.4 vtgr在不同组织和发育性腺时期的表达量分析
运用qRT-PCR方法检测双须骨舌鱼vtgr在8个组织中的表达量(图8-A),结果表明vtgr在8个组织中均有表达,其中在雌雄鱼性腺中表达量最高,其次是肝和肾。在雌鱼卵巢和雄鱼精巢组织中vtgr相对表达量都显著高于鳃、肝、脾、肾、心、头肾和脑7个组织(P<0.05),且这7个组织间无显著差异(P>0.05)。将雌雄个体相同组织vtgr表达量进行差异显著性分析发现,雌鱼的肝和脾显著高于雄鱼(P<0.05),而性腺、鳃、肾、心、头肾和脑6个组织则均无显著差异(P>0.05)。vtgr在不同发育时期的雌雄鱼性腺中的表达量变化进见图8-B。在Ⅱ期卵巢中vtgr的表达量显著高于Ⅲ和Ⅳ期(P<0.05),但雄鱼3个时期之间无显著差异(P>0.05)。性腺发育Ⅱ和Ⅲ期雌鱼vtgr表达量显著高于雄鱼(P<0.05),而Ⅳ期则无显著差异(P>0.05)。

图7 基于vtgr编码氨基酸序列构建进化树Fig.7 Phylogenetic tree constructed based on vtgr gene coding amino acid sequences各支上数值表示经1 000次运算得到的引导值;标尺表示每单位氨基酸的变化率。

图8 不同组织和时期的vtgr相对表达量Fig.8 The relative expression of vtgr in different tissues and periods不同的小写字母表示雌鱼不同组织和时期显著差异(P<0.05),相同则无显著差异(P>0.05);不同大写字母表示雄鱼不同组织和时期显著差异(P<0.05),相同则无显著差异(P>0.05);*表示雌雄鱼同一组织和时期显著性差异(P<0.05),并标于高的一端。
3 讨论
本研究是用卵巢组织总RNA反转录为cDNA,通过RACE方法克隆获得双须骨舌鱼vtgrcDNA 全序列,并运用相关生物信息学软件对该基因编码氨基酸序列进行分析,发现该基因编码的氨基酸序列含有典型的LDLR基因超家族的脂蛋白受体的结构,与目前已在NCBI文库中发布的虹鳟[17]、非洲爪蟾[18]、 美洲狼鲈[19](MoroneAmericana)等卵生脊椎动物的极低密度脂蛋白受体(vldlr)结构相似,表明该基因属于vldlr。此外,因使用SignalP软件预测结果为分泌型信号肽,而且研究表明蛋白质N端信号肽是指导分泌蛋白在内质网上合成的决定因素,故推测该蛋白属于分泌蛋白,且Smart软件分析结果表明含有跨膜区域,说明该蛋白为表面受体蛋白。另外,从磷酸化位点分析结果发现该基因含有丰富的丝氨酸磷酸化位点,对蛋白质变构和激活蛋白质活力起到重要作用,而酪氨酸磷酸化位点除包含以上功能外,还可以结合蛋白,以促使与其他蛋白形成多蛋白复合体,从而发挥细胞信号传导功能。
通过qRT-PCR对双须骨舌鱼不同组织和不同性腺发育时期vtgr的表达量检测结果显示,在Ⅱ期卵巢中的vtgr表达量最高,随后逐渐减低,这与Bujo等[20]、Prat等[21]、Hiramatsu等[19]对其他卵生动物所描述的类似。根据研究结果表明,双须骨舌鱼卵巢vtgr表达模式和卵巢发育阶段紧密相关,vtgr在卵泡发生时在卵巢中高度表达,随后在卵黄发生过程中表达量逐渐降低。根据刘红等[9]对虹鳟卵巢进行免疫组织化学研究发现卵巢发育前期(I和Ⅱ期)vtgr的表达分布在卵母细胞膜上,细胞质中含量较少,是因该基因的编码蛋白质具有转运Vtg与传递信号等功能[21-23]。推测双须骨舌鱼vtgr转录主要发生在卵黄生成前,需要大量消耗vtgrmRNA,致使vtgr表达量升高。而在卵黄生成时,前期合成的Vtgr蛋白被连续循环地转运至卵膜发挥胞吞作用,使得Ⅲ和Ⅳ期中vtgr表达量显著下降。在本实验室前期对双须骨舌鱼vtg相对表达量的研究中发现,该基因在Ⅱ、Ⅲ和Ⅳ期卵巢中的相对表达量逐渐升高。这一结果与本次研究vtgr表达变化趋势相反,其原因在于Vtg合成主要起始于Ⅲ期后,而Vtgr合成发生在Ⅱ期前为下一步卵母细胞吸收Vtg提前做准备,以便为卵巢发育提供充足的营养。
本研究在雄鱼的精巢内也检测到vtgr表达,且显著高于其他组织,但3个时期表达量无显著差异。与卵巢相比Ⅱ和Ⅲ期精巢表达量显著低于卵巢,而Ⅳ期无显著差异。由于目前研究以雌性鱼类为主要研究对象,因此未能找相似结果。但根据前期对双须骨舌鱼vtg研究[24]发现,在雄鱼的精巢中也检测到vtg表达,推测Vtg是为精子发育提供营养与协助受精的作用。因此猜测精巢中Vtgr具有吸收Vtg为精子提供营养的功能,但该结果还需进一步验证。
双须骨舌鱼vtgr作为LDLR家族细胞表面受体的成员,其对细胞内外的脂蛋白循环调节发挥着重要的作用。根据Brow等[24]研究发现在哺乳动物中LDLR是血浆中主要的胆固醇载脂蛋白,作用于调节哺乳动物细胞内的胆固醇平衡。而在鱼类的vtgrcDNA中包含的8个LDLa结构与哺乳动物VLDLRs高度相似[25]。目前已发现VLDLR可以作为中枢密度脂蛋白受体,在外周组织中具有独特的配体特异性,与哺乳动物的脂蛋白脂肪酶具有相同作用[26]。已有研究表明在鱼类的肝和脾中含有丰富的胆固醇,因此,观察到双须骨舌鱼vtgr在肝和脾中有较高的表达,可能是转运组织中的胆固醇至血浆,通过血液循环到达鱼体其他组织,从而达到维持机体胆固醇平衡的目的。
本研究目的在于探究vtgr在雌雄双须骨舌鱼组织中的表达特征,以及在性腺不同发育时期表达规律,为进一步研究Vtgr蛋白在性腺发育过程中的功能提供基础数据,也有助于我们对卵生鱼类精子发育和卵母细胞生长的深入了解。
