血清α-L-岩藻糖苷酶、甲胎蛋白、脱γ-羧基异常凝血酶原检测在原发性肝癌诊断中的价值及临床意义研究
2018-07-13党小军侯智辉刘发全
林 召 党小军 侯智辉 刘发全
1.广东省东莞市大岭山医院检验科,广东东莞 523820;2.陕西省人民医院检验科,陕西西安 710068;3.深圳市中医院检验科,广东深圳 518033
原发性肝癌(PHC)在我国发病率较高,且患者生存率较低,有学者指出,造成PHC生存率较低的原因之一为其早期诊断相对不足,部分患者在确诊时已错失最佳治疗时机,后续治疗效果显著降低,使患者病死率增加[1]。病理学检查一直作为PHC诊断的金标准,但需通过穿刺取肝组织才能完成检查,对患者创伤较大,患者多不耐受,故寻找其他创伤较小的检查方法迫在眉睫[2]。近年来,超声诊断技术在我国发展迅速,但超声难以发现发现直径<3cm的肝脏肿块,且超声检查受操作者影响较大,临床诊断有一定缺陷[3]。而血清学检查为一种操作简便且相对廉价的诊断技术,对PHC的诊断有利。临床上最常使用的血清肿瘤标志物为甲胎蛋白(AFP),其在20世纪末期被推荐为PHC的监测工具,然而血清AFP水平在良性肝病患者中也能明显升高,仅用单一指标检测可造成漏诊及误诊[4]。因此,发现其他血清学标志物以提高血清学指标的检出准确率有其必要性与重要性。临床研究发现,α-L-岩藻糖苷酶(AFU)可受到PHC患者体内癌细胞的激活而异常升高,脱γ-羧基异常凝血酶原(DCP)缺乏凝血酶原活性,在肝细胞发生癌变时可显著升高,此2种标志物在PHC诊断中均有一定作用[5]。基于此,本研究回顾性分析我院98例PHC患者、84例良性肝病患者及84例体检健康者临床资料,以分析AFU、AFP、DCP在检测PHC中的诊断价值。
1 资料与方法
1.1 一般资料
回顾性分析2014年11月~2017年10月我院与陕西省人民医院98例PHC患者(A组)、84例良性肝病患者(B组)及84例体检健康者(C组)临床资料。纳入标准:A组为经影像学、病理学检查确诊PHC者;B组为经临床症状及影像学检查确诊肝炎或肝硬化等良性肝病者;C组为本院同期体检健康者;年龄40~75岁;临床资料完整者。排除标准:合并血液系统疾病影响血清学指标者;妊娠或哺乳期女性;伴糖尿病、高血压肾炎等疾病者。A组男女比例为1.513:1(59/39),平均年龄(56.8±7.7)岁;B 组男女比例为 1.625:1(52/32),平均年龄(56.2±8.0)岁;C组男女比例为1.545:1(51/33),平均年龄(57.1±7.2)岁。三组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 指标检测方法
三组均于清晨抽取空腹肘静脉血5mL,以3000r/min离心10min,取上清液待测;三组抽血及血液检测均由同一组医务人员完成。采用全自动生化酶法检测AFU水平,检测试剂由浙江福康生物技术有限公司提供,并利用美国贝克曼库尔特有限公司生产的AU680型全自动生化分析仪检测;采用化学发光法测定AFP水平,检测试剂为美国贝克曼库尔特有限公司生产的原装进口试剂,并使用该公司生产的UniCel DxI 800全自动化学发光免疫分析仪检测;采用酶联免疫分析法检测DCP水平,检测试剂由上海星科生物科技有限公司提供,使用瑞士帝肯公司生产Infinite F50全自动酶标仪检测。A组则使用彩色超声诊断仪(日立医疗器械株式会社生产,HIVISION Preirus,探头 EUP-C715-1,频率为3.5MHZ)和核磁共振成像(MRI)(德国西门子股份公司生产,MAGNETOM Skyra 3.0T)检测,分别记录其检出情况。
1.3 指标阳性检出标准
AFU正 常 值 范 围:0~ 40U/L,以 AFU>40U/L为阳性[6];AFP正常值范围:0~ 20μg/L,以 AFP> 20μg/L为阳性[7];DCP正常值范围:0~350mAU/mL,以DCP>350mAU/mL为阳性[8]。
1.4 观察对象
记录三组血清AFU、AFP及DCP水平差异,分析比较三组单项及联合检测阳性率差异;并记录A组血清学联合检测检出率与超声、MRI检出率差异。
1.5 统计学方法
2 结果
2.1 三组血清AFU、AFP及DCP水平比较
A组血清AFU、AFP及DCP水平均高于B组及C组(P<0.05),B组上述指标水平均高于C组(P< 0.05),见表 1。
表1 三组血清AFU、AFP及DCP水平比较(±s)
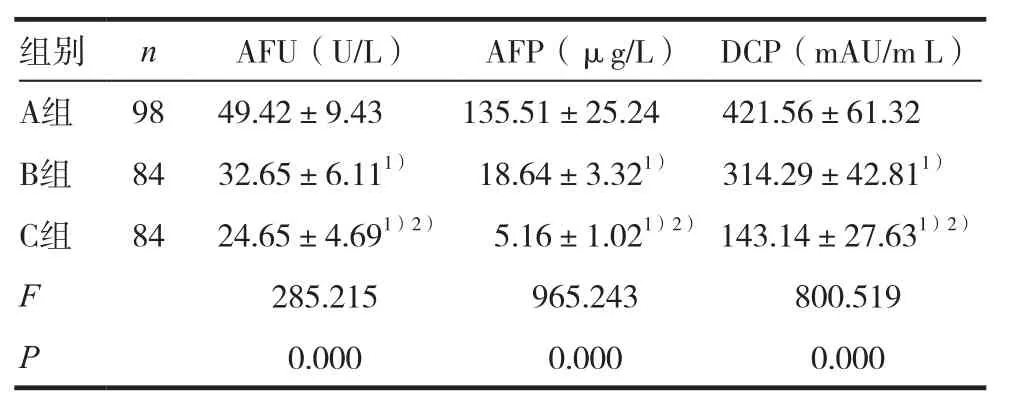
表1 三组血清AFU、AFP及DCP水平比较(±s)
注:与 A 组比较,1)P < 0.05;与 B 组比较,2)P< 0.05
组别 n AFU(U/L) AFP(μg/L) DCP(mAU/m L)A组 98 49.42±9.43 135.51±25.24 421.56±61.32 B组 84 32.65±6.111) 18.64±3.321) 314.29±42.811)C组 84 24.65±4.691)2) 5.16±1.021)2) 143.14±27.631)2)F 285.215 965.243 800.519 P 0.000 0.000 0.000
2.2 三组指标单项检测及联合检测阳性率比较
A组AFU、AFP、DCP及3项联合检测阳性率分别为83.67%、72.45%、79.59%及93.88%,其中3项联合检测阳性率最高;A组指标单项检测及联合检测阳性率均高于B组及C组(P<0.05),B组指标单项检测及联合检测阳性率均高于C组(P<0.05),见表 2。
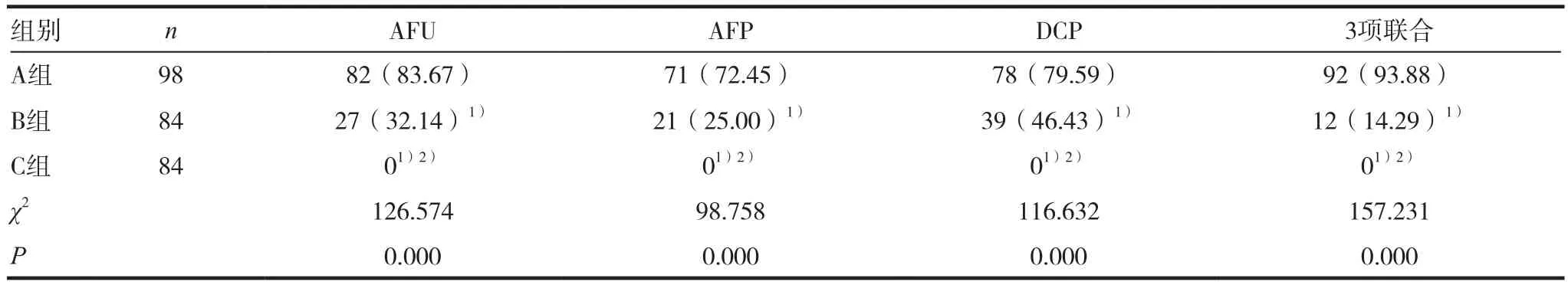
表2 三组指标单项检测及联合检测阳性率比较[n(%)]
2.3 A组相关检查检出率比较
A组血清学联合检测检出率明显高于超声及MRI检测(P< 0.05),见表 3。
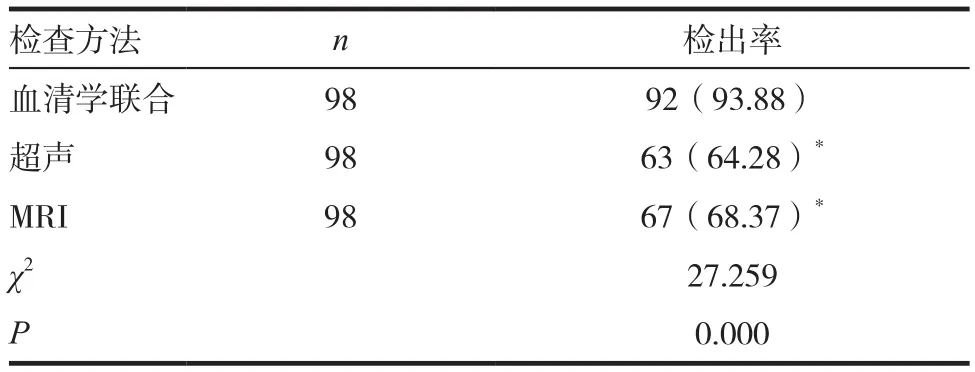
表3 A组相关检查检出率比较[n(%)]
3 讨论
PHC发病隐匿,早期症状不明显,超声及MRI等影像学检查也难以发现肿块较小的早期PHC,故在患者发生相关症状前确诊率极低[9]。随着本世纪初期大众对AFP的了解增多,许多体检中心或检查单位将AFP检查列为常规体检项目,以达到早期筛查PHC的目的[10]。但近年来国内外研究发现,临床上仍有30%~40%的PHC患者血清AFP水平在正常范围内,而部分慢性肝炎、肝硬化患者血清AFP水平则可出现中等水平表达,使得AFP检查的假阳性率与假阴性率较高,单一诊断效果下降[11]。近年来,血清学标志物受到学术界的重视,有关PHC的血清指标也较多。
AFU为在机体各实质器官溶酶体内广泛存在的酸性水解酶,在肝肾组织中活性较高,在肝癌细胞酶蛋白合成增加而降解速度减慢和癌细胞破裂坏死时显著增高[12];DCP为肝细胞产生的无活性凝血酶前体,可由肝癌细胞内相关酶的羧化功能异常,致其无法利用维生素K(VK),而引起PHC患者血清DCP水平明显升高[13]。另外,高水平的DCP还能刺激肝癌细胞生长、浸润及转移,对评估PHC患者预后也有积极意义[14]。因此,血清AFU及DCP均能辅助诊断PHC。本研究结果也证实,PHC患者血清AFU、AFP、DCP水平均明显高于良性肝病患者及健康人群,提示AFU、AFP及DCP均对诊断PHC有一定意义。
本研究也对3种指标检测阳性情况展开分析,结果显示,虽然此3种指标在健康人群检查中未出现阳性,但仍有20%~50%良性肝病患者检出阳性,这也提示AFU、AFP及DCP单项检测特异性较低,对PHC诊断具有一定缺陷,与王晴晴等[15]研究结果一致。分析其原因可能与肝脏病变时肝细胞对AFU清除能力降低,导致血清AFU聚集、升高[16],而肝硬化患者毛细血管脆性增加引起VK缺乏而使DCP水平升高有关[17]。此外,本研究对PHC患者3种指标单项及联合检测阳性率比较,发现3项联合检测阳性率最高,与宋森涛等[18]研究结果一致。不仅如此,血清学3项联合检测检出率也明显较超声及MRI检测高,这也进一步说明AFU、AFP及DCP联检测对诊断PHC更有利。
综上所述,血清AFU、AFP及DCP均能辅助诊断PHC,但3项联合检测能提高PHC检出率,诊断价值更高。
