PCR-DHPLC检测方法在病毒性出血性败血病诊断中的应用
2018-07-12吴斌苏立明肇慧君蔡晓萍关鹏
吴斌,苏立明,肇慧君,蔡晓萍,关鹏
(1.辽宁出入境检验检疫局,辽宁 大连 116001;2.中检集团辽宁公司,辽宁 大连 116001)
病毒性出血性败血病(Viral haemorrhagic sep ticaemia,VHS)是由弹状病毒引起鲑、鳟、狗鱼和大菱鲆等十多种鱼类的一种烈性传染病,表现为出血性败血症,致死率达到90%以上[1]。该病主要流行于北半球,是世界动物卫生组织(OIE)必须申报的疫病[2],我国将其列为二类疫病。
目前国际上检测VHSV通常采用的方法是细胞培养分离病毒法,血清学方法、反转录聚合酶链反应法[3]以及酶联免疫吸附试验[4]。细胞培养分离VHSV法结果可靠,但是检测周期长,不适用于快速、高通量集成化鉴别诊断的要求。该试验首次将RT-PCR结合变性高效液相色谱技术(DHPLC)应用于病毒性出血性败血病病毒(VHSV)的检测,以达到快速、准确、高通量集成化检测的目的。DHPLC是利用样品分子通过离子对固定相亲和力的差异,在用流动相洗脱时,不同大小或者不同序列的核苷酸片段分子在固定相上移动速率不同而达到分离的目的[5]。
1 材料与方法
1.1 病毒和细胞系
病毒性出血性败血病病毒(VHSV)、传染性造血组织坏死病病毒(IHNV)、传染性胰脏坏死病病毒(IPNV)、鲤春病毒(SVCV)和鲤鱼上皮瘤细胞系(EPC)均由辽宁出入境检验检疫局实验室保存。
1.2 主要试剂
PCR相关试剂购自宝生物工程(大连)公司PCR产物回收试剂盒购自OMEGA公司,三乙胺乙酰盐(TEAA,色谱纯)购自Transgenomic公司,乙腈(色谱纯)购自Fisher公司。DHPLC缓冲液:缓冲液A为0.1 mmol/L TEAA;缓冲溶液B为0.1 mol/L TEAA+25%乙腈。
1.3 主要仪器
变性高效液相色谱仪器(Transgenomic Wave 4500)为北京环球基因公司产品;Allegra TM21R高速冷冻离心机为Beckman Coulter公司产品;ES-2全波长紫外可见光分析系统为日本Malcom公司产品。
1.4 引物设计
选取病毒性出血性败血症病毒的糖蛋白(glycoprotein)基因序列 ,针对病毒的高保守区域,用Primer Explorer V3软件设计两条特异性引物,引物由宝生物工程(大连)有限公司合成。
1.5 RT-PCR扩增反应
首先用Trizol法从增殖的病毒液中提取病毒的RNA,再用M-MLV反转录酶对病毒RNA进行逆转录,在PCR管中加入提取出的RNA模板5 μL、2 μL dNTP、0.5 μL RNA 酶抑制剂(20 U)、5 μL 的 5 倍逆转录酶浓缩缓冲液、1 μL逆转录酶M-MLV(10 IU),加 DEPC 水至 25 μL。42 ℃反应 60 min,合成cDNA。
对合成好的cDNA进行RT-PCR扩增,反应条件为:引物 F1 和 R1 各 1 μL、10 倍缓冲液 5 μL、Taq DNA 聚合酶 5 U、dNTP 2 μL(含 dCTP、dGTP、dATP、dTTP各10 mmol/L),总反应体系总体积为50 μL。反应条件:94℃变性 5 min;94℃变性 30 s,55℃40 s退火,72℃延伸40 s,共35个循环;72℃,8 min,4℃保存反应产物。
用1.5%的琼脂糖凝胶对PCR产物进行电泳分析,回收目的片段(大小为811 bp),将目的片段与pMD18-T载体连接,连接好的重组质粒在感受态细胞DH5α中进行转化,用OMEGA Kit试剂盒对增殖的菌液进行重组质粒pMD18-T-VHSV-Sp抽提,测序鉴定。将测序结果与GENBANK上公布的多株VHSV核苷酸序列进行同源性比对分析。
1.6 PCR扩增产物的DHPLC分析
DHPLC分析条件:该试验采用PS-DVB&C18DNASep色谱柱(4.6 mm×50 mm,粒度 3 μm),将PCR产物放入DHPLC进样室,上样量为5 μL。预先设定基因片段大小为100~700 bp,检测起始时间为0.5 min,洗脱液起始浓度为缓冲液 A液50.2%,B液49.8%;洗脱液由缓冲液A(0.1 mol/L三乙胺乙酰盐)和缓冲液B(0.1 mol/L三乙胺乙酰盐和25%乙腈)组成,柱温50℃,结束时间为10 min,洗脱液终止浓度为缓冲液A液50.2%,B液49.8%;流速为0.9 mL/min,用紫外检测器在波长260 nm处获得吸光度值,经系统处理后,形成DHPLC峰型图谱,进行分析鉴定。
1.7 实时荧光PCR检测
首先确立荧光PCR的最佳反应条件,分别对反应体系中引物和探针浓度、镁离子浓度、DNA聚合酶浓度、退火温度及循环次数进行优化,建立了如下反应体系为:RNA模板10 μL,5×反转录缓冲液(Mg2+,15 mM)5 μL,0.25 μL dNTP,M-MLV 反转录酶(200 U/μL)0.25 μL,DNA 聚合酶(5 U/L)0.25 μL,上下游引物(10μM)各 1.5 μL,最后用DEPC水补足至总反应体积25 μL。在LC 480荧光PCR仪上进行PCR扩增,反应条件:42℃反转录30 min,95 ℃预变性 5 min;95 ℃ 10 s,60 ℃ 1 min 40个循环。
1.8 PCR-DHPLC检测的特异性分析
分别提取 VHSV、IPNV、IHNV、SVCV 的 RNA,以其为模板按照RT-PCR条件进行扩增反应,同时设立灭菌水为空白对照,对扩增结果进行DHPLC分析。对其扩增结果进行鉴定,观察是否有交叉反应,分析该方法的特异性。
1.9 PCR-DHPLC与实时荧光PCR的灵敏度试验
将提取的VHSV的RNA用紫外分光光度计测其在260 nm波长处的OD值,计算RNA的浓度为3×105pg,将其进行10倍梯度系列稀释,得到模板质量浓度分别为:3×105pg、3×104pg、3×103pg、3×102pg、3×101pg、3×100pg、3×10-1pg,分别应用PCR-DHPLC与实时荧光PCR进行同步检测,确定并比较两种检测方法的检测限。
2 试验结果
2.1 RT-PCR产物的鉴定结果
将病毒性出血性败血症病毒的RT-PCR的扩增产物的测序结果通过DANSTAR序列比对软件与GENBANK上公布的多株VHSV核苷酸序列进行同源性比对分析。同源性均在96%以上,说明RT-PCR扩增所得片段为该病毒的特异性扩增产物。
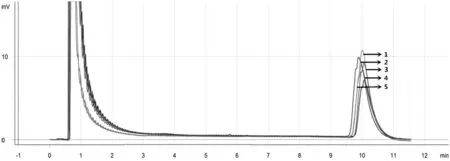
图1 病毒性出血性败血症病毒的DHPLC检测图谱
2.2 PCR扩增产物经DHPLC检测结果
RT-PCR扩增后,将扩增产物经DHPLC分析,5个平行试验均在10.2 min左右出峰时间出现明显的特征吸收峰,且重复性很好,如图1所示。
2.3 PCR-DHPLC检测的特异性试验结果
四种病毒均在相同条件下进行RT-PCR扩增后,用DHPLC检测,设置100~900 bp的相同检测模式下进行分析,病毒性出血性败血症病毒在10.2 min左右的出峰时间检测到了其阳性特征吸收峰,其他三种病毒经检测后在DHPLC分析图谱中均未出现明显的吸收峰。如图2所示。
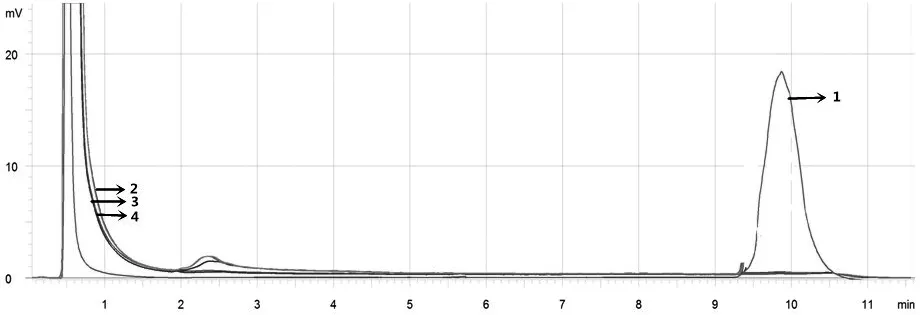
图2 病毒性出血性败血症病毒特异性试验的DHPLC检测图谱
2.4 实时荧光PCR检测结果
采用针对病毒性出血性败血症病毒设计的探针及引物对四种病毒在相同反应条件下进行实时荧光PCR检测,如图3所示,只有病毒性出血性败血症病毒出现特异性扩增曲线,其他三种病毒均无扩增曲线。
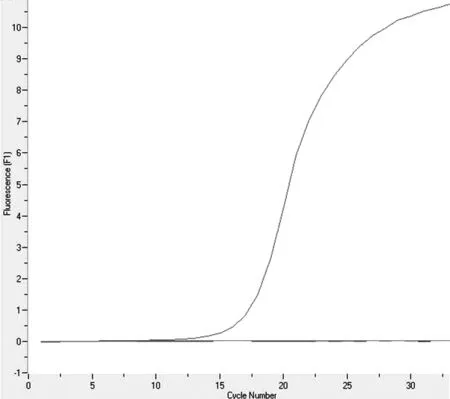
图3 实时荧光PCR特异性检测结果
2.5PCR-DHPLC与实时荧光PCR的灵敏度试验结果
2.5.1PCR-DHPLC的灵敏度检测结果由图4所示,经10倍梯度系列稀释的7个稀释度样品,在DHPLC分析图谱中,最低为3 pg的模板量可出现特征峰。
2.5.2实时荧光PCR灵敏度检测结果由图5所示,5 pg的病毒核酸也出现了“S”型扩增曲线,表明实时荧光PCR的检测限为3 pg,由于加入了一条特异性的荧光探针,使其比普通的PCR在检测灵敏度上高出很多。
3 结论
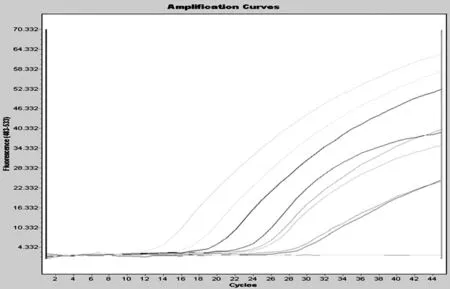
图5 实时荧光PCR灵敏度检测结果
病毒性出血性败血症是一种能够感染鲑鳟鱼类的烈性传染性疾病,主要通过水体扩散传播病毒,在自然条件下受感染的病鱼会通过粪便、尿液等排泄物迅速感染周围鱼类[6]。目前国际上检测病毒性出血性败血症病毒通常采用的方法是细胞培养分离病毒法、血清学方法、以及酶联免疫吸附试验[4]。细胞培养分离VHSV法结果可靠,但是检测周期长,不适用于快速鉴别诊断,因为VHSV是有囊膜的弹状病毒,在用酶联免疫吸附试验对其进行检测时容易与其他鱼类弹状病毒有交叉反应,进而影响到诊断的准确性。

图4 PCR-DHPLC灵敏度检测结果
目前反转录聚合酶链反应法(RT-PCR)是检测该病毒比较常用的检测方法。但是普通PCR需要结合电泳和紫外光成像系统来判定扩增结果,这不仅使得操作繁琐,检测中还需要接触到溴化乙锭、紫外灯,在一定程度上对操作者造成危害,电泳很难检测出模板拷贝数较低的病毒核酸,这可能会产生假阴性现象。荧光PCR检测方法有着高灵敏度的特点,但是成本较高。为了简化检测步骤降低检测成本提高准确性以适应高灵敏度高通量集成化的诊断要求,该试验建立了RT-PCR与DHPLC相结合的检测方法,该方法将RT-PCR的扩增产物用变性高效液相色谱仪进行检测,最低可检测出3 pg的核酸模板,其检测限高于普通PCR两个数量级[7],与荧光PCR的最低检测量一致,并且不需要设计荧光探针,降低了检测成本,试验结果表明该方法特异性较高,与其他弹状病毒无交叉反应,DHPLC特征图谱可精确到几个碱基的差异[8],一次进样可自动检测数百个样品,满足了检测的高通量自动化的要求。综上所述,该方法可应用于进出口岸贸易及水产养殖业对VHSV的快速检测。
