基于CMV启动子表达鹦鹉热衣原体PmpD-N蛋白的重组火鸡疱疹病毒的构建
2018-07-11刘杉杉贾长青沈易华郁建生
刘杉杉,孙 伟,张 稳,2,贾长青,2,罗 杰,2,沈易华,郁建生,2,何 诚
(1.铜仁职业技术学院,贵州铜仁 554300;2.民族中兽药分离纯化技术国家地方联合工程研究中心,贵州铜仁 554300;3.中国农业大学动物医学院,北京 100193)
鹦鹉热衣原体(Chlamydiapsittaci)能够在家禽中引起家禽和鸟类的系统性疾病,该病原能够引起鸟疫,或者被称为衣原体病[1]。国内外和本实验室均有研究表明,在禽群中鹦鹉热衣原体血清阳性率极高[2-4],而且与禽群接触的饲养人员有鸟疫的相关症状出现[5]。鹦鹉热衣原体不仅给养禽业带来经济损失,而且携带衣原体的禽群长期向体外排毒,严重威胁人类健康。因此,需要研制一种价格低廉而且有效的疫苗防控鹦鹉热衣原体的感染。
鹦鹉热衣原体疫苗多是采用主要外膜蛋白(major outer membrane protein,MOMP)基因进行构建的,有研究表明,采用MOMP基因构建的疫苗对于鸡群抵抗鹦鹉热衣原体感染的保护属于不完全保护,而且只能提供同型之间的保护[6]。衣原体保守的多型外膜蛋白D(polymorphic membrane protein D,PmpD)具有泛中和抗体活性,同时可以介导衣原体持续性感染的早期免疫刺激[6]。PmpD蛋白的N端(N-terminal fragment of PmpD,PmpD-N)蛋白可以移位到菌体表面,与细胞膜的其他成分非共价结合在一起,而且PmpD-N的中和抗体可以提供感染早期的免疫保护[7]。因此,含有PmpD-N蛋白的疫苗是一种有价值的鹦鹉热衣原体候选疫苗。
高的抗体滴度不一定能够有更好的免疫保护,而且或许有负面作用,尤其是在菌体分泌方面。在豚鼠和沙眼衣原体感染模型中,体液免疫和细胞免疫在清除感染和防止再次感染方面都发挥了至关重要的作用[8]。因此,能够将鹦鹉热衣原体PmpD-N蛋白递呈到细胞表面并且产生免疫的活载体疫苗是一个很好的选择。
目前以火鸡疱疹病毒(Herpesvirus of turkeys,HVT)为载体构建的活载体疫苗有多种,包括新城疫病毒、传染性法氏囊病病毒、禽流感病毒和艾美耳球虫重组的HVT疫苗,并且有很好的长效的保护效果。在这些重组的HVT疫苗中,Li Y等[9]研制的H7NA重组的活载体疫苗是利用了构建了HVT全长的细菌人工染色体技术(bacterial artificial chromosome,BAC)系统,操作简单,效果好,而且插入的目的基因非常稳定。本试验旨在通过构建含有巨细胞病毒(Cytomegalovirus,CMV)启动子的表达PmpD-N的重组质粒得到真核表达盒,采用BAC系统构建HVT重组子,转染细胞获得重组病毒,为下一步的动物试验奠定基础。
1 材料与方法
1.1 材料
1.1.1试剂脂质体Lipofectamine LTX试剂盒,Invitrogen公司产品;限制性内切酶、T4 DNA连接酶,NEB公司产品;DNA凝胶回收试剂盒、质粒提取试剂盒,Qiagen公司产品;Pfx高保真聚合酶,天根公司产品;ExTaq酶,宝生物工程(大连)有限公司产品。
1.1.2菌株、鸡胚和血清鹦鹉热衣原体CB7株,购自中国兽医药品监察所,经繁殖后保存于中国农业大学动物医学院何诚教授实验室;按常规方法取9日龄~10日龄SPF鸡胚(购自北京市实验动物中心)制备CEF,供转染和增殖重组病毒用;PVAX1载体保存于中国农业大学动物医学院何诚教授实验室;鹦鹉热衣原体6BC阳性血清,将鹦鹉热衣原体6BC株免疫鸡后制备;鸡HVT多抗购自中国兽医药品监察所;鼠PmpD-N多抗,将先前制备的纯化后的PmpD-N重组蛋白与弗氏佐剂乳化后免疫Balb/c小鼠后获得。
1.2 方法
1.2.1目的基因的扩增以CB7 DNA为模板,通过PCR扩增pmpD-N基因。根据pmpD-N基因序列设计1对引物,上游引物酶切位点为KpnⅠ,下游引物酶切位点为EcoRⅤ,引物由上海生工生物工程技术服务有限公司合成。引物序列如下(酶切位点用斜体字标出):上游引物:5′-CGGGGTACCGCCGCCACCATGGGATCCAATGTGTTGATTTCTGGAA-3′;下游引物:5′-AAAGATATCTCAAACAGCCCCACCTGTAGGAGCA-3′。
1.2.2pmpD-N真核表达盒的构建PCR产物经KpnⅠ和EcoRⅤ双酶切后回收并纯化,定向插入表达载体PVAX1的多克隆位点KpnⅠ和EcoRⅤ处,得到重组表达载体PVAX1-pmpD。
1.2.3表达pmpD-N基因的重组火鸡疱疹病毒转移载体的构建采用ExTaq酶扩增PVAX1-pmpD的真核表达盒。上游引物:5′-GTTCCGCGTTAATTAACTTACGGTA-3′,下游引物:5′-TGTTAATTAAGGTTCGCTTGCTGT-3′。引物中均包含了PacⅠ酶切位点(斜体字标注),预期扩增片段为大约2 000 bp。PCR产物经PacⅠ酶切,插入本实验室已经构建好的含有UL45和UL46的pGEM-T载体中构建转移载体,并命名为pHVT-CMV-pmpD-BGH。
1.2.4HVT重组病毒的获得采用内切酶PvuⅡ和NruⅠ对转移载体pHVT-CMV-pmpD-BGH进行酶切,获得带有同源臂和真核表达盒的部分,并与实验室已经构建好的带有galK筛选标记的重组HVT BAC进行同源重组。具体步骤参照文献[10]。将同源重组后获得的阳性质粒转染原代鸡胚成纤维细胞。转染的具体步骤参照Lipofectamine LTX试剂盒说明书。转染后4 d收毒,进行一次盲传。产生病变的为阳性,命名为rHVT-CMV-pmpD。
1.2.5HVT重组病毒的鉴定
1.2.5.1HVT重组病毒的Western blot鉴定收集HVT重组病毒,用细胞裂解液进行裂解后,加入等体积的2×SDS上样缓冲液,混匀,煮沸10 min,进行Western blot分析,一抗采用自己制备的鸡6BC多抗(1∶100稀释),二抗采用的是HRP标记的羊抗鸡IgG(1∶5 000稀释)。
1.2.5.2HVT重组病毒的IFA鉴定将第3代HVT重组病毒感染细胞,3 d后,进行间接免疫荧光(IFA)鉴定,一抗采用自己制备的鼠PmpD-N多抗(1∶100稀释),二抗采用的是FITC标记的兔抗鼠IgG(1∶600稀释)。
1.2.5.3HVT重组病毒的定位检测将HVT重组病毒第3代细胞毒接种含有爬片的长至约80%的CEF细胞中,3 d后用PBS洗2次,采用Confocal进行定位检测,一抗采用1∶100稀释的鼠PmpD-N多抗和鸡HVT多抗,二抗为1∶600稀释的FITC标记的羊抗鼠IgG和568标记的羊抗鸡IgY,最后用1∶5 000 稀释的DAPI(终浓度为0.5 μg/mL)染色细胞核。
1.2.5.4HVT重组病毒的蚀斑检测为更直观地观察HVT重组病毒的病变形态和检测HVT重组病毒的毒价,将需要检测的代次按照10-3、10-4、10-5三个稀释度接种CEF细胞4 d后,进行蚀斑试验检测,一抗采用1∶100稀释的鸡HVT多抗,二抗则采用1∶4 000稀释的HRP标记的羊抗鸡IgY,最后用AEC试剂盒进行染色。
1.2.5.5重组病毒的一步生长曲线将构建好的HVT重组病毒和野生型HVT同时接种CEF细胞,接种剂量均为400 PFU,接种后不同时间收集感染细胞,用蚀斑检测方法对不同时间的病毒含量进行检测。
1.2.5.6重组病毒对HD11细胞产生NO和IL-6的影响将400 PFU的重组HVT和野生型HVT同时接种于长成单层的HD11巨噬细胞,分别于接种后的1、2、4 d收集细胞上清,用NO检测试剂盒(碧云天),按照说明书进行NO含量的检测;同时提取不同时间收集的细胞RNA,用相对定量测定IL-6的含量,内参基因采用GAPDH基因[11]。
2 结果
2.1 HVT重组病毒的获得
将同源重组获得的阳性克隆大提质粒,参照Lipofectamine LTX试剂盒转染原代CEF细胞,转染后4 d收毒,进行一次盲传。结果表明,构建的HVT重组病毒产生了明显病变,且病变形态与野生型HVT基本一致(图1)。

A.野生型的HVT感染CEF产生的病变;B.rHVT-CMV-pmpD重组病毒感染CEF产生的病变
A.Cytopathic effect of parental HVT on CEF cells; B.Cytopathic effect of rHVT-CMV-pmpD on CEF cells
图1HVT重组病毒感染CEF产生的病变(100×)
Fig.1Cytopathic effect of recombinant HVT on CEF cells(100×)
2.2 HVT重组病毒的Western blot鉴定
HVT重组病毒感染的细胞经裂解后,用Western blot进行鉴定,结果表明,HVT重组病毒在大约43 ku处出现目的条带(图2),大小与预期相符。
2.3 HVT重组病毒的IFA鉴定
将第3代HVT重组病毒的细胞毒接种CEF细胞,3 d后用IFA进行鉴定。IFA鉴定结果表明,HVT重组病毒感染CEF后出现明显荧光,而对照细胞无荧光(图3)。
2.4 HVT重组病毒的定位检测
为检测HVT重组病毒各部分蛋白(HVT蛋白和PmpD-N蛋白)的表达,将HVT重组病毒第3代细胞毒接种于长至爬片上的CEF细胞中,3 d后用Confocal进行检测。结果表明,HVT重组病毒的PmpD-N蛋白在胞浆、胞核和细胞表面均有表达,HVT蛋白的表达主要在胞浆和胞核(图4A);HVT感染的细胞,蛋白主要表达在胞核及其周围(图4B)。

M.蛋白分子质量标准;1.rHVT-CMV-pmpD重组病毒感染的CEF;2.野生型HVT感染的CEF
M.Protein molecular weight Marker;1.CEF infected with rHVT-CMV-pmpD;2.CEF infected with parental HVT
图2HVT重组病毒的Western blot鉴定
Fig.2Identification of recombinant HVT by Western blot
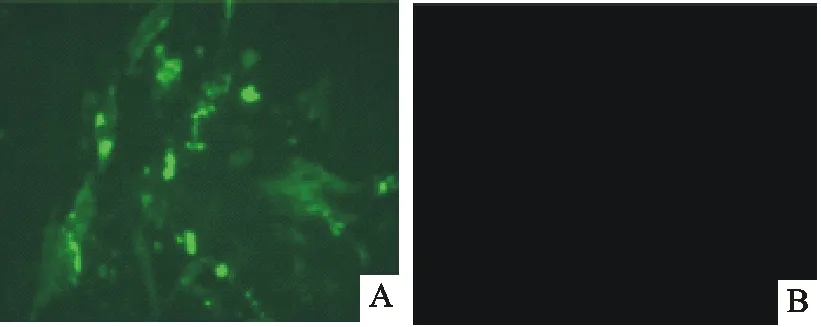
A.rHVT-CMV-pmpD重组病毒感染CEF;B.正常细胞对照
A.CEF infected with rHVT-CMV-pmpD; B.Normal CEF control
图3rHVT-CMV-pmpD重组体表达的IFA鉴定
Fig.3Identification of recombinant rHVT-CMV-pmpD by IFA
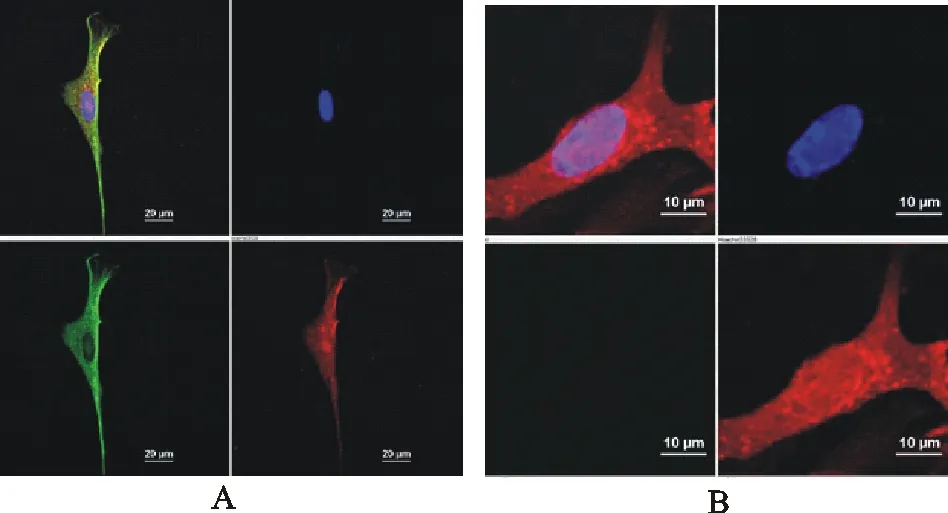
A.rHVT-CMV-pmpD重组病毒感染CEF;B.野生型HVT感染CEF
A.CEF infected with rHVT-CMV-pmpD;B.CEF infected with parental HVT
图4 HVT重组病毒的定位鉴定
Fig.4Identification of recombinant HVT by confocal
2.5 HVT重组病毒的蚀斑检测
HVT重组病毒和野生型HVT同时接种细胞,进行蚀斑检测,并用AEC试剂盒进行染色,结果表明,HVT重组病毒和野生型HVT产生的蚀斑形态基本一致(图5)。野生型HVT和rHVT-CMV-pmpD第4代的细胞毒毒价基本一致,分别为1×106PFU/mL和8×105PFU/mL。
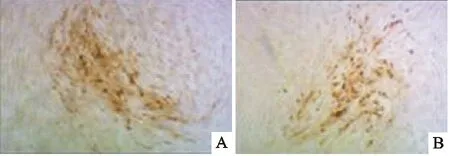
A.野生型的HVT感染CEF产生的蚀斑;B.rHVT-CMV-pmpD重组病毒感染CEF产生的蚀斑(100×)
A.Plaques of parental HVT in CEF cells;B.Plaques of rHVT-CMV-pmpD in CEF cells(100×)
图55野生型HVT和重组HVT感染CEF细胞后产生的病变(100×)
Fig.5Cytopathic effects of parental HVT and rHVT-CMV-pmpD on CEF cells(100×)
2.6 HVT重组病毒的一步生长曲线
将HVT重组病毒和野生型HVT同时接种CEF细胞,用蚀斑法对不同时间收集的感染细胞进行病毒含量的检测。结果表明,HVT重组病毒和野生型HVT的增殖速度相近,48 h时开始有明显升高,经过72 h~96 h的对数增长期后,开始出现明显下降(图6)。

图6 rHVT-CMV-pmpD和野生型HVT的一步生长曲线
2.7 HVT重组病毒对HD11细胞产生NO和IL-6的影响
将400 PFU的HVT重组病毒和野生型HVT同时接种于HD11巨噬细胞后,不同时间的NO和IL-6含量检测结果表明,HVT重组病毒组产生的NO始终显著高于野生型HVT组(图7);HVT重组病毒组从第2天开始产生的IL-6始终显著高于野生型HVT组(图8)。
图7 rHVT-CMV-pmpD对HD11细胞产生NO的影响

图8 rHVT-CMV-pmpD对HD11细胞产生IL-6的影响
3 讨论
在活载体疫苗构建领域,HVT是一种常用的疫苗载体,现在更有已经上市的梅里亚公司生产的HVT和鸡传染性法氏囊病二联苗[12]。本研究中利用HVT载体的优势,将鹦鹉热衣原体的PmpD-N蛋白进行递呈,构建了基于CMV启动子表达鹦鹉热衣原体PmpD-N蛋白的重组HVT,并在体外对其相关特性进行了研究,以期免疫动物体后可以激发高水平的细胞免疫和体液免疫,进而获得高水平的免疫效果。
重组HVT的构建方法主要有经典的同源重组方法和BAC技术构建两种。采用经典的同源重组法构建的步骤比较繁琐,尤其是重组病毒的筛选比较困难,更重要的是最后获得的重组病毒的稳定性不好。而BAC技术构建的重组HVT过程操作简单,构建的HVT稳定性好。BAC通常采用的反向筛选方法包括neo-sacB、ccdB、rpsL-neo和galK。缺失了半乳糖操纵子的大肠埃希菌能够采用基于galK基因的筛选。galK首先插入到BAC载体,重组病毒通过半乳糖作为唯一碳源的培养基进行筛选。galK编码半乳糖激酶,是半乳糖利用所必须的。半乳糖激酶使2-脱氧-半乳糖(DOG)磷酸化,DOG进一步代谢产生有毒性的末端产物。galK通过同源重组的方法被外源基因替代后,由于失去了galK基因,因此可以通过含DOG和甘油的培养基筛选。未发生重组的病毒,由于仍含有galK基因,因此在DOG培养基上产生了有毒的代谢产物。因此,galK可通过正向和反向筛选,而且背景很低,是一种非常便捷有效的筛选方法[10]。本研究在进行反向筛选时发现,在DOG培养基上一般只长出10个左右菌落,鉴定后的阳性菌落大约有3个~7个,阳性率约30%~70%,这对于同源重组来说阳性率是很高的。
构建的疫苗若要激发更好的免疫保护,则需要构建的重组病毒可以将目的蛋白递呈到细胞表面,因此本研究采用Confocal研究目的蛋白和HVT的定位。Confocal试验表明,HVT载体能将PmpD-N蛋白递呈到细胞表面,为下一步的激发免疫反应奠定基础。蚀斑试验进一步表明,构建的重组HVT(rHVT-CMV-pmpD)与野生型HVT相比,病毒的病变状态、蚀斑大小以及增殖速度都未发生改变。
巨噬细胞是吞噬细胞的一种,在动物体内参与先天性免疫和细胞免疫。骨髓中的前体细胞进入血液循环后成为单核细胞,随后分化成巨噬细胞,进而迁移到各种组织中。巨噬细胞在监测、吞噬、摄取抗原、分泌各种促炎性细胞因子以及控制和消除感染中发挥了重要作用[13]。禽巨噬细胞在抵抗微生物的感染和病毒、细菌以及寄生虫感染等方面发挥了核心作用。研究表明,禽巨噬细胞接触病原和PAMPs后,能够激活产生前炎性细胞因子和趋化因子以及抗微生物的ROS和NO,而ROS和NO是抗微生物的军火库,可以控制和清除病原[14]。HD11细胞系是AEV转化禽巨噬细胞样细胞系后获得的,有吞噬能力,能够表达Fc受体和巨噬细胞表面抗原[15]。HD11细胞作为鸡的巨噬细胞广泛应用于体外免疫功能的研究。本研究中,HD11细胞用于阐明重组病毒rHVT-CMV-pmpD对巨噬细胞的功能的影响。研究表明rHVT-CMV-pmpD能够明显刺激巨噬细胞促炎性细胞因子IL-6和NO的产生,对于杀死外界病原、促进免疫应答有至关重要的作用。另外,重组HVT疫苗诱导巨噬细胞活性增强是否通过激活Toll-like受体而发挥效应,以及重组HVT活载体疫苗能否很好地产生免疫保护,还需要进一步深入研究。
