进境水产品中典型异尖线虫恒温实时荧光检测法的建立与应用
2018-07-11柏建山赵尚志张森邓艳黄燕琼何淑华戴金石磊
柏建山,赵尚志,张森,邓艳,黄燕琼,何淑华,戴金,石磊
(1.广州机场出入境检验检疫局国家水产品检测重点实验室,广东广州 510470)
(2.暨南大学食品安全与营养研究院,广东广州 510632)
异尖线虫病是人感染异尖线虫的第三期幼虫引起的疾病,主要是由于食入生的或未熟的海鱼,如寿司和生鱼片等[1]。感染的异尖线虫可以钻入消化道,或移行到其它组织,从而引起人的急腹症症状:如剧烈腹痛、恶心、呕吐、腹泻等[1~4],还能导致人的过敏反应[5~7]。引起异尖线虫病的虫种有6种[8],即简单异尖线虫、典型异尖线虫、抹香鲸异尖线虫、拟地新线虫、对盲囊线虫和宫脂线虫。典型异尖是广大热带及副热带地区的优势虫种,严重威胁了人类的健康[3,4,9],因此建立典型异尖线虫快速准确的检测方法至关重要。
异尖线虫的传统鉴别方法是利用其形态学特征,依据其头端、消化道、尾部结构特征来判断[10]。但各个虫种间形态相似,在不同的生长阶段,其形态、结构存在很大差异,单纯的依靠形态学方法很难鉴定到种间差异。
近年来,利用分子生物学方法鉴定虫种的方法得到发展,如PCR技术。但PCR技术耗时较长、需要在实验室内进行检测,这导致PCR技术很难在基层推广;免疫学方法也因特异性较差而受到限制。
环介导等温扩增(LAMP)技术是一种体外的基因扩增技术[11]。用4条特异性引物识别靶基因的6个区域,并加入两条环引物加速反应,利用一种具有链置换功能的DNA聚合酶(Bst DNA polymerase)在恒温条件(60~65 ℃)反应 30~60 min,即可完成反应。本研究将LAMP技术与实时荧光技术相结合,利用实时荧光技术可以将LAMP反应可视化,进行实时监控,根据扩增曲线判断结果。与普通LAMP技术相比,反应时间更短,反应的灵敏度和特异性更高,操作更为简便,成本更加低廉,适合在基层推广应用。
本研究根据典型异尖线虫 ITS2区域设计特异性引物[12],建立了典型异尖线虫的恒温实时荧光快速检测方法,并且进行了灵敏度、特异性和稳定性验证。
1 材料与方法
1.1 实验材料
1.1.1 虫体来源
典型异尖线虫由广州机场检验检疫局国家水产品检测重点实验室在2015~2016年进境海鱼体中分离鉴定并保存。对比虫体简单异尖线虫(A. simplex)、短棘异尖线虫(A.brevispiculata)、抹香鲸异尖线虫(A.physeteris)、Anisakis nascettii、宫脂线虫(Hysterothylacium Spp.)、对盲囊线虫(Contracaccum Spp.)、颚口线虫(Gnathostoma spp.)均由上述实验室分离鉴定并保存。
1.1.2 主要试剂
Bst DNA polymerase large fragment,美国 New England Biolabs公司;甜菜碱(Betaine)、MgCl2,美国Sigma公司;SYBR Green Ⅰ荧光染料,Life Technologies公司;引物,上海英潍捷基贸易有限公司;DNA提取试剂盒、DNA胶回收试剂盒、18-T载体克隆试剂盒、DH5α菌株、质粒提取试剂盒、Tap酶、Mg2+、dNTPs、PCR10×Buffer反应液均购自宝生物工程(大连)有限公司。
1.2 方法
1.2.1 虫体基因组
DNA提取,将虫体从保存液中取出,置于1.5 mL离心管中,用蒸馏水反复浸泡清洗3次,每隔2 h换水1次,使用Takara公司的Universal Genomic DNA Extraction Kit Ver.5.0试剂盒,按照说明书步骤提取异尖线虫基因组DNA,微量紫外分光光度计检测基因组DNA的浓度,置于-20 ℃冰箱保存备用。
1.2.2 引物设计与合成
GenBank中获得典型异尖线虫 ITS2(AY826724)序列,根据ITS2的保守区,利用在线设计软件Primer Explorer version4(http://primerexplorer.jp/e)进行LAMP引物设计,共设计3套引物,将设计好的引物序列在NCBI网站进行序列特异性比对。Oligo 7.0对引物之间的二聚体、发夹结构、错配等情况进行分析,引物由上海英潍捷基贸易有限公司合成。根据引物筛选试验结果,选取最优引物,最终使用的引物为第二套引物(见表1)。
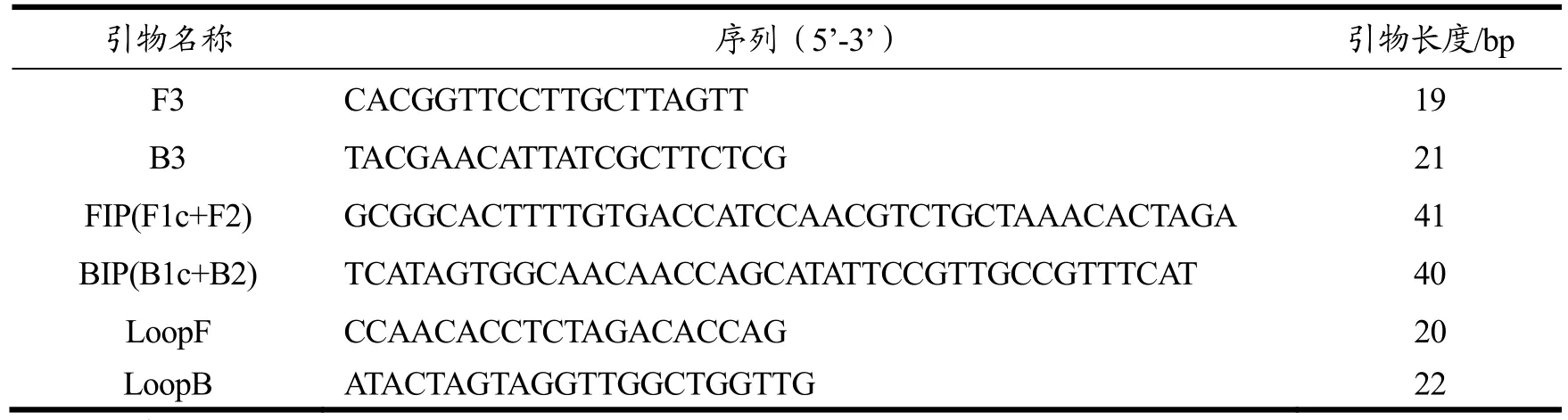
表1 恒温实时荧光法引物序列Table 1 Sequence of primers for the real-time LAMP
1.2.3 质粒构建
用LAMP引物的外引物F3、B3对典型异尖线虫基因组 DNA进行 PCR扩增,使用 Takara公司的Agarose Gel DNA Extraction Kit Ver.4.0试剂盒,按照说明书步骤进行DNA片段的回收,使用Takara公司的pMDTM 18-T Vector Cloning Kit试剂盒,按照说明书步骤进行质粒构建,使用 Takara公司的 Plasmid Purification Kit Ver.4.0试剂盒,按照说明书步骤进行质粒的提取。用NanoDrop2000微量紫外分光光度计检测质粒DNA的浓度,将质粒置于-20 ℃冰箱保存。
1.2.4 恒温实时荧光法反应体系的建立
本研究采用 25 μL反应体系,8 mM dNTP、10×ThermoPol反应缓冲液、120 mM MgSO4水溶液、F3 0.2 μM、B3 0.2 μM、FIP 1.6 μM、BIP 1.6 μM、LF 0.8 μM、LB 0.8 μM、DNA聚合酶8 U、10×SYBR Green I 0.5 μL、待检样品2 μL,用超纯水补齐到25 μL,最后在体系表面加密封油防止污染,将配制好的反应管混匀后离心,以典型异尖线虫DNA为阳性对照,超纯水为阴性对照,于LAMP恒温扩增检测仪(广州双螺旋基因技术有限公司)中63 ℃反应45 min。
结果判读方法:若有“S”型扩增曲线,则判断为阳性,若无“S”型扩增曲线,则判断为阴性。
1.2.5 特异性试验
用建立的恒温实时荧光法对其它寄生虫简单异尖线虫(A. simplex)、短棘异尖线虫(A. brevispiculata)、抹香鲸异尖线虫(A. physeteris)、anisakis nascettii、宫脂线虫(Hysterothylacium Spp.)、对盲囊线虫(Contracaccum Spp.)、颚口线虫(Ggnathostoma spp.)的DNA进行扩增。
1.2.6 灵敏度试验
将含目的基因片段的质粒DNA以10倍的梯度稀释到 1 ng/μL、100 pg/μL、10 pg/μL、1 pg/μL、100 fg/μL、10 fg/μL、1 fg/μL、100 ag/μL、10 ag/μL,取 10 pg/μL~10 ag/μL浓度的模板进行恒温实时荧光法扩增。
1.2.7 与PCR方法比较
用外引物 F3、B3作为 PCR 引物对 10 pg/μL~1 fg/μL质粒模板进行PCR扩增,体系为25 μL:2.5 μL 10×PCR buffer,2 mM Mg2+,0.8 mM dNTPs,0.4 μM F3 引物,0.4 μM B3引物,1.25 U Taq酶(Takara),2 μL DNA模板,用超纯水补齐至25 μL。反应程序为:95 ℃预变性5 min;95 ℃变性45 s、60 ℃退火延伸1 min,40个循环。反应产物在1%琼脂糖凝胶中进行电泳20 min。
1.2.8 实际样品的检测
对广州机场检验检疫局国家水产品检测重点实验室在2015年至2016年,5批次来自热带地区海鱼体内检出的异尖线虫进行检测,共选取41条虫体进行恒温实时荧光法检测,并与 PCR检测方法进行比较。PCR检测方法依据中华人民共和国出入境检验检疫行业标准 SC/T 7210-2011,使用上游引物 390(5’-ATCCGTGTTTCAAGACGGG-3’)和下游引物391(5’-AGCGGAGGAAAAGAAACTAA-3’)对虫体DNA进行扩增,反应体系参照1.1.5,反应程序为:94 ℃预变性 5 min;94 ℃变性 30 s,55 ℃退火 30 s,72 ℃延伸1 min,35个循环;72 ℃延伸8 min。反应产物大小为800 bp左右,送测序公司测序,将测序结果在NCBI网站上进行序列比对。
2 结果与讨论
2.1 恒温实时荧光法反应条件的确定

图1 恒温实时荧光法引物反应效率的检测Fig.1 Detection of the reaction efficiency of the real-time LAMP primers
用3套特异性引物对典型异尖线虫DNA进行恒温实时荧光法扩增,筛选出最优的特异性引物。结果显示,3套引物均能扩增,而第二套引物扩增曲线最标准,出峰时间最短(见图1),所以选取第二套引物作为本研究的特异性引物。
2.2 特异性试验

图2 典型异尖线虫恒温实时荧光法特异性试验Fig.2 Assessment of specificity of the real-time LAMP assay for A.typica
特异性试验表明,对于短棘异尖线虫(A.brevispiculata)、抹香鲸异尖线虫(A. physeteris)、典型异尖线虫(A. typica)、anisakis nascettii、宫脂线虫(Hysterothylacium spp.)、对盲囊线虫(Contracaccumspp.)、颚口线虫(Ggnathostoma spp.)的DNA模板,未产生“S”型扩增曲线,说明没有目的片段扩增,对于典型异尖线虫DNA模板,产生“S”型扩增曲线,说明目的片段能够扩增(见图2),表明建立的典型异尖线虫的恒温实时荧光检测方法具有严格的特异性。
2.3 灵敏度试验

图3 典型异尖线虫恒温实时荧光法的灵敏度试验Fig.3 Assessment of sensitivity of the real-time LAMP for A.typica

图4 典型异尖线虫恒温实时荧光法与PCR方法的比较Fig.4 Comprision of the real-time LAMP for A.typica and theconventional PCR
含目的基因片段的质粒浓度为29 ng/μL,将其稀释到 1 ng/μL、100 pg/μL、10 pg/μL、1 pg/μL、100 fg/μL、10 fg/μL、1 fg/μL、100 ag/μL、10 ag/μL,选取 10 pg/μL~10 ag/μL质粒模板进行恒温实时荧光法扩增,其检测限为1 fg/μL(见图3)。用PCR方法对相同浓度的质粒模板进行扩增,其检测限为100 fg/μL(见图4),恒温实时荧光法的灵敏度比PCR方法高出两个数量级。表明建立的典型异尖线虫恒温实时荧光检测方法具有很高的灵敏度。
2.4 重复性和稳定性试验

图5 典型异尖线虫恒温实时荧光法的稳定性试验Fig.5 Assessment of stability of the real-time LAMP for A.typica
用恒温实时荧光法对最低检测限1 fg/μL的质粒模板进行15次重复试验,验证本研究的稳定性和重复性。对1 fg/μL质粒模板的15次平行试验,均产生“S”型扩增曲线,说明全部扩增,且出峰时间相差不大,扩增曲线标准,重复性良好,阴性对照无扩增,假阳性率为0(见图5)。表明建立的典型异尖线虫的恒温实时荧光检测方法具有良好的重复性和稳定性。
2.5 实际样品的检测
用恒温实时荧光法对5批次来自热带地区的进境实际样品进行检测,并与PCR检测方法进行比较。恒温实时荧光法检测结果与PCR检测结果完全一致,假阳性率为0(见表2)。说明本研究建立的LAMP检测方法适用于典型异尖线虫实际样本的检测。
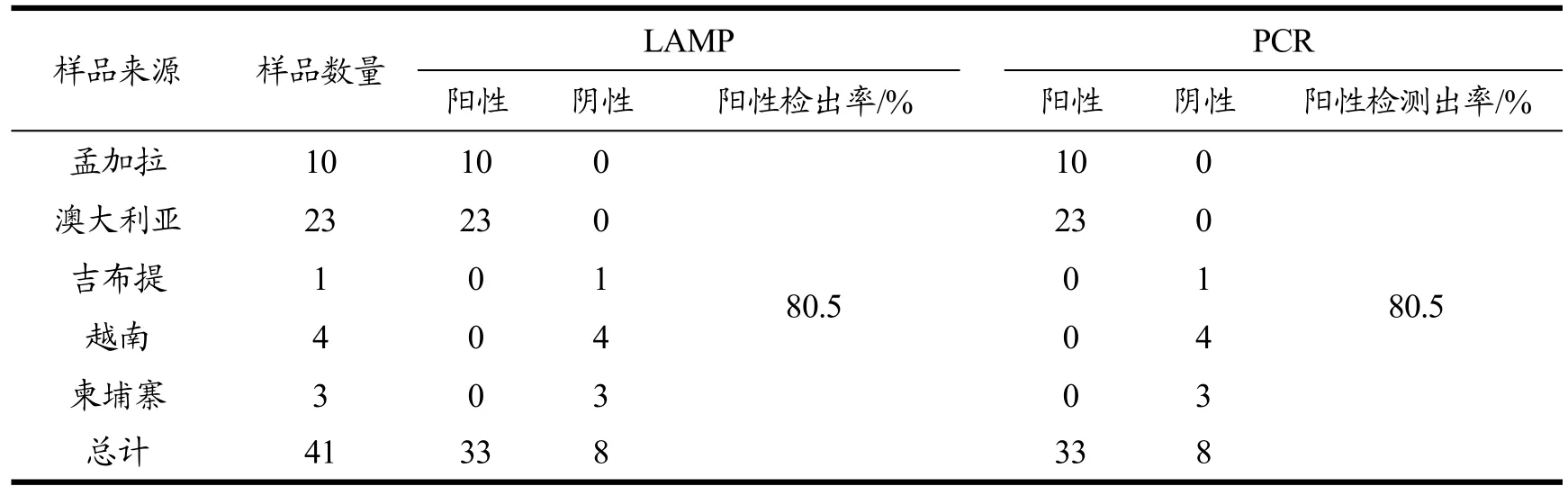
表2 实际样品中恒温实时荧光法和PCR方法检测典型异尖线虫的结果Table 2 Detection results for detrction A.typica by real-time LAMP method and PCR method in samples
3 结论
3.1 自1960年van Thiel在荷兰发现并报道了异尖线虫病例后,国际上感染并报道的异尖线虫病例越来越多。至今,全世界已有超过3万异尖线虫病例,所以异尖线虫日益受到各界的重视,我国已将异尖线虫列为二类禁止入境的寄生虫。我国在2013年报道了首例异尖线虫病病例[13],随着人口流动、文化传播以及国际贸易的全球化,特别是人们生食鱼肉变得越来越普遍,异尖线虫病的发生率也在不断增加,由异尖线虫或其过敏物质引起的过敏反应也在不断增加[14]。在所有的致病种中,典型异尖线虫广泛存在于热带及副热带地区,是很多海域的优势虫种[3,4,9,15,16],广州机场出入境检验检疫局国家水产品检测重点实验室对来自孟加拉、越南和澳大利亚等国家的海鱼进行检测,发现了大量的典型异尖线虫,并且肌肉中的感染率很高,严重威胁了人类的健康。
3.2 为了能够更好的检测典型异尖线虫,有效控制其传播和感染,快速、灵敏和准确的检测方法是必不可少的。LAMP方法已经应用于检测食源性病原的多个领域,如:细菌、病毒、真菌、原虫[17,18],但在蠕虫检测上的应用还很少,影响了蠕虫病病原检测技术的发展。以往,LAMP检测方法的结果判定有凝胶电泳法、显色法、浊度法。凝胶电泳法需要开盖才能完成,可能产生气溶胶污染,而造成假阳性;显色法是最经济的方法,不需要在反应过程中收集信号,只需恒温水浴锅即可完成反应,但显色法需要反应结束后开盖加入显色液,也容易造成扩增产物的气溶胶污染;浊度法包括焦磷酸镁沉淀观察法和实时浊度法,不需要添加额外的试剂,不需要开盖,但焦磷酸镁沉淀观察法存在人为判断的主观性,实时浊度法也因浑浊颗粒不均一和反应液存在不透明颗粒等因素导致较低的灵敏度。为了克服上述方法的不足,恒温实时荧光法不断被发开并应用于实际的样品检测中,它是一种新型的可视化方法,将LAMP技术与实时荧光检测技术有机的结合,可以对扩增过程进行及时判读,在保证高敏感性的同时,使检测结果数据化、形象化,不同于终点判读方法,可以在反应过程中对出峰时间、扩增曲线以及扩增效率进行实时监控,使反应时间更短,在一定程度上避免了假阳性的存在。
3.3 本研究根据典型异尖线虫的ITS2特异性基因,建立了典型异尖线虫的恒温实时荧光检测法,该方法具有灵敏度高、特异性好、方便和快速等优点,灵敏度可达1 fg/μL,反应时间短,45 min内便可完成反应,而传统的PCR方法至少需要2~3 h。在澳大利亚等国家进境水产品中应用该方法进行检测,结果表明该检测方法具有广泛的实用性和良好的应用前景,特别适合于在基层和各进行推广和应用。
