基于铜离子显色反应的磁珠免疫分析快速检测黄曲霉毒素B1
2018-07-11程慧龚蕾李诗瑶彭青枝
程慧,龚蕾,李诗瑶,彭青枝
(湖北省食品质量安全监督检验研究院,湖北武汉 430070)
医学研究表明,黄曲霉毒素B1具有强烈的毒性和致癌性[1~4]。近年来,为了满足现场食品检测的需要,发展各种高灵敏免疫分析方法以用于真菌霉毒素的准确检测方法操作方便,成本较低,且信号转导更加直观简单,因此在实际应用中具有较好发展前景[5~8]。相对于电化学、荧光和电化学发光等信号转导的方法,比色免疫分析法在方法简单、成本低及可快速直接得到结果等方面的优势明显[9~12]。但是,如何提高比色免疫分析方法的灵敏度,降低传统酶催化比色免疫分析方法的检测成本仍然是该领域面临的重要挑战。
最近,大量具有特殊化学结构的有机配体可以选择性地与不同金属离子形成各种不同颜色、具有强吸附性能的复合物[13,14]。基于此,金属离子的显色反应被广泛用于比色法。此外,为了有效降低传统酶催化比色免疫分析方法的成本,同时增强信号转导,一些非酶标记的金属或金属纳米材料被用作标记物[15~19]。这种金属纳米标记物不仅可以直接检测,而且在处理后很容易释放大量的金属离子。将非酶纳米探针和金属离子显色反应相结合,从而发展一种新的免疫比色法[20~23]。
根据之前报道合成的腙类铜离子显色剂可以与铜离子反应生成红色络合物[24],通过紫外-可见吸收光谱法测定该红色溶液的吸光度,或直接通过目视比色法。本实验将磁珠免疫分析与铜离子显色反应相结合,发展了一种基于抗体功能化纳米氧化铜信号示踪的比色免疫分析检测黄曲霉毒素B1。如图1,基于磁珠免疫分析平台,纳米氧化铜标记物和黄曲霉毒素B1被成功应用于免疫反应。定量结合的氧化铜标记物可经酸溶解释放出高浓度的铜离子,加入腙类铜离子显色剂,即可生成红色络合物。基于铜离子和腙类铜离子显色剂形成的红色络合物作为信号转导来源,建立了一种新型比色免疫法用于定量检测黄曲霉毒素B1。
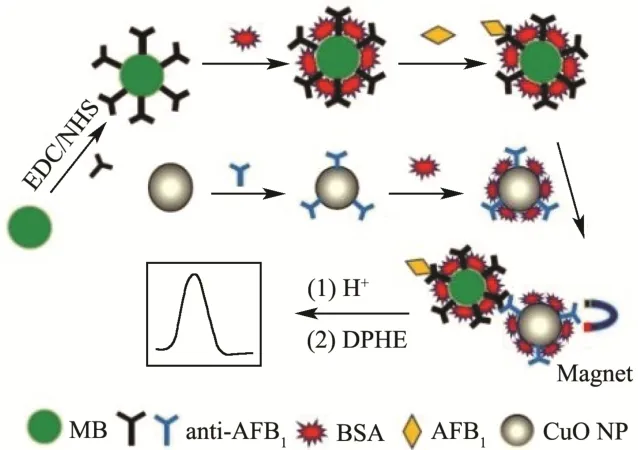
图1 基于抗体功能化CuO NP纳米探针和Cu2+显色反应的免疫分析原理示意图Fig.1 Schematic diagram of immune analysis based on anti-AFB1 functionalized CuO NP probe and Cu2+ chromogenic reaction
1 材料与方法
1.1 实验试剂与仪器
黄曲霉毒素 AFB1标准品购于厦门波生生物技术有限公司;鼠抗AFB1单克隆抗体、AFB1-BSA、驴抗鼠二抗购于武汉博士德生物技术有限公司;2-吗啉乙磺酸(MES)、乙基-(3-二甲基丙基)碳二亚胺盐酸盐(EDC)、N-羟基琥珀酰亚胺(NHS)、腙类铜离子显色剂(DPHE)、CuO NPS均购于美国Sigma-Aldrich公司;四氢呋喃(THF)等其他试剂均购于上海国药化学试剂公司;黄曲霉毒素B1、赭霉毒素A、玉米赤霉烯酮、脱氧雪腐镰刀烯酮、桔霉素、展青霉毒素标准品(纯度≥98%):北京中科质检生物技术有限公司;抗坏血酸、腙类铜离子显色剂,叠氮酸钠(NaN3)、2-吗啉乙磺酸、乙基-(3-二甲基丙基)碳二亚胺盐酸盐、N-羟基琥珀酰亚胺、腙类铜离子显色剂:西格玛(中国)有限公司;黄曲霉毒素B1ELISA检验试剂盒购自北京华安麦科生物技术有限公司;纳米磁珠、氧化铜纳米粒子(CuO NP):美国量子科学仪器公司。PBS缓冲溶液用作洗涤和结合缓冲液,购自北京索莱宝科技有限公司。
UV-3100紫外-可见分光光度计:日本日立公司;酶标仪:赛默飞世尔科技有限公司;AB SCIEX 4500高效液相色谱串联质谱:上海爱博才思分析仪器贸易有限公司;恒温震荡器:苏州吉米诺仪器有限公司。
1.2 实验方法
1.2.1 抗体功能化CuO NP纳米探针的制备
将1 mg CuO NP分散于1.0 mL的10 mmol/L PBS 7.4中超声10 min混匀,向其中加入100 μL 1.0 mg/mL驴抗鼠二抗室温混匀组装4 h,将所得产物离心洗涤除去过量的抗体后,分散于1.0 mL的10 mM PBS 7.4。之后再离心除去多余的 CuO NP后分散于 5%(m/V)BSA溶液中封闭反应1 h。最后,将所得的抗体功能化CuO NP纳米探针经离心洗涤,分散于500 μL pH 7.4的PBS溶液中,4 ℃保存待用。
1.2.2 免疫磁珠的制备
采用EDC/NHS法将纳米磁珠的羧基与鼠抗AFB1单克隆抗体上的氨基偶联。2 mg磁珠用 500 μL MEST(10 mmol/L MES,pH 6.0,0.05%Tween 20)洗涤两次,400 μL MES(10 mmol/L,pH 6.0)重悬浮磁珠后加入2 mg/mL EDC/NHS(现配现用),置于涡旋仪上混匀使其充分悬浮,37 ℃活化 30 min。磁分离移除上清,加入500 μL MEST洗涤两次,PBST(pH 7.4,含1%BSA)重悬后加入 40 μg鼠抗 AFB1单克隆抗体于4 ℃混匀过夜,磁分离移除上清,用500 μL PBST洗涤4次后重悬于1 mL PBST(pH 7.4,含0.02% NaN3,0.5% BSA),4 ℃保存备用。
1.2.3 检测方法及步骤
首先,向制备的40 μL免疫磁珠中加入100 μL不同浓度的AFB1标准样品或样品提取液,室温震荡15 min后通过PBS和PBST洗净。之后,向其中加入140 μL CuO NP纳米探针分散液,继续震荡10 min之后利用pH 7.4 Tris-HCl充分洗净。接着,加入10 μL 0.1 M HCl释放出定量结合的铜离子,接着加入110 μL pH 7.0含有10 μM腙类铜离子显色剂的Tris-HCl/THF溶液,进行显色反应得到红色溶液,通过紫外-可见吸收光谱法测定该红色溶液的吸光度进行定量分析。
2 结果与讨论
2.1 抗体功能化CuO NP纳米探针的显色反应

图2紫外可见吸收光谱图和相应溶液的图像Fig.2 UV-Vis absorption spectra and the photographs of the corresponding solutions(inset)
根据文献方法,铜离子和腙类铜离子显色剂可以形成红色络合物[24]。如图 2,腙类铜离子显色剂的紫外-可见吸收光谱在335 nm处呈现明显的特征吸收,而4.0 μmol/L铜离子溶液在250~700 nm之间无特征吸收峰(曲线a和b)。将4.0 μmol/L铜离子溶液与10 μmol/L腙类铜离子显色剂混合后所得溶液在502 nm处呈现明显的特征吸收,同时,腙类铜离子显色剂在335 nm处的特征吸收峰有所减弱(曲线c)。从插图中我们不难发现在加入铜离子的腙类铜离子显色剂中出现明显的由黄色到红色的颜色变化过程。这一结果表明铜离子和腙类铜离子显色剂反应形成了红色络合物,而且它们紫外特征吸收峰的差别更加有利于避免显色剂对铜离子显色的干扰。

图3 磁珠对不同免疫显色反应紫外可见吸收光谱图Fig.3 UV-Vis absorption spectra recorded by different immunochromatographic reaction
将铜离子显色反应与抗体功能化CuO NP纳米探针相结合以用于免疫反应的信号转导(图3)。通过磁珠免疫分析平台上的免疫反应,纳米氧化铜标记物被定量捕获到磁珠表面形成磁性免疫复合物。在加入酸之后磁性免疫复合物释放出定量捕获的铜离子,该铜离子与显色剂反应生成红色络合物以实现定量分析。从图1B我们可以看出对100 ng/mL AFB1进行该反应之后在502 nm处有较强的吸收峰(曲线a)。然而,若形成磁性免疫复合物后未加入酸,那么在 400~700 nm之间就没有特征吸收峰(曲线b)。同时,背景空白表现的微弱吸收峰主要是由于非特异性吸附(曲线c)。因此,以上现象说明502 nm处的较强吸收峰主要是由于磁性免疫复合物释放铜离子后引起的显色反应,基于免疫磁珠的显色反应可应用于对 AFB1的检测分析。
2.2 条件优化
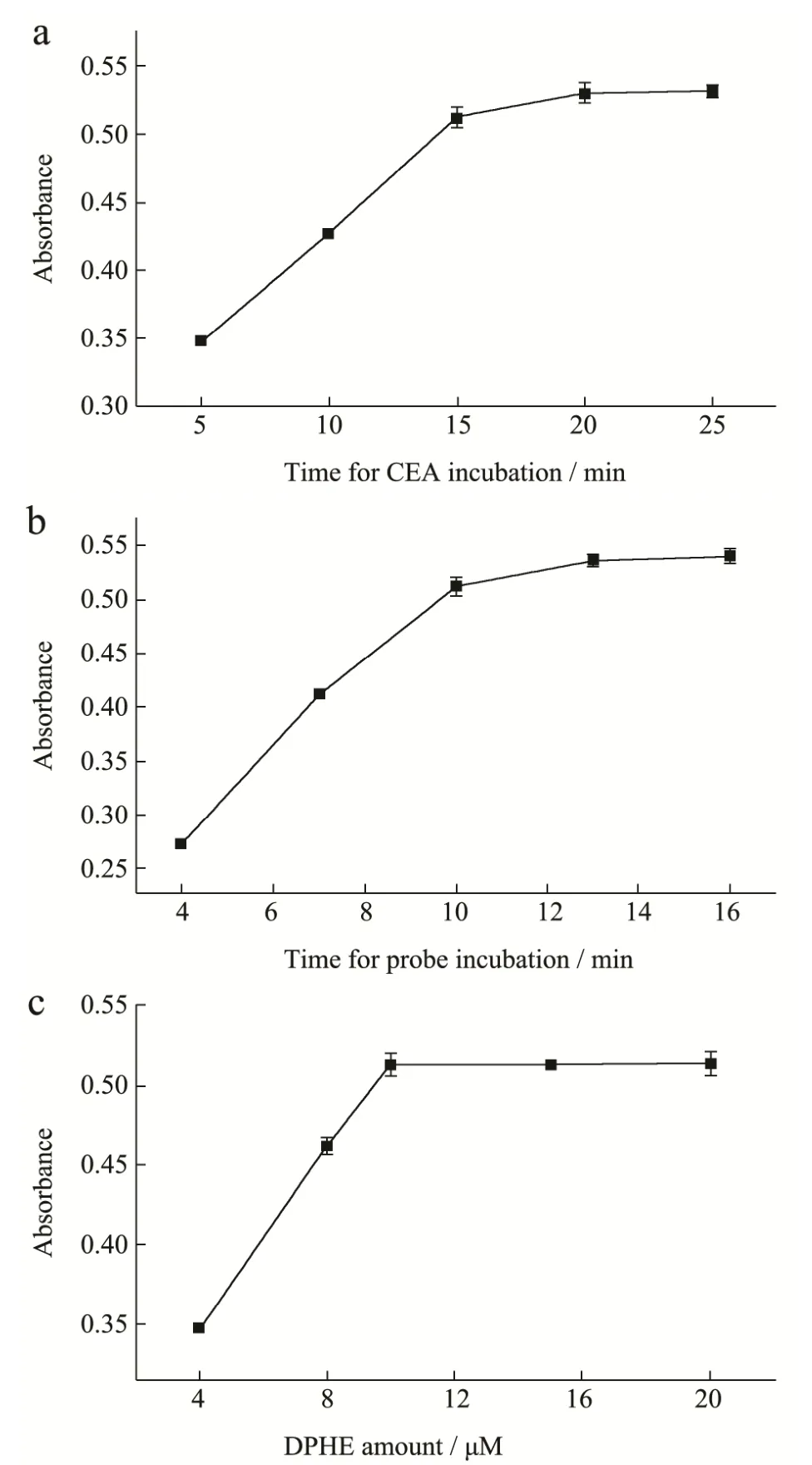
图4 温育AFB1 (a)、纳米探针(b)的时间和DPHE浓度(c)对100 ng/mL AFB1在免疫显色反应上吸光度的影响Fig.4 Effects of the time ofAFB1 (a) and probe (b) incubation,and the DPHE concentration of chromogenic reaction (c) on the absorbance response of 100 ng/mL AFB1
温育时间是影响免疫分析性能的另一个重要因素。实验分别研究了不同温育时间下100 ng/mL AFB1与抗体功能化的CuO NP纳米探针对免疫反应的紫外吸收响应强度的影响。如图2所示,随着免疫反应温育时间的增加,紫外吸收峰的响应强度不断增大,当温育AFB1的时间达到15 min(图4a)以及温育纳米探针的时间达到10 min后响应达到一个平台(图4b)。该结果说明AFB1与纳米探针分别在15 min和10 min时使免疫反应可以达到饱和状态。 为了保证磁性免疫复合物释放的铜离子与显色剂充分反应,实验研究了不同浓度的显色剂对100 ng/mL AFB1夹心免疫反应的紫外吸收响应强度变化。如图4c所示,随着显色剂浓度的增加,紫外吸收峰的响应强度不断增大,当显色剂浓度为10 μmol/L后响应达到一个平台。因此,本实验中所用的显色剂浓度为10 μmol/L。
2.3 分析性能

图5 a图为不同浓度的AFB1的工作曲线,b图为AFB1浓度对应的颜色变化Fig.5 (a) Calibration curve of the different concentrations of AFB1; (b) Color change of the detection solution corresponding to the marked concentrations of AFB1 (ng/mL)
在最优实验条件下,实验通过紫外可见吸收峰考查了不同浓度AFB1在该磁性免疫反应中的响应情况。从图5a可以看出,502 nm处的吸收峰随着AFB1浓度的增加而不断增大,其吸光度与0.01~100 ng/mL AFB1的对数值成较好的线性关系,线性回归方程为:y=0.2998+0.1075lgC (ng/mL),相关系数为 0.995。信噪比为3时,计算得该方法的检测限为35 pg/mL。
2.4 特异性、重复性、稳定性和可靠性
为了考察该方法的特异性,实验分别考察了黄曲霉毒素B1、赭霉毒素A、玉米赤霉烯酮、脱氧雪腐镰刀烯酮、桔霉素和展青霉毒素标准品在该免疫磁珠上的信号响应,质量浓度分别为2 ng/mL、5 ng/mL、10 ng/mL,经免疫磁珠检测,每个浓度重复3次,判断免疫磁珠的特异性,结果见表1,与黄曲霉毒素B1在该免疫磁珠上的灵敏信号响应相比,赭霉毒素A、玉米赤霉烯酮、脱氧雪腐镰刀烯酮、桔霉素和展青霉毒素在该免疫磁珠上并没有引起明显的信号响应,这一结果说明非特异性真菌霉毒素在该免疫磁珠上引起的交叉反应较小,检测方法的特异性良好。

表1 特异性试验结果Table 1 Results of Specificy experiments
将同批和不同批次的免疫磁珠分别检测 5 ng/mL、10 ng/mL、20 ng/mL、50 ng/mL黄曲霉毒素B1标准品,每个质量浓度重复测3次,结果见表2,检测方法的检测结果相对标准偏差(relative standard deviation,RSD)为1.0%~2.5%,表明该检测方法具有较好的重复性。将同一样品分别放置0、0.3 h、0.5 h、0.7 h、1.0 h后测定一次,分别记录吸光度值,结果见表 3。高质量浓度黄曲霉毒素 B1标准品(100 ng/mL)与低质量浓度黄曲霉毒素 B1标准品(1 ng/mL)吸光度值在1.0 h内均变化不明显,由此可以说明样品溶液在避光冷藏条件下放置2.0 h内稳定性良好。
称取3个未知黄曲霉毒素B1含量的大米各5份进行平行性试验,结果见表4。由表4可知,3个黄曲霉毒素 B1含量不同的样品平行实验结果的相对标准偏差均<10%,结果表明该方法精密度良好。在大米样品中添加一定含量的黄曲霉毒素B1标准品,使最终质量浓度为2 μg/kg、5 μg/kg 和10 μg/kg。经提取回收,将高效液相色谱串联质谱、酶联免疫试剂盒所得分析结果与免疫比色法分析结果相比较,结果见表5。由表5可知,免疫比色法回收率在99.3%~117.9%,表明将该方法用于实际样品分析具有良好的可靠性和准确度。

表2 重复性试验结果Table 2 Results of repeatability experiments

表3 稳定性试验结果Table 3 Results of stability experiments

表4 精密度试验结果Table 4 Results of precision experiments
3 结论
本工作发展了基于铜离子显色反应离子的新型免疫比色法用于检测大米中黄曲霉毒素B1。通过在磁珠上共价固定捕获抗体,免疫反应后定量捕获到免疫磁珠表面的铜纳米探针,其在酸的作用下释放出大量铜离子,铜离子与显色剂结合后生成红色络合物,通过紫外-分光光度计检测吸光度。标准曲线及方法学验证结果显示:方法的最低检测限为0.035 ng/mL,免疫比色法的标准线性回归方程y=2.998+1.075lgx(ng/mL),相关系数R=0.995;精密度试验结果RSD为<10%,加标回收率在99.3%~117.9%之间,溶液在避光冷藏放置h内稳定,免疫比色法检测结果与GB 5009.22-2016《食品安全国家标准 食品中黄曲霉毒素B族和G族的测定》液相色谱法及酶联免疫法试剂盒法的检测结果无显著性差异(p>0.05)。结果表明该免疫比色法在实际应用中具有较好的发展前景。
