基于BI-RADS分类多参数乳腺MRI对肿块性病变的诊断效能研究*
2018-07-11柏玉涵李玉萍彭红芬蒋玮丽张东友
柏玉涵,李玉萍,彭红芬,蒋玮丽,张东友
(1.湖北省武汉市第一医院 放射科,湖北 武汉 430022;2.中国人民解放军第二六六医院 放射科,河北 承德 067000)
乳腺MRI乳腺影像报告和数据系统(breast imaging reporting and data system, BI-RADS)是由美国放射学会(american college of radiology, ACR)组织编写的一个国际专家共识(包括各种形态特征定义和图解、乳腺MRI检查技术因素及动态曲线描述)。根据病灶结构特征和动态增强曲线在鉴别良、恶性肿瘤的特点后,提出相应的指导处理病灶原则。目的是对乳腺MRI报告的用词进行标准化,帮助临床医师理解MRI报告和选择处理方式,帮助不同研究之间的交流。本研究旨在评价乳腺MRI BI-RADS分类对肿块性乳腺病变的阳性预测价值(positive predictive value,PPV);确定并证实肿块性病变基于BI-RADS分类最具恶性预测价值MRI特点,并对乳腺肿块性病变的动态增强磁共振(dynamic contrast enhanced magnetic resonance imaging, DCE-MRI)征象、功能磁共振成像(diffusion weighted imaging-apparent diffusion coefficient,DWI-ADC)值进行分析,探讨两者联合应用对该类良、恶性病变诊断的价值,提高对BI-RADS乳腺肿块性病变诊断的特异性和准确性。
1 资料与方法
1.1 研究对象
选取2012年12月-2015年12月该院经乳腺MRI诊断为BI-RADS的肿块性病变患者(180例,194个病灶),病变均经DCE-MRI和DWI扫描,且得到手术或穿刺活检病理证实。其中,年龄18~77岁,平均45岁。纳入标准:①所有病例均有最终病理结果,获取病理结果的方式包括活检或手术;②符合实验设计的统一检查程序和参数;③临床报告给出BI-RADS分类预测和良、恶性预测;④MRI检查前3个月未活检或局部手术,避免血肿干扰。排除标准:①新辅助化疗干扰;②其他原发恶性肿瘤或者系统性疾病。
1.2 检查方法
MR HDXT 3.0T 4通道相控阵乳腺专用线圈,患者取俯卧位,双乳自然悬垂。扫描序列包括:①横轴位SE EPI/DWI,TR 8400 ms,TE 93.8 ms,并行采集因子 2,b值1 000 s/mm2,矩阵128×128,激励次数(number of excitation,NEX)=2;②横轴位脂肪抑制FSE/T2WI,化学饱和法脂肪抑制,TR/TE 4700 ms/78 ms,矩阵320×256,NEX=2,视野320 mm×320 mm,层厚4 mm,层间距 1 mm;③横轴位 FSE/T1WI:TR/TE 500 ms/9 ms,NEX=2,视野320 mm×352 mm,矩阵320×224,层厚4 mm,层间距1 mm;④动态增强:采用体积成像乳房评估序列,TR 4.7 ms,TE 2.2 ms,矩阵320 mm×320 mm,层厚1.0 mm,176层横轴位扫描。动态增强重复6次,每次扫描时间120 s(时间分辨率),其中第1次为预扫描,第1次扫描结束后经肘静脉团注造影剂钆喷替酸葡甲胺,速度2 ml/s,按照0.1 mmol/kg给药,注射后用20 ml生理盐水冲刷。
1.3 图像处理与分析
ADW4.5图像处理工作站(美国GE公司)完成图像处理:①时间-信号曲线(time-to-intensity curve,TIC)测量:第1增强时相强化率≥120%病灶均需测量TIC,测量感兴趣区(region of interes, ROI)<3个体素,ROI尽量小以避免部分容积效应。体积较大病灶取多点测量,取最代表恶性的曲线纳入计算。曲线分类参照KUHL等[1]划分方式,但第2增强时相后强化率降低>20%定义为廓清型曲线(Ⅲ型),扫描时间内波动±20%者定义为平台型曲线(Ⅱ型),持续强化>20%定义为流入型曲线(Ⅰ型);②ADC值测量:在b=1 000 mm2/s图像上高于乳腺实质信号和TIC测量病灶均进行ADC测量,ROI<3个体素。对较大病灶、同一病灶内不同信号特征的部分均需多次测量,单个病灶多点测量时取最小值纳入计算;③图像分析:由2位有经验MRI医师采用双盲法独自阅片常规MRI图像分析。肿块性病变定义为肿块性病变在三维空间上有明确的占位效应,推压周围正常的乳腺或脂肪,单个肿块性病变内部不会夹杂脂肪或正常腺体组织。依据2013版最新修订BI-RADS词汇对每一个肿块性病变进行描述,肿块形状分为椭圆形、圆形及不规则形;边缘描述分为清晰与不清晰(又分为毛刺与不规则);内部强化特征分为均匀强化、不均匀强化、边缘强化及内部分隔不强化;依据形状是否规则、边缘是否清楚将病变分为良、恶性。内部强化、均匀强化及内部分隔不强化归为良性,不均匀及边缘强化归为恶性。TIC为Ⅰ型归为良性组,Ⅱ型和Ⅲ型归为恶性组。
1.4 病理学分析
穿刺或手术切除后的标本,经苏木精-伊红染色法和(或)免疫组织化学法染色后,由指定的乳腺病理学专家进行诊断。
1.5 统计学方法
数据分析采用SPSS 13.0统计软件,以病理结果为金标准,计算各种成像参数诊断的PPV和Kappa值;采取多因素Logistic回归分析各观察指标对肿块良恶性的预测概率,以DWI-ADC值指标、常规BI-RADSMRI、ADC+常规BI-RADS-MRI作为新变量,做ROC曲线,并计算曲线下面积。P<0.05为差异有统计学意义。
2 结果
2.1 病例构成
194个肿块病变均经穿刺或手术得到病理证实。其中,恶性125例,良性69例;125例恶性病灶,5例行穿刺活检,21例行病灶局部切除,26例行局部扩大切除,67例行单侧乳腺全切,3例行双侧乳腺全切,另有3例处理方式未知;病理类型、BI-RADS分类及各分类PPV见表1。126个病灶划为BI-RADS Ⅴ类,114例证实为恶性,21个病灶划为BI-RADS Ⅳ类,6例证实为恶性;39例BI-RADSⅢ类病灶中5例病理证实为恶性。
2.2 各观察指标诊断效能
以病理结果为状态变量,绘制ADC值ROC曲线,及ROC曲线下面积(AUC)为0.871,且对应的良、恶性诊断最佳界值为1.18×10-3mm2/s。各种成像参数诊断PPV和Kappa值(见表2)。以病理结果为因变量,各种成像参数MR诊断结果(包括ADC值、形状、边缘、内部强化及TIC类型)为自变量,进行多因素Logistic回归分析;以P≤0.05为选入变量标准,以P≥0.10为剔除变量标准,逐步排除统计学意义不大的观察指标,计算O^R值;各BI-RADS-MRI观察指标Logistic多因素回归分析结果见表3。回归分析结果表明,ADC值、边缘及TIC类型对乳腺良、恶性病变诊断能力较强(P<0.05)。ADC值≤1.18×10-3mm2/s、边缘毛刺征及TIC Ⅱ型和Ⅲ型为MRI诊断恶性乳腺肿块性病变的危险因素(P<0.05)。
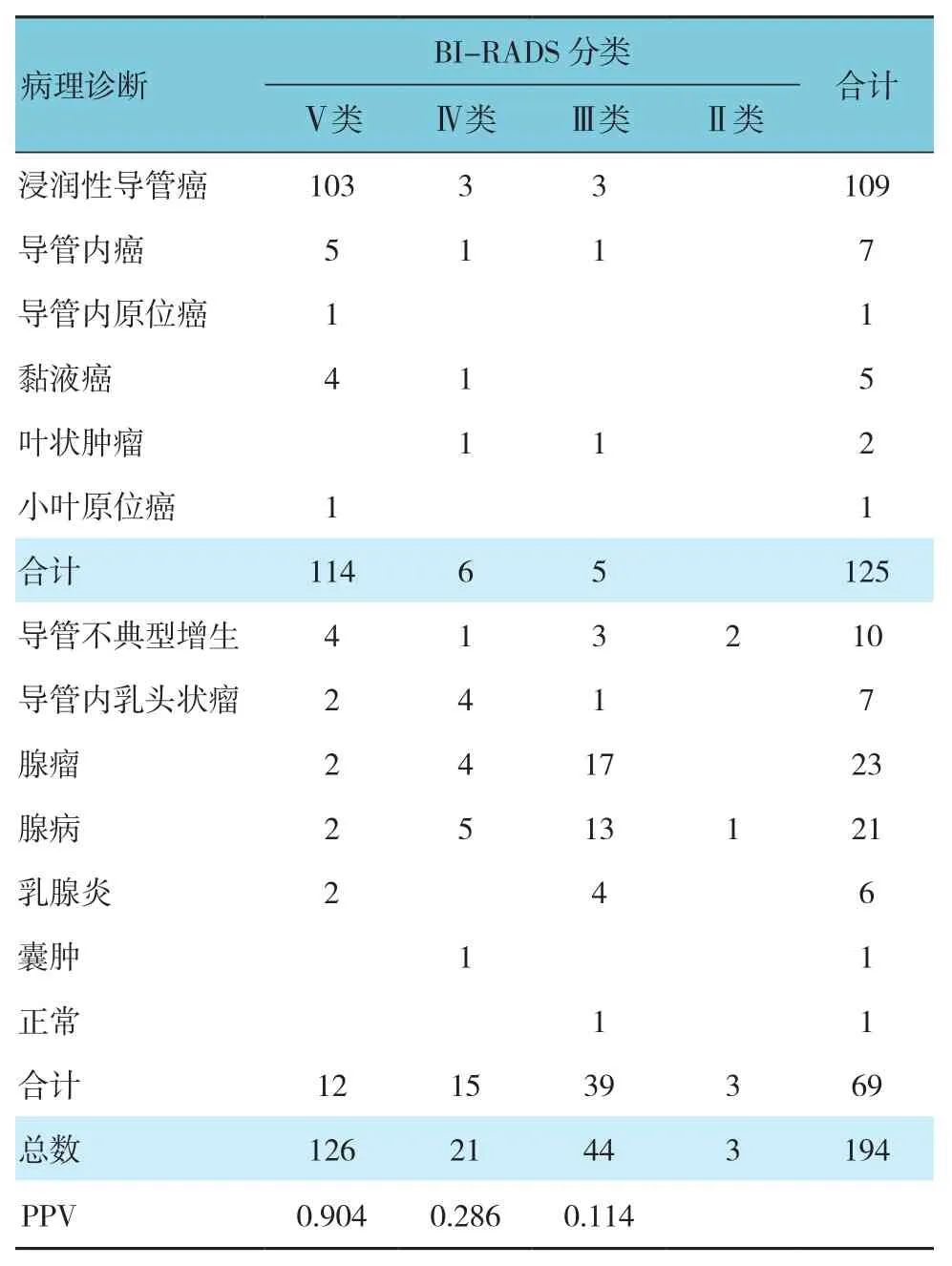
表1 MRI分级与病理的对应关系

表2 各观察指标诊断效能
2.3 DWI-ADC值、常规BI-RADS MRI、ADC+常规BI-RADS MRI诊断效能比较
ADC+常规BI-RADS MRI ROC曲线下面积>DWI-ADC值ROC曲线下面积>常规BI-RADS MRI曲线下面积见表4和附图。
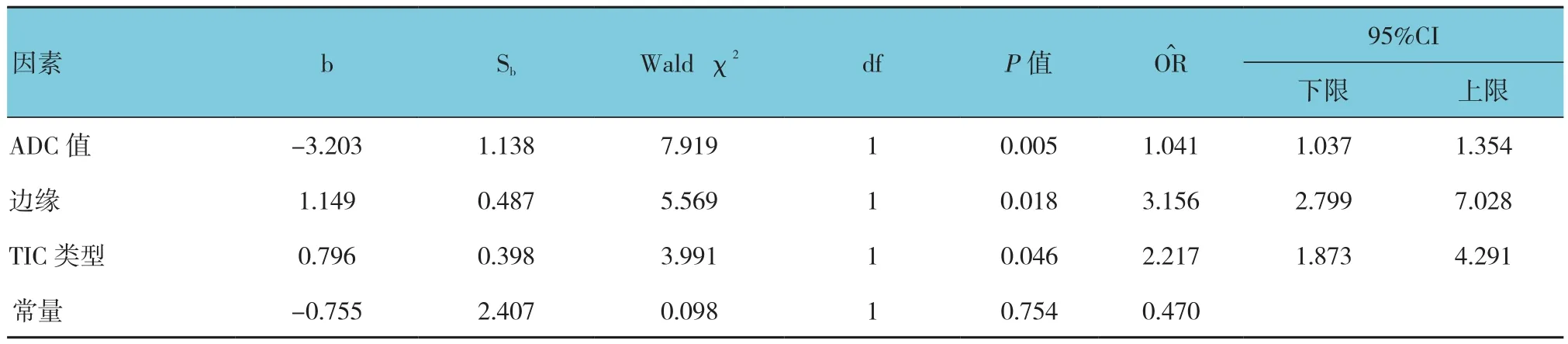
表3 基于BI-RADS MRI观察指标Logistic回归分析相关参数
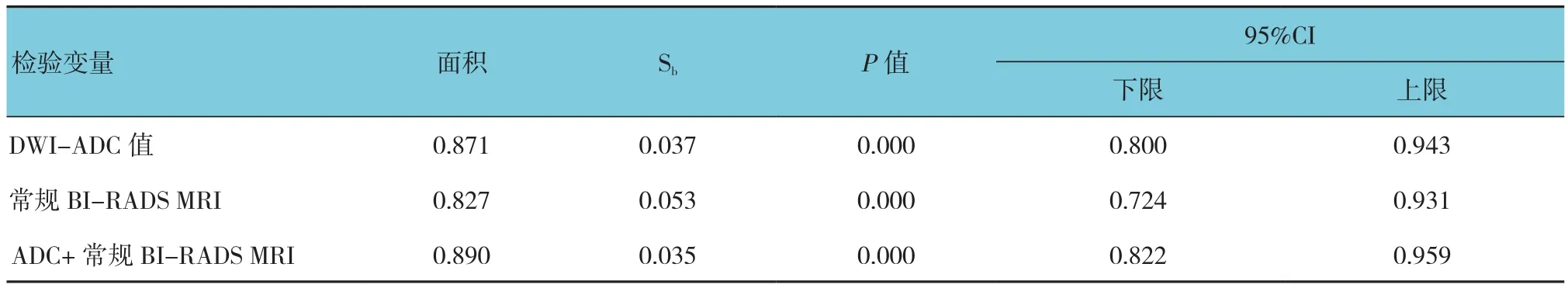
表4 3种诊断指标ROC曲线下面积比较
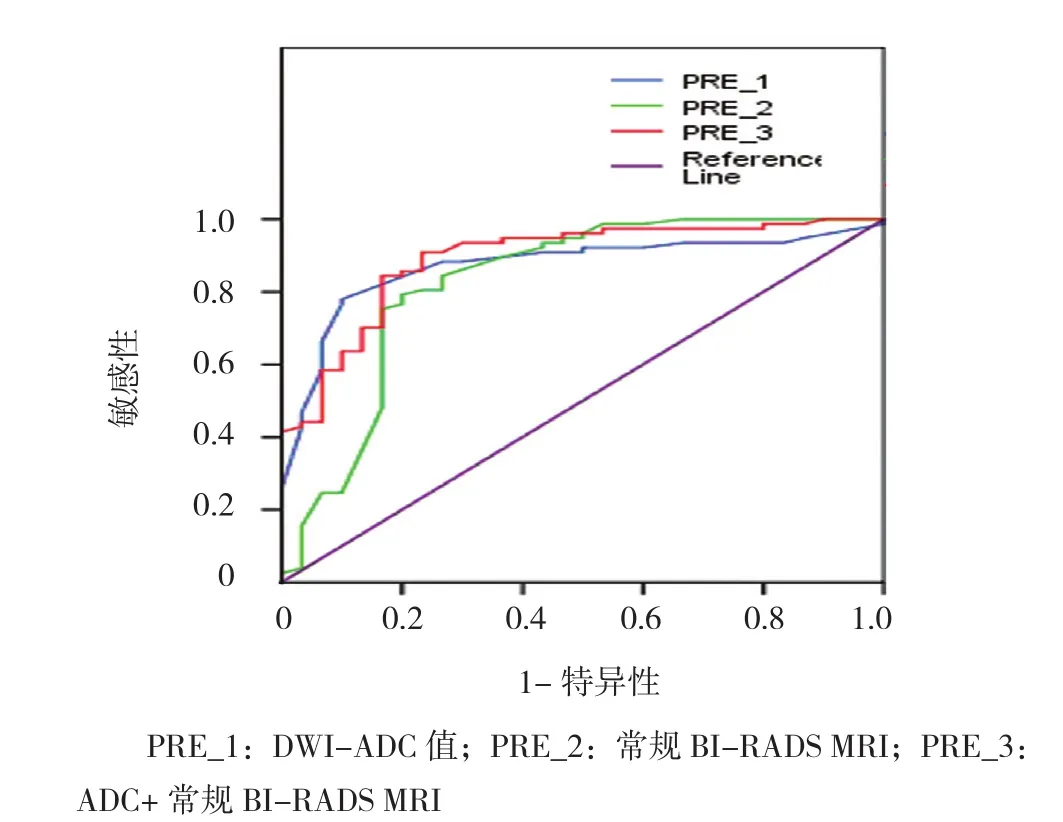
附图 几种不同诊断指标ROC曲线
3 讨论
乳腺MRI临床运用的主要优势在于对乳腺癌检出的高敏感性,早期研究报告指出其敏感性高达94%~100%[2-3]。但由于良、恶性病变MRI表现的部分特点有交叉重叠之处,乳腺MRI对病变检出的特异性较敏感性低很多[1,4-6]。由于乳腺MRI成像技术有很大差异性,导致影像表现也有差异,影响观察者对影像表现的解读和报告内容,不利于临床处置和随访检测。相较于钼靶和超声图像运用BI-RADS评估乳腺病变的明确标准和广泛运用,关于BI-RADS-MRI对病变(尤其是BI-RADS Ⅲ、Ⅳ类病变)指导的标准及运用相当有限,所以规范乳腺MRI报告变得非常必要。
本研究中,MRI-BIRADS Ⅳ类病灶的PPV与文献持平[7-8]。文献中对BIRADS Ⅲ类病变,其恶性概率0.8%~10.0%[9-10],差距大除试验设计、入组标准不同外,还有各个机构对于BI-RADS 3类定义不尽相同。SADOWSKI等[11]对79例BI-RADS MRI Ⅲ类的患者进行随访14~18个月后发现,其中6%为恶性,且BI-RADS MRI Ⅲ类中恶性概率高于钼靶BI-RADS Ⅲ类的概率。
有研究对BI-RADS Ⅱ、Ⅲ类病变的临床处理原则提出不同看法。法国学者MARTINE BOISSERIE等[12]通过对218个BI-RADS Ⅲ类病变进行1年的追踪观察。SPICK[13]对192例MRI诊断为BI-RADS Ⅱ类病变回顾性统计分析,建议对BI-RADS Ⅱ类病变无进行活检的必要。
乳腺常规MRI一般通过基于动态增强扫描显示的病灶形态特征(包括观察病灶形状、边界、边缘及病灶强化方式),判断病变的良、恶性。形态学特征能反映病变的生长方式。由于多数恶性肿瘤呈浸润性生长方式,形态一般表现为不规则,边缘呈星芒状或蟹足样毛刺,边缘不清。BI-RADS-MRI发布之前,国外已有很多研究评估运用乳腺MRI中病灶形态学及动力学特点来预测其良、恶性价值。如NUNE等[14]研究表明,边缘光滑或分叶对良性病变有97%~100%的预测率,而环形强化能预测79%~92%的恶性病变。但基于形态学的乳腺MRI未形成1个标准化的分级系统,有很多局限性。2003年,ACR公布BI-RADSMRI评分系统后,乳腺MRI日臻成熟运用于临床,同年ACS将乳腺MRI作为乳腺癌筛查工具。BAUM[15]指出,BI-RADS结合动力学的参数和形态学特征,较以前乳腺MRI的评分系统,能提供更多更细的分析。SHIN等[16]研究表明,依据BI-RADS-MRI的特征,对病变预后评价也有很大意义:边缘毛刺的病变预后相对较好,而环形强化和延迟期廓清的癌灶预后较差。PASCAL[17]通过研究也推测动态期强化,达峰时间短且体积较大的病变预后较差。HANAA等[18]将Fischer评分系统与BI-RADS-MRI相结合,将BI-RADS分类用评分方式标准化,指出这种方法诊断恶性病变的敏感性、特异性分别为96%、67%,对乳腺BI-RADSMRI初学者很有帮助,也为乳腺MRI诊断标准化提供新思路。TOZAKI等[19]在一项回顾性研究中发现,乳腺肿块性病变边缘分叶及不规则形状是预测其为恶性病变最具预测价值的形态特征。WENDY等[20]对855个乳腺病灶回顾性分析研究发现,最具乳腺癌预测性诊断的模型是综合性临床指标、肿瘤大小及血流动力学状况。
DCE-TIC反映病变的血管密度、肿瘤血管通透性及肿瘤间质容积比。DCE-MRI空间分辨率、时间分辨率均较高,可无创检测乳腺肿瘤微血管改变。时间信号强度曲线类型和乳腺病变性质具有一定的相关性[21]。有研究表明[22-23],乳腺病变的血流动力学特征可减少形态学可疑恶性病灶的假阳性率。GWEON[24]最近的研究更是提出,若形态学可疑恶性病灶增强强度未达到阈值的50%或者延迟未呈流出型,应考虑对病灶追踪复查而不是活检。
ADC值反映肿瘤的细胞密度、通透性及灌注状态。WOODHAMS等[25]报道ADC阈值为1.6×10-3mm2/s时,敏感性和特异性最高。KUL等[26]研究ADC值的阈值为0.92×10-3mm2/s,敏感性和特异性为91.4%、86.5%,原因除灌注效应、样本量的影响,被提及的因素还包括细胞密度、肿块大小及测量方法不同等。JIN、WOODHAMS等学者[25,27]认为,ADC值与细胞密度及细胞增生有关,并呈反比例关系。
综上所述,联合应用DCE-MRI与DWI诊断乳腺肿块性病变诊断效能大大提高,对肿块性病变动态增强MRI和DWI联合应用提供大量的诊断信息,并提高MRI诊断效能。因此DWI是对BI-RADS规范化诊断的一个重要补充,DWI应纳入乳腺MRI常规标准化检查程序中。
