2型糖尿病周围神经病变患者外周血CD4+调节性T细胞与25-(OH)D3的关系及其意义*
2018-07-11秦宏超张真稳
秦宏超,张真稳
(扬州大学临床医学院 内分泌科,江苏 扬州 225100)
糖尿病(diabetes mellitus, DM)周围神经病变(diabetic peripheral neuropathies, DPN) 是DM主 要的慢性并发症之一。≥50%的2型糖尿病(type 2 diabetes mellitus, T2DM)患者合并有DPN,≥1/3的DPN患者存在针刺、烧灼及电击等疼痛症状[1],严重影响患者正常的工作和生活,也是DM晚期致死、致残的主要原因之一。T2DM及其并发症的发病机制涉及多方面,免疫机制也参与其中。由于疾病病因和长期病程,患者免疫功能多受到影响,细胞免疫平衡被破坏,其中T淋巴细胞亚群的变化尤为显著。调节性T细胞(T-regulatory cell, Tregs)是一类具有独特免疫调节功能的T细胞亚群,在维持机体的免疫稳态和控制自身免疫病的进展方面具有重要作用[2]。维生素D(vitamin D, VD)除作为钙、磷代谢调节剂参与骨代谢外,还具有免疫调节作用(包括调节Tregs各个亚群比例、促进CD4+T分化及上调Tregs活性等)。血清25-羟维生素D3[25-(OH)D3]在DPN患者的糖代谢、营养神经、氧化应激及免疫调节方面均发挥作用[3-5],与DPN具有相关性[6]。本文旨在探讨DPN患者25-(OH)D3和CD4+Tregs的关系及其意义,为DPN的发生机制和治疗提供依据。
1 资料与方法
1.1 一般资料
选取2017年1月-2017年7月该院就诊的T2DM患者42例。其中,男性26例,女性16例;病程1~40年,平均10.5年;年龄35~86岁,平均(60.36±12.22)岁。所有患者均符合1999年世界卫生组织的DM诊断标准。排除标准:①非DM因素导致的神经病变(如腰椎病变、VB12缺乏及格林-巴利综合征等)、甲状腺功能亢进症及恶性肿瘤等;②合并有DM高渗昏迷、低血糖及DM酮症酸中毒等急性并发症;③合并有各类急性或慢性感染;④有骨质疏松和其他骨代谢异常疾病病史;⑤肝肾功能障碍、心功能不全及甲状旁腺疾病;⑥半年内使用过甲状旁腺激素、降钙素、类固醇激素、VD制剂及性激素等药物。
1.2 方法
1.2.1 一般资料采集 记录每位患者性别、年龄、DM病程等一般数据,测量身高、体重,计算体重指数(body mass index, BMI)。
1.2.2 实验室检查 所有受试者空腹≥8 h,于次日清晨抽取静脉血,采用AU2700型全自动生化分析仪(美国贝克曼库尔特公司)测定TG、TC、HDL-C、LDL-C、Scr、BUM及尿微量白蛋白(urine microalbuminuria,UMA);采用糖化血红蛋白测定仪(美国Bia-rad公司)对HbA1c水平进行测定。
1.2.3 VD3水平测定及分类 抽取所有受试对象空腹静脉血,采用25-(OH)D3试剂盒(英国IDS公司)用酶联免疫吸附测定法测定。依据25-(OH)D3的水平:≤50 nmol/L为VD3缺乏;50~75 nmol/L为VD3不足;≥75 nmol/L为VD3充足[7]。
1.2.4 CD4+Tregs检测 使用PF-anti-CD25/FITC-anti-CD4荧光标记抗体(美国Serotec公司)标记两组分离好的单个核细胞样本,采用流式细胞仪(美国BD公司)进行Tregs检测,采用CXP Cytometer(美国贝克曼库尔特公司)对数据进行收集和分析。
1.2.5 DPN诊断 对受试者使用肌电诱发仪(日本光电工业株式会社)进行肌电图检查。确诊DPN标准[8]:在明确诊断DM同时或之后出现神经病变,临床表现与DPN表现(麻木、疼痛及感觉异常等)相符;5项检查(温度觉、足部感觉、踝反射、振动觉及神经传导速度)≥2项为异常。
1.3 统计学方法
数据分析采用SPSS 16.0统计软件,计量资料以均数±标准差(±s)或中位数(四分位数)表示,比较用t检验,不满足或用轶和检验,相关分析采用Pearson法或Spearman法,P<0.05为差异有统计学意义。
2 结果
2.1 两组临床资料比较
两组年龄、25-(OH)D3水平及Tregs百分比比较,差异有统计学意义(P<0.05);两组 BMI、HbA1c、UMA、BUM、Scr及血脂分析等比较,差异无统计学意义(P>0.05)。见表1。
2.2 两组外周血25-(OH)D3水平和Tregs百分比的比较
两组外周血25-(OH)D3水平比较,差异有统计学意义(P<0.05),DPN组外周血25-(OH)D3水平比非DPN组更低(P<0.05);两组外周血Tregs百分比比较,差异有统计学意义(P<0.05),DPN组外周血Tregs百分比非DPN组更低(P<0.05)。见表1和附图。
2.3 DPN组外周血Tregs百分比与各临床指标相关性分析
DPN组外周血Tregs百分比与25-(OH)D3呈正相关(P<0.05),与年龄、BMI、HbA1c、UMA、BUM、Scr、TC、TG、HDL-C、LDL-C 无相关性(P>0.05)。见表2。
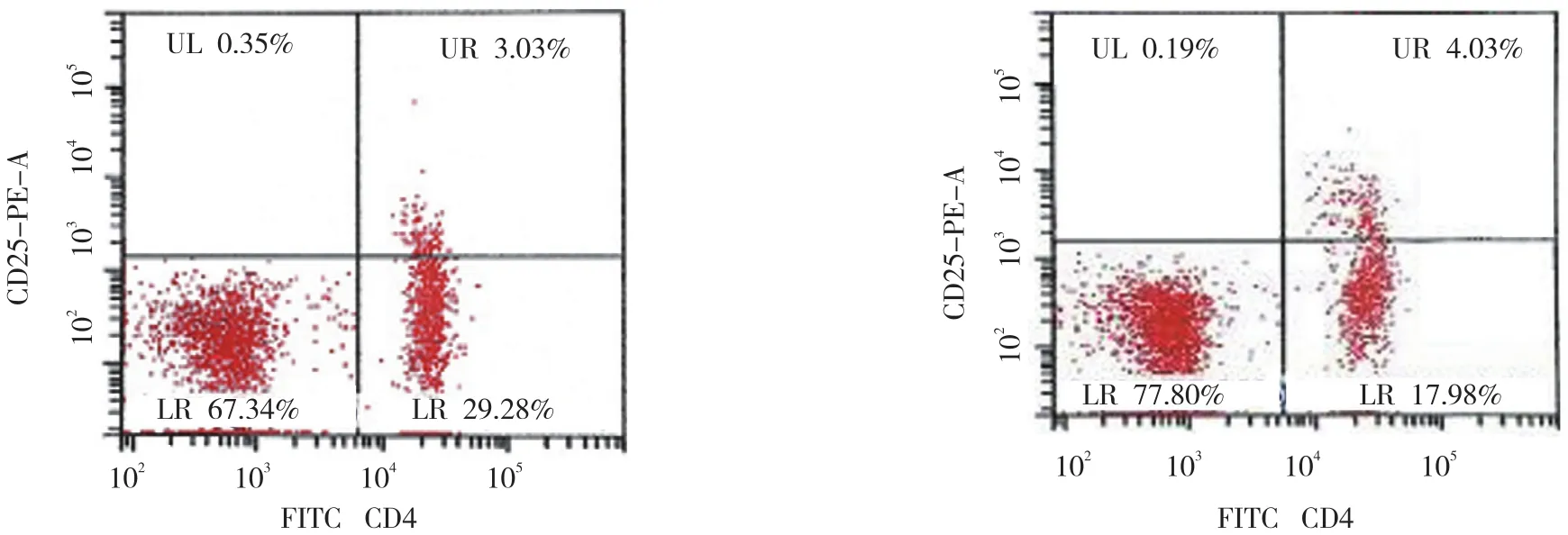
附图 两组Tregs百分比的比较
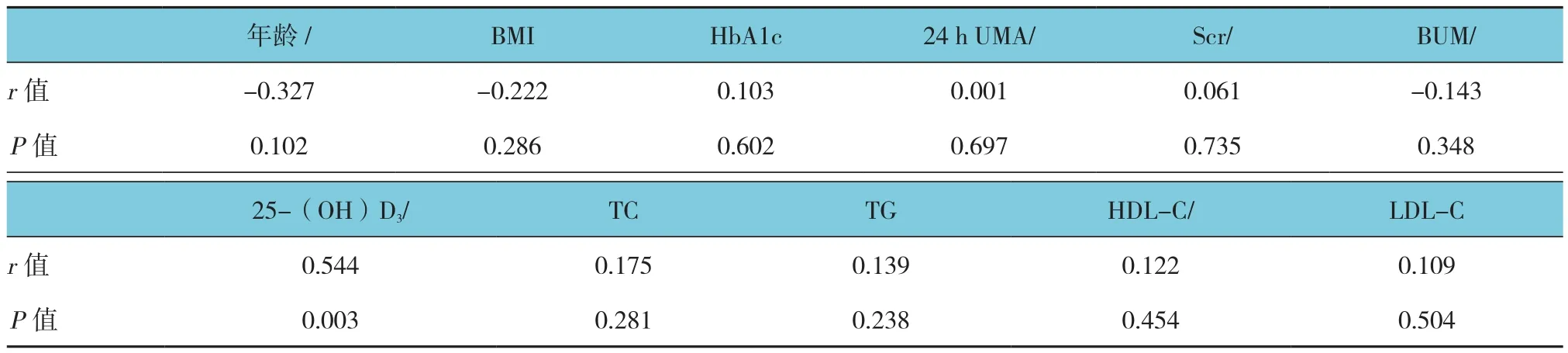
表2 DPN组外周血Tregs百分比与临床指标相关性
3 讨论
近年来,Tregs作为维持机体免疫耐受的一个重要调控者备受关注。研究显示,T2DM外周血淋巴细胞的数量和比例以及相关炎症因子的改变,支持CD4+、CD25+Tregs参与DM微血管病变过程。杨雪等[9]研究发现,DPN患者外周血中CD4+、CD25+Foxp3+Tregs数量减少,可能是导致DPN患者神经组织自身免疫性损伤的原因之一。但DPN发病过程中Tregs所起作用进行的深入研究仍然较少。
VD作为一种脂溶性维生素,主要通过与其受体结合,调控基因转录,进一步发挥其生物学作用。VD在体内的主要存在形式为血清25-(OH)D3,是目前评价VD营养状况最有效指标[10]。多项研究表明,T2DM中VD缺乏与DPN相关,且VD缺乏可作为DPN发病的危险因子[11-12]。SHEHAB等[13]给57例VD缺乏DPN患者补充外源性VD后发现,VD能有效缓解DPN患者的临床症状,使疼痛评分得到改善。充足的VD还可降低中老年人罹患T2DM的风险[14-15]。而低于人群VD水平中位数的T2DM患者,5年后发生微血管并发症的概率增高[16]。VD对DPN的影响机制还不明确,研究证实VD可通过影响微血管功能、抑制炎症反应因子及直接保护作用对外周神经发挥作用[17-21]。笔者早期研究结果显示,T2DM DPN与VD水平有关[22],本研究也证实DPN组25-(OH)D3水平较对照组降低,DPN患者普遍存在VD缺乏现象,进一步证实25-(OH)D3或参与DPN发生、发展。
近期研究表明,VD除经典的钙磷调节功能外,还在免疫调节中发挥重要作用,其主要的靶细胞(包括T淋巴细胞、树突状细胞及巨噬细胞等)抗原递呈细胞。VD可抑制T淋巴细胞的增殖、介导T细胞的凋亡并且改变Th1与Th2细胞之间的比例[23]。有研究表明,25-(OH)D3和转化生长因子β的联合刺激下,可增加FoxP3+调节性T细胞的表达,同时促进原始CD4+T细胞向Tregs分化[24],此结论在URRY等[25]体外实验中也得到证实。PRIETL等[26]临床研究指出,在血清25-(OH)D3充足的正常对照组的外周血淋巴细胞中,Tregs所占比例增高,两者呈正相关。王琦等[27]在动物实验中发现,VD能刺激Tregs分泌的抑制性细胞因子产生白细胞介素10,从而发挥生物学作用。
综上所述,本研究结果支持DPN患者外周血CD4+Tregs与 25-(OH)D3水平相关。25-(OH)D3可通过影响DPN患者Tregs表达而影响DPN的发生、发展,为进一步揭示DPN发病机制提供新方向,VD或成为未来治疗DPN的一个新靶点,其能否通过补充外源性VD来调节T细胞的免疫功能,进而改变DPN进程,则需要更多的临床实验进一步证实。
